慢性乙型肝炎与肝硬化患者乙型肝炎病毒S蛋白变异分析
2020-06-16原永明章晓鹰孙学华
原永明, 章晓鹰, 顾 超, 张 珏, 孙学华
(1.上海大华医院检验科,上海 200237;
2.上海中医药大学附属曙光医院检验科,上海 201203;3. 上海中医药大学附属曙光医院肝炎科,上海 201203)
乙型肝炎病毒(hepatitis B virus,HBV)感染是肝硬化与肝癌的重要危险因子。慢性乙型肝炎(chronic hepatitis B,CHB)的预后转归取决于病毒-宿主的相互作用[1]。HBV具有4个开放阅读框(open reading frame,ORF),分别为S、C、P、X,其中S ORF包含前S1(pre-s1)、前S2(pre-s2)和S区域,编码3个HBV表面糖蛋白,分别为小蛋白表面抗原(由S基因编码)、中蛋白表面抗原(由S和pre-s2基因编码)和大蛋白表面抗原(由S、pre-s2和pre-s1基因编码)[2]。S蛋白即乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg),由226个氨基酸组成,由于S蛋白不仅仅有B细胞表位[3],还含有辅助T细胞(helper T cell,Th)表位与细胞毒T淋巴细胞(cytotoxic T lymphocyte,CTL)表位[4],因此S蛋白在宿主相关的免疫功能刺激中扮演了重要角色[2]。S蛋白变异还能影响病毒颗粒和表面蛋白的分泌,可通过诱导表面抗原合成的不平衡使S蛋白在细胞质内质网中停留,从而引起内质网应急反应,这一机制可能与肝脏疾病的严重程度有关[5-7]。目前,关于我国CHB患者和肝硬化患者S蛋白变异特征及其与CHB严重程度相关性的报道较少。为此,本研究拟探讨CHB患者和肝硬化患者S蛋白变异的临床意义。
1 材料和方法
1.1 研究对象
选取2018年1月—2019年3月于上海中医药大学附属曙光医院肝炎科就诊的CHB患者114例,其中男70例、女44例,年龄5~76岁。参照《慢性乙型肝炎防治指南》[1],将患者分成慢性HBV携带组(41例)、非活动性HBsAg携带组(38例)和肝硬化组(35例)。慢性HBV携带者定义为无特殊症状、HBsAg阳性、乙型肝炎e抗原(hepatitis B e antigen,HBeAg)阳性、HBV DNA高载量(HBV DNA>107IU/mL)、丙氨酸氨基转氨酶(alanine aminotransferase,ALT)正常、天门冬氨酸氨基转氨酶(aspartate aminotransferase,AST)正常[1]。非活动性HBsAg阳性者定义为HBsAg阳性、HBeAg阴性、乙型肝炎e抗体(hepatitis B e antibody,HBeAb)阳性、HBV DNA<2×103IU/mL[1,8]。肝硬化诊断参照中华医学会肝病学分会与感染病学分会发布的诊断标准[1]。所有患者均排除合并其他病毒,如丙型肝炎病毒(hepatitis C virus,HCV)等感染。
1.2 仪器和试剂
DNA提取试剂盒、DNA第1次纯化试剂盒购自德国QIAGEN公司,DNA第2次纯化试剂盒购自美国Applied Biosystems公司。ABI 3500 Dx Genetic Analyzer基因测序仪购自美国Applied Biosystems公司。
1.3 方法
1.3.1 样本采集 采用乙二胺四乙酸抗凝管采集所有对象静脉血3 mL,离心分离血浆。
1.3.2 HBV DNA提取 取200 μL血浆,按试剂盒说明书要求提取HBV DNA。
1.3.3 引物设计 按Genbank数据库中的HBV DNA(HBV genotype B DNA,complete genome,LC0362263;HBV genotype C DNA,complete genome,AB644286)S区序列,利用Primer Primer 5.0软件设计引物,引物序列见表1。2种引物均涵盖整个S蛋白。
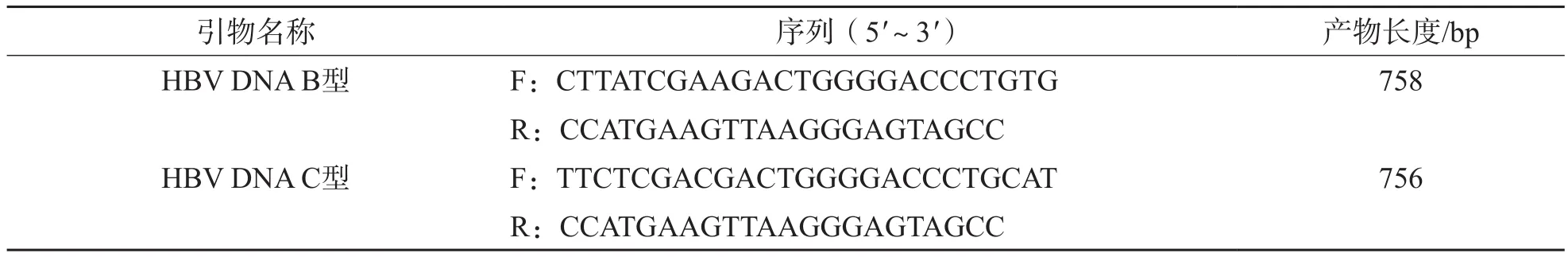
表1 HBV NDA S区引物序列
1.3.4 聚合酶链反应(polymerase chain reaction,PCR)反应条件及S区变异检测 提取HBV DNA后进行第1轮PCR扩增和纯化,纯化后的PCR产物进行第2轮PCR扩增与纯化,最后加入10 μL去离子甲酰胺,短时振荡溶解DNA,95 ℃变性5 min,迅速置于冰上或4 ℃冷却4 min,随后采用ABI 3500 Dx Genetic Analyzer基因测序仪测序。第1轮PCR反应体系:总体积为50 μL,5×PCR buffer 10 μL(含Tris-HCl缓冲液、dNTP、Mg2+)、Taq酶3 μL、10 μmol/L上游引物与下游引物各1 μL(终浓度为200 nmol/L),DNA模板10 μL,补蒸馏水25 μL。第1轮扩增条件:尿嘧啶糖苷酸(防污染)50 ℃ 2 min;95 ℃预变性15 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,40个循环;72 ℃终延伸7 min。第2轮PCR反应体系:总体积为20 μL,DNA模板1 μL,BigDye 2 μL、BigDye Sequencing buffer 3 μL、F引物或R引物0.5 μL(终浓度为250 nmol/L),补蒸馏水13.5 μL。第2轮扩增条件:96 ℃预变性1 min;96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸4 min,25个循环。
1.3.5 数据分析 采用Primer Primer 5.0软件将核苷酸序列翻译成氨基酸,采用BLAST分析软件进行氨基酸序列比对。
1.4 统计学方法
采用SPSS 16.0软件进行统计分析。计数资料以率表示,组间比较采用χ2检验。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,多组间采用非参数Kruskal-WallisH检验后,2个组间比较采用非参数Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
2 结果
2.1 慢性HBV携带组、非活动性HBsAg携带组与肝硬化组一般资料比较
慢性HBV携带组、非活动性HBsAg携带组与肝硬化组之间年龄和HBV DNA载量差异均有统计学意义(P<0.01),性别及HBV基因型差异均无统计学意义(P>0.05)。见表2。
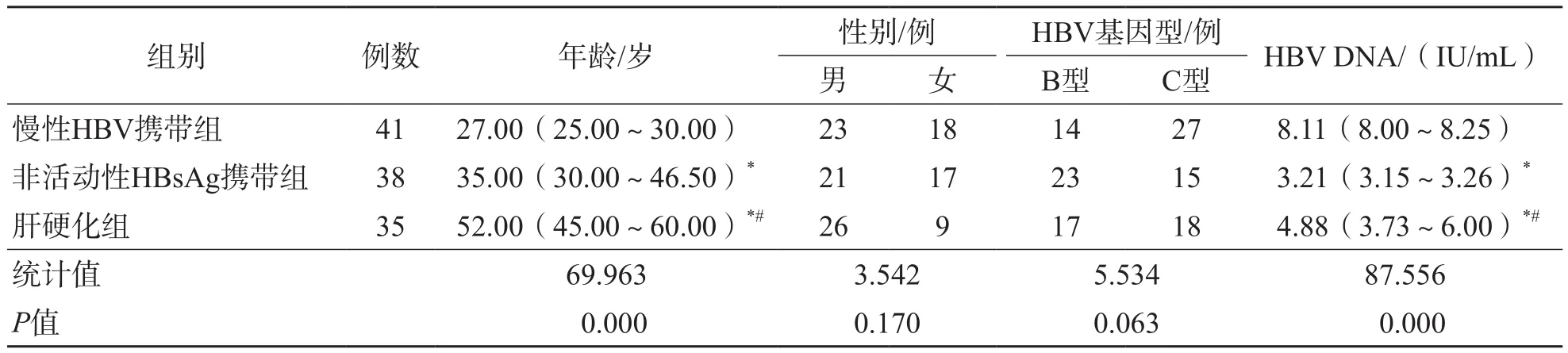
表2 慢性HBV携带组、非活动性HBsAg携带组与肝硬化组一般资料比较
2.2 慢性HBV携带组、非活动性HBsAg携带组与肝硬化组HBV S蛋白变异的比较
肝硬化组HBV S蛋白总体变异率明显高于非活动性HBsAg携带组和慢性HBV携带组(P<0.05、P<0.01)。慢性HBV携带组、非活动性HBsAg携带组与肝硬化组S蛋白的MHR区域外变异率及CTL+Th免疫表位区变异率依次升高(P<0.01)。3个组之间S蛋白的主要亲水区(major hydrophilic region,MHR)及位于MHR区域内的“a”决定簇、LOOP1和LOOP2的变异率差异均无统计学意义(P>0.05),MHR区域外的非免疫表位区变异率差异亦无统计学意义(P>0.05)。见表3。
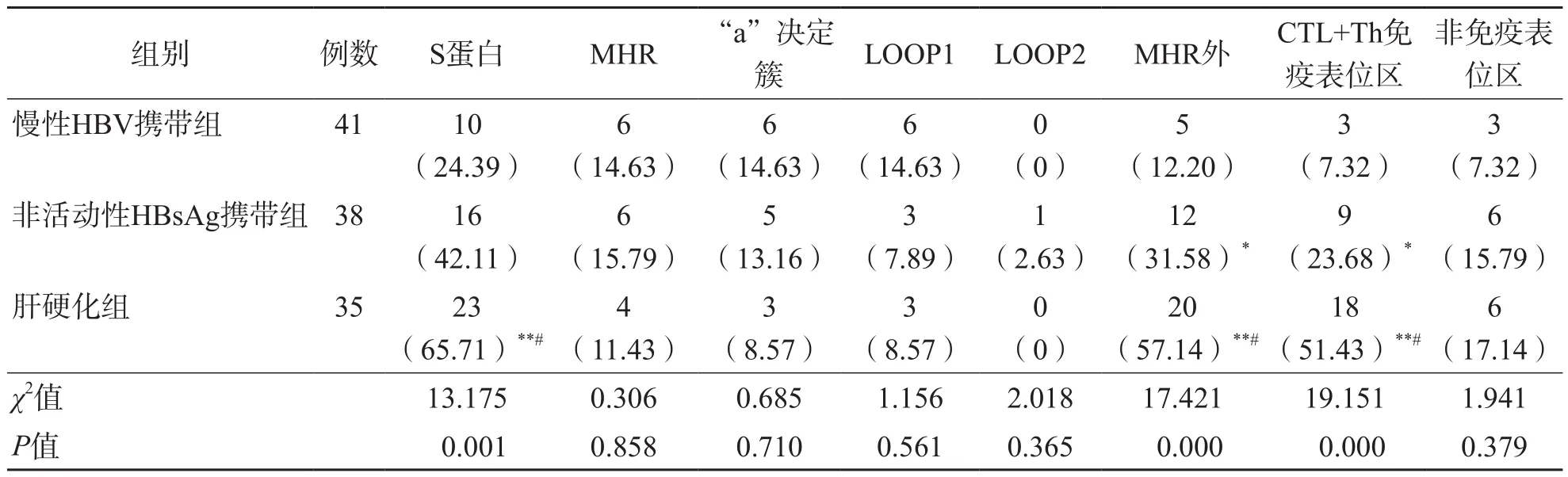
表3 慢性HBV携带组、非活动性HBsAg携带组与肝硬化组HBV S蛋白及MHR、MHR外变异率比较 例(%)
2.3 慢性HBV携带组、非活动性HBsAg携带组与肝硬化组HBV S蛋白变异位点比较
慢性HBV携带组中有1例患者同时出现MHR外Th免疫表位区、CTL免疫表位区和非免疫表位区3个位点变异,1例患者出现MHR与MHR外Th表位2个位点变异,其他患者均为单点变异,且MHR外CTL+Th免疫表位区与非免疫表位区变异率相当,呈随机分布。非活动性HBsAg携带组有5例(13.15%)患者出现2个位点以上的变异,肝硬化组有9例(25.71%)患者出现2个位点以上的变异,且2个组的变异位点集中于MHR外CTL+Th免疫表位区。见表4。

表4 慢性HBV携带组、非活动性HBsAg携带组与肝硬化组HBV S蛋白变异位点比较

续表4
3 讨论
此前,大部分研究者认为内源性宿主免疫压力与外源性免疫预防或接种(疫苗或治疗)均是HBV S蛋白变异的主要原因[6]。慢性HBV携带者均为母亲HBsAg或HBeAg阳性的围产期或婴幼儿期疫苗逃逸的HBV感染患者,该类患者均处于免疫耐受期且未接受任何抗病毒药物治疗,临床特征为HBsAg阳性、HBeAg阳性、ALT正常、HBV DNA高载量,肝脏炎症非常轻微,患肝硬化的概率较小[1]。本研究结果显示,免疫耐受状态下的慢性HBV携带者HBV S蛋白的变异率相对较低,MHR内的变异主要集中于“a”决定簇中的LOOP1中,主要变异位点为126和127位点,未检出G145R免疫逃逸位点,MHR外的变异位点呈随机分布,CTL+Th免疫表位区与非免疫表位区变异率基本一致。经历免疫清除,导致出现血清学转换(由HBeAg阳性转变为阴性)的非活动性HBsAg携带者的MHR区域内变异率与慢性HBV携带者比较,差异无统计学意义(P>0.05), 其变异主要出现在MHR外。本研究结果与文献报道[9-10]明显不同。SONG等[9]的研究结果显示,在免疫耐受期转化为免疫清除期过程中产生的抗体可对HBV MHR,尤其是“a”决定簇造成强烈的选择性压力,从而引起该位点变异,因此HBeAg阴性患者MHR变异率高于HBeAg阳性患者。也有学者认为,自然产生的变异主要集中于LOOP1区,免疫压力导致的变异主要集中于LOOP2区[10]。而本研究结果显示,免疫压力导致的HBV S蛋白变异主要集中于MHR外。另外,肝硬化患者MHR外及MHR外CTL+Th免疫表位区变异率明显升高,提示在经历免疫清除导致出现血清学转化的过程中,免疫压力所致的变异位点集中于MHR外,其变异与HBeAg阴性的血清学状态有关。由于HBeAg阴性患者变异位点多出现于“a”决定簇外或MHR外区域,因此推测体液免疫产生的抗体可能并不是HBV S蛋白发生变异的主要压力,造成HBV S蛋白变异的免疫压力可能更多来自于CTL与Th介导的细胞免疫压力。有研究结果显示,CTL、Th介导的细胞免疫在HBV清除过程中起关键作用,而体液免疫,即中和抗体产生相对较晚,起相对次要的作用[11]。另外,HBV变异与CHB病情加重或肝硬化具有一定的关联性,病毒发生变异可能不仅仅是免疫压力造成的后果。变异的HBV可能会通过免疫逃逸或内质网应急等机制使病情加重并发展成为肝硬化。
本研究尚存在一定的不足之处:首先,非活动性HBsAg携带者通常被认为预后良好,但其中有20%~30%会复发,这类患者的HBV载量通常接近或低于检测限。由于HBV载量低于检测限的患者无法进行DNA测序,因此本研究参考文献[8],选取HBV DNA<2×103IU/mL的患者作为研究对象。其次,有研究提示有长期拉米夫定治疗史的CHB患者的MHR变异率明显高于未治疗患者(χ2=5.803,P<0.05)[12]。本研究中所有非活动性HBsAg携带者和肝硬化患者均有抗病毒药物治疗史,而慢性HBV携带者均未接受抗病毒药物治疗。本研究结果显示,MHR变异率3个组之间差异无统计学意义(P>0.05),不支持抗病毒治疗对MHR变异产生影响这一结论,但抗病毒治疗是否与MHR外变异有关尚无法确认。
总之,HBV S蛋白MHR外,尤其是MHR外CTL+Th免疫表位区变异不仅与HBeAg阴性血清学状态相关,也与肝硬化相关。
