盐酸溴己新葡萄糖注射液质量标准改进建议*
2020-06-16陈乃江王婷婷
陈乃江,李 玲,王婷婷
(江苏省连云港市食品药品检验检测中心,江苏 连云港 222006)
盐酸溴己新葡萄糖注射液临床主要用于治疗慢性支气管炎及其他呼吸道疾病,如哮喘、支气管扩张、硅肺等有黏痰而不易咳出的病症。目前仅有江西科伦药业有限公司和石家庄四药有限公司生产,分别执行局颁标准YBH10902004-2016Z[1]( 以 下 简 称 “标 准 1”) 和YBH04412004-2016Z[2](以下简称“标准2”)。两种标准项下均收载了性状、鉴别、pH、有关物质、5-羟甲基糠醛、含量测定等项目。检验工作中发现,有些鉴别项无法执行,有些项目方法的设置和色谱条件选择有待商榷。本研究中通过对盐酸溴己新葡萄糖注射液2 种质量标准进行比较分析,对试验方法进行探讨,拟对盐酸溴己新葡萄糖注射液的质量标准提出修订建议,为该制剂标准的提高提供参考。现报道如下。
1 质量标准比较
现行盐酸溴己新葡萄糖注射液2 种质量标准中控制限度基本一致,标准1 在鉴别项下增加了盐酸溴己新芳香第一胺反应,在检查项中增加了重金属检测;2 种标准的含量测定项下均采用高效液相色谱(HPLC)法,仅流动相体系存在差异;葡萄糖含量测定均采用旋光度测定法。2 种标准比较见表1。

表1 盐酸溴己新葡萄糖注射液两个版本标准比较
2 各标准项比较
2.1 鉴别项
鉴别项下芳香第一胺反应、还原糖-菲林试剂反应及HPLC 法鉴别均能完全重现,专属性强。但2 种标准共有的氯化物鉴别不呈正反应,试验中无法生成白色凝乳状沉淀。原因在于,供试品溶液中Cl-质量浓度过低,盐酸溴己新葡萄糖注射液规格为100 mL ∶4 mg,经折算Cl-质量浓度为3 μg/mL。《中国药典》通则0801 氯化物检查中,针对微量氯化物的限度检查,采用的氯化钠标准溶液为每1 mL 相当于10 μg 的Cl-,也仅产生浑浊,难以生成沉淀。试验发现,供试品氯化物鉴别难以生成白色沉淀,现象不明显,且专属性不强,建议取消该项理化鉴别。
2.2 有关物质项
限度标准:盐酸溴己新和盐酸溴己新片是《中国药典》收录品种,2010 年版《中国药典(二部)》对杂质Ⅰ未做要求,2015 年版《中国药典(二部)》不仅对杂质Ⅰ规定了限度,对其他杂质的要求也更严格(见表2)。2 种局颁标准均在2016 年发布并实施,对杂质Ⅰ和其他杂质均未作要求,标准规定的总杂限度值高于2010 年版《中国药典(二部)》,是2015 年版《中国药典(二部)》的7 倍。2 种局颁标准不仅滞后于2010 年版《中国药典(二部)》,对杂质的控制程度更是严重落后于2015 年版《中国药典(二部)》的口服片剂标准,其潜在使用风险不容忽视,理应引起重视。
可操作性探讨:标准1“有关物质”项下规定,“供试品溶液的色谱中如有杂质峰,除空白溶液峰外各杂质峰面积的和不得大于对照溶液主峰面积的2.0%”。标准2中对空白溶液峰扣除无要求。执行前者的江西科伦药业有限公司在内部控制中,按生产工艺流程制得1 份除添加盐酸溴己新原料以外的阴性样品,作为空白峰扣除。作为企业可以这样操作,但对于监督抽验或第三方检验,按处方工艺生产不现实,因为不仅要考虑生产工艺高温灭菌等,还要涉及相应批次的辅料和原料葡萄糖,在实际检验中不具备操作性。建议考察盐酸溴己新有关物质时,其相关溶剂峰及辅料峰的扣除情况应在标准中予以详细说明,便于扣除。
已知杂质的控制:2015 年版《中国药典(二部)》[3]中,盐酸溴己新及其制剂均增加了杂质Ⅰ的控制,国外药典中盐酸溴己新及其制剂对杂质C,D,F 等已知杂质进行了限度控制[4-8]。笔者考察了盐酸溴己新中杂质Ⅰ,C,D,F,建立了色谱检测法,4 种杂质均能达到有效分离。但当杂质含量为盐酸溴己新0.1%时,盐酸溴己新葡萄糖注射液制剂母液进样,常规紫外检测器检测不到峰,原因在于制剂母液中盐酸溴己新质量浓度仅为0.04 mg/mL,对应盐酸溴己新0.1%杂质强度远小于检出限。由于该输液剂含有较高浓度的葡萄糖,对母液中盐酸溴己新进行富集和浓缩也不现实。建议必要时提高质量标准,采用液相色谱质谱联用(LC-MS)法对盐酸溴己新葡萄糖注射液中的已知杂质进行控制。
2.3 5-羟甲基糠醛(5-HMF)项
检查方法:5-HMF 作为葡萄糖降解杂质之一,对人体横纹肌和内脏有损害,且有遗传毒性、致癌性和致突变性,属2 类遗传毒性杂质。2015 年版《中国药典(二部)》中对葡萄糖注射液的检查方法主要有紫外分光光度(UV)法和HPLC 法[9-10],HPLC 法限度一般规定为不高于葡萄糖含量的0.02%,UV 法规定在一定浓度时吸光度不得大于0.32。2 种局颁标准均采用UV 法控制限量,优点是简单便捷、不涉及对照品使用,缺点是供试品溶液中盐酸溴己新主药在284 nm 波长处有吸收。5-HMF 检查时,供试品溶液中盐酸溴己新的质量浓度为8 μg/mL,取盐酸溴己新对照品配制同样质量浓度的对照品溶液,进行扫描(见图1),对照品溶液在284 nm 波长处的吸光度约为0.02,对5-HMF 的控制有轻微影响。HPLC 法的优点为可直观、准确地定量分析,缺点是检测时需要对照品,价格昂贵,需冷冻保存,该对照品低熔点近室温,引湿性强,称量要求较苛刻,故推荐UV 法进行5-HMF 检查。对本品分别采用UV 法和HPLC 法测定5-HMF 含量,结果见表3。

表2 2 种标准与《中国药典》项下有关物质限度比较

图1 紫外分光光谱图
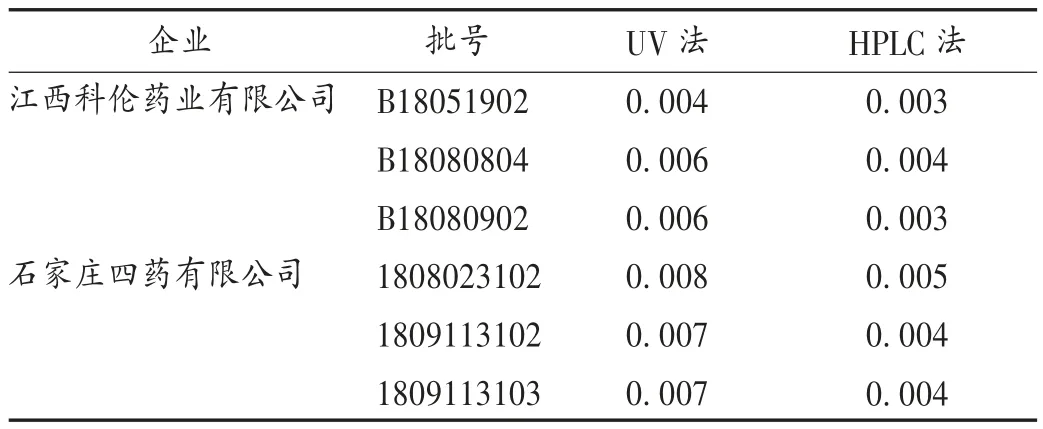
表3 5-HMF 含量测定结果(%)
5-HMF 对有关物质检查的影响:有关物质考察的是盐酸溴己新的杂质情况,5-HMF 为葡萄糖的降解产物,在有关物质色谱条件下有较大吸收。有关物质项下5-HMF 峰是否计入一般杂质峰,目前存在争议。有观点认为,5-HMF 在检查项下已明确规定,有关物质中出现的5-HMF 峰不应作杂质论,应予以扣除。另有观点认为,标准中有关物质项下没有明确说明5-HMF 不按杂质峰计算,且有关物质检查和5-HMF 检查是不同概念,两者所用方法不同,前者用HPLC 法于249 nm波长处测定总杂,后者用UV 法于284 nm 波长处测定5-HMF 单个杂质。检验者一般都会把5-HMF 色谱峰作为一般杂质峰计入样品总杂,易造成总杂超过标准规定[8],因5-HMF 峰较大,造成有关物质不符合规定。盐酸溴己新葡萄糖注射液的规格是为每100 mL 含溴己新4 mg、葡萄糖5 g,5-HMF 的限度值按葡萄糖0.02%计算,每100 mL 盐酸溴己新葡萄糖注射液中5-HMF 最大允许量为1 mg。可见,5 -HMF 对有关物质测定有较大干扰,建议标准中明确有关物质检查项中应扣除5-HMF 峰。
2.4 色谱条件
2 个局颁标准均采用HPLC 法测定盐酸溴己新含量和有关物质,HPLC 法专属性强、准确度高。2 个标准仅在流动相体系上存在差异,前者为甲醇-水-0.01mol/L 三乙胺甲醇溶液(95 ∶5 ∶1.5,V/ V/ V),后者为甲醇-0.05 mol/L 醋酸铵溶液(89 ∶11,V/ V)。标准1 流动相体系有机相比例为95%,水相比例偏小,在有关物质检查时,供试品是母液(每1 mL 含50 mg 葡萄糖)进样,遇到高比例有机相甲醇时,出现析晶粘针现象,造成色谱峰鬼峰。试验中发现,当水相比例提高至10%时,粘针析糖现象消失,建议修订质量标准时适当降低有机相比例,重新考察流动相体系。
3 建议
药物杂质影响药物的临床使用安全性和药品的稳定性,对其进行充分研究和控制是确保药品安全性的必要环节。针对盐酸溴己新葡萄糖注射液,控制主药杂质具体范围和明确杂质具体限值是控制该制剂质量的重点和难点。该制剂中存在盐酸溴己新和葡萄糖2 种成分,现行2 种局颁标准均弱于2015 年版《中国药典(二部)》盐酸溴己新片口服制剂,且无已知杂质Ⅰ的限度控制项,故局颁标准有提高的客观要求。100 mL 样品中仅含主药盐酸溴己新4 mg,样品尽管是母液进针,盐酸溴己新质量浓度也仅为0.04 mg/mL,而2015 年版《中国药典(二部)》盐酸溴己新和盐酸溴己新片考察杂质制备的样品溶液浓度为2.5 mg/mL,该质量浓度级别可有效考察限值为2.0%的杂质Ⅰ,有关物质考察客观要求供试品溶液要有一定浓度,局限性在于样品本身就是注射剂,采用HPLC-UV 法,供试品无法达到可开展有关物质限度检查的进样浓度。对于注射剂,任何所谓富集和浓缩来提高浓度的手段都不现实,且除了浓度达不到要求,另一问题是,100 mL 输液中还存在5 g 葡萄糖,葡萄糖作为另一主要成分,质量浓度是主药盐酸溴己新的1 250 倍,在液相色谱UV 检测器下,50 mg/mL 葡萄糖背景系统产生的基础噪音严重干扰了主药杂质的检测和相关杂质峰识别。基于以上考虑,对于输液中预控制已知杂质Ⅰ和其他已知单杂C,D,F,企业只有采用更高灵敏度的LC-MS 法控制(外标法)。另外,对于总杂质的控制,只有在系统考察50 mg/mL 葡萄糖背景系统干扰情况下,必要时进行相关色谱峰区分后,可采用面积归一化法。
