生物肽SP对NK-92MI细胞迁移及趋化因子受体表达的影响
2020-06-16孟佳慧刘国栋张亚南范世光赵蔓嘉傅炜昕
孟佳慧, 刘国栋, 张亚南, 范世光, 赵蔓嘉, 傅炜昕*
(1. 中国医科大学 科学实验中心一部,辽宁 沈阳 110001;2. 济宁市中心血站,山东 济宁 272000;3. 天津医科大学 代谢病医院,天津 300000)
NK细胞是一种具有天然细胞毒活性的免疫细胞,可直接对损害机体的病原体进行免疫防御,无需抗原提呈即可靶向裂解癌细胞和病原体,介导机体抗感染和抗肿瘤反应。NK细胞参与正常状态的外周循环,除此之外,也可存在于脾、淋巴结、肝、肺、肠及子宫中[1]。当机体受到外源性感染和肿瘤细胞侵袭时,NK细胞被活化,具有增殖和杀伤活性,能很好地清除受炎症所累的坏死细胞及肿瘤细胞[2-3]。NK细胞通过表达激活和抑制受体信号的平衡,识别和杀死应激、转化或病毒感染的细胞,并分泌各种效应分子[4-5]。NK细胞受到激活后,自身也分泌促进迁移的活性因子,而在个体差异、细胞亚群差异、以及NK细胞是否被激活等因素下,趋化因子受体的种类和水平具有很大的不同[6]。生物肽SP最初被发现为存在于神经组织及非神经组织中的多肽,并且是传递疼痛、伤害感受和炎症的神经递质。SP可以在炎症时促进免疫细胞合成并分泌细胞因子,增强炎症局部的免疫反应,促进淋巴细胞向炎症局部的迁移[7]。SP是细胞迁移的关键参与者,可以直接或通过诱导多种趋化因子及其受体或粘附分子发挥这种功能[8]。本研究以NK92-MI细胞为研究对象,旨在探讨SP对NK细胞的趋化迁移活性的直接或间接的影响,并通过测定SP对NK92-MI细胞CCR7和CXCR4表达水平的影响,进一步讨论SP促进NK细胞迁移的机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 NK细胞株:NK-92MI细胞为IL-2非依赖型NK92细胞,1998年建系,购自中科院上海细胞库,用含12.5%的胎牛血清和12.5%马血清的α-MEM培养基传代培养。
1.1.2 试剂 P物质(Sigma),HE染色液(生工生物公司),Trizol试剂、反转录反应试剂盒、Real-time PCR反应试剂盒(TaKaRa),流式细胞抗体(FITC-CCR7单抗、PE- CXCR4单抗,BD)。
1.1.3 仪器与设备 恒温培养箱(Thermo),倒置显微镜(OLYMPUS),微量紫外分光光度计(Sigma),实时荧光定量PCR仪(Roche 4800),流式细胞仪FACSAria(BD)。
1.2 方法
1.2.1 Transwell细胞迁移实验测定SP对NK92-MI细胞迁移力的影响 ①在24孔板下室加入不同浓度的SP,600 μL/孔,使其终浓度分别为10-12、10-10、10-8、10-6mol/L,并设置对照孔,以等体积的培养液替代SP;在Transwell上室加入8×105/mL的未经SP处理的NK92-MI细胞悬液,100 μL/孔。②将NK92-MI细胞用不同浓度SP(10-12、10-10、10-8、10-6mol/L)作用24 h,在24孔板下室分别加入趋化因子CXCL12/CCL21,600 μL/孔,使其终浓度为60 ng/mL;在Transwell上室加入8×105/mL的经SP处理的NK92-MI细胞悬液,100 μL/孔。设置对照组,上室为未经SP处理的NK92-MI细胞,下室为CXCL12/CCL21。③将接种好的24孔培养板置于37 ℃、5% CO2培养箱中孵育6 h。孵育结束后,取出培养板,弃去上、下室的液体,然后用棉签轻轻擦拭Transwell小室的上表面,再用PBS清洗小室的上、下表面。用4%多聚甲醛固定15 min;对小室进行HE染色后,倒置显微镜下观察并计算趋化指数(CI)。计算公式:CI=实验组每镜下视野中细胞数/对照组每镜下视野中细胞数。
1.2.2 Real-time PCR法测定SP对NK92-MI细胞趋化因子受体CCR7和CXCR4 mRNA表达的影响 ①引物设计:CR7和CXCR4的引物用Primer Premier 5.0软件设计,由生工生物公司合成,引物序列见表1。②Real-time PCR:将NK92-MI细胞用各浓度SP(10-12mol/L~10-6mol/L)作用6 h后收集细胞,用异硫氰酸胍(Trizol)法提取总RNA。RT反应体系为20 μL(去DNA反应总RNA液10.0 μL、5×Prime Script BufferⅡ 4.0 μL、Prime Script RT Enzyme Mix I 1.0 μL、RT Primer Mix 1.0 μL、RNase Free dH2O 4.0 μL);反转录反应条件为37 ℃ 15 min;85 ℃ 5 s。PCR反应体系为20 μL(SYBR Premix ExTaqII 10.0 μL、PCR Forward Primer 0.8 μL、PCR Reverse Primer 0.8 μL、cDNA 2.0 μL、dH2O 6.4 μL);PCR反应为2步法:95 ℃、30 s(预变性),95 ℃ 5 s、60 ℃ 34 s(40个循环)。应用罗氏4800 Real-time PCR System进行检测,以β-actin做内参基因,用2-△△Ct法比较实验组相对表达量与对照组的倍数差异,计算公式:△△Ct=实验组△Ct-对照组△Ct,mRNA相对表达= 2-△△Ct。

表1 Real-Time PCR 用引物
1.2.3 流式细胞术检测SP对NK92-MI细胞表面趋化因子受体CCR7和CXCR4表达的影响 将NK92-MI细胞用各浓度SP(10-12~10-6mol/L)作用24 h后收集细胞。用PBS缓冲液洗涤两次,将细胞重悬至EP管中,并将SP处理的NK92-MI细胞分为两管,分别加入FITC-CCR7抗体5 μL、PE-CXCR4抗体20 μL,室温避光孵育30 min。抗体处理结束后,用PBS缓冲液洗涤3次,每次以10 000 r/min离心3 min,洗去未结合抗体。将每管细胞用200 μL 4%多聚甲醛重悬,上流式细胞仪检测NK92-MI细胞表达趋化因子受体CCR7和CXCR4的阳性细胞百分率。
2 结果与分析
2.1 SP对NK92-MI细胞迁移活性的影响
2.1.1 SP对NK92-MI细胞迁移能力的影响 在10-12~10-10mol/L浓度范围内,随着SP浓度的增加,其促进NK92-MI细胞迁移作用逐渐增强,1010mol/L浓度时趋化指数达最大值(P<0.01),随浓度继续增加,SP促进NK92-MI细胞迁移能力逐渐减弱,结果如表2、图1所示。

图1 SP对NK92-MI细胞迁移能力的影响(HE染色transwell图)Fig.1 Effects on migration ability of NK92-MI cells by SP (HE staining picture of transwell)

表2 SP对NK92-MI细胞迁移能力的影响
注:*与对照组相比P<0.05,**与对照组相比P<0.01,下表同
2.1.2 SP增强趋化因子CCL21/CXCL12对NK92-MI细胞的趋化作用 在低浓度(10-12~10-10mol/L)范围内,SP可促进趋化因子CCL21/CXCL12对NK92-MI细胞的趋化作用,且随SP浓度的增加促进作用逐渐增强,在10-10mol/L浓度时,SP促进作用最强;SP浓度继续增加,SP促进趋化因子CCL21/CXCL12对NK92-MI细胞的趋化作用又有所回降,结果如表3、图2所示。
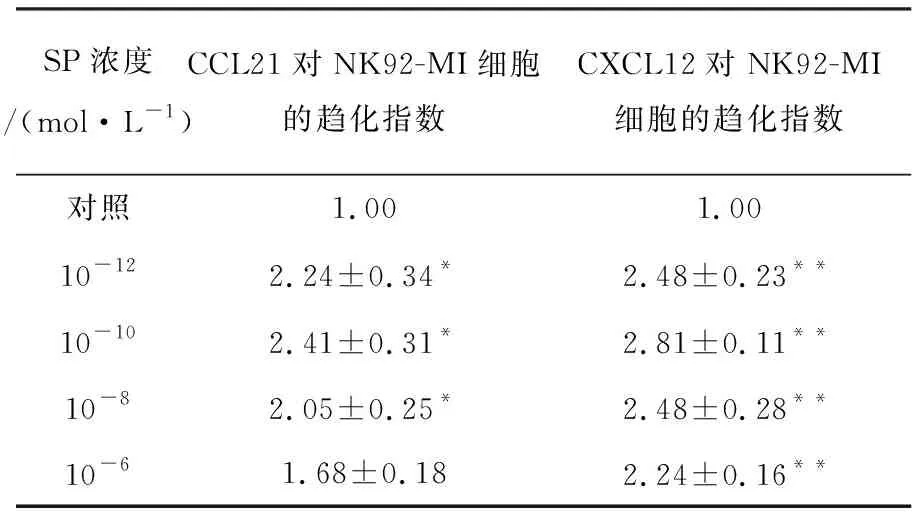
表3 SP增强趋化因子CCL21/CXCL12对NK92-MI细胞的趋化作用Table 3 SP enhanced chemotaxis of CCL21/CXCL12 on NK92-MI cells
图2 SP增强趋化因子CCL21/CXCL12对NK92-MI细胞的趋化作用(HE染色transwell图)
2.2 SP对NK92-MI细胞趋化因子受体CCR7和CXCR4 mRNA表达的影响
SP对NK92-MI细胞表达的CCR7和CXCR4两种趋化因子受体mRNA表达具有促进作用。
在浓度范围为10-12~10-6mol/L时,SP刺激NK92-MI细胞6 h,均可明显促进CCR7 mRNA的表达(P<0.01),且随着SP浓度的增高,其mRNA表达水平也增高(图3A)。在浓度范围为10-10~10-6mol/L时,SP刺激NK92-MI细胞6 h,均可明显促进CXCR4 mRNA的表达(P<0.01);仅在浓度为10-12mol/L时,其mRNA的表达无明显增高(图3B)。
2.3 SP对NK92-MI细胞趋化因子受体CCR7和CXCR4膜表达的影响
SP对NK92-MI细胞表达的CCR7和CXCR4两种趋化因子受体膜表达具有不同的效应。
浓度范围为10-12~10-6mol/L的SP作用24 h,CCR7阳性细胞百分率随着SP浓度的增高而增高,10-8mol/L和10-6mol/L浓度的SP可明显促进CCR7受体膜表达(P<0.05)(结果见图4A、图4C)。浓度范围为10-12~10-6mol/L的SP作用24 h,CXCR4阳性细胞百分率均高于对照组,且随着SP浓度的增高,具有先增高后回降的趋势,10-10mol/L和10-8mol/L浓度组,CXCR4阳性细胞百分率有显著增高(P<0.01、P<0.05)(图4B、4C)。

图3 SP对NK92-MI细胞趋化因子受体CCR7和CXCR4 mRNA表达的影响Fig.3 Effects on the mRNA expression of CCR7 and CXCR4 in NK92-MI cells by SPA: CCR7 mRNA的相对表达; B: CXCR4 mRNA的相对表达;*与对照组相比P<0.05,**与对照组相比P<0.01,下图同A: Relative expression of CCR7 mRNA;B: Relative expression of CCR7 mRNA;*Compared with the control group P<0.05,** Compared with the control group P<0.01,same the follow
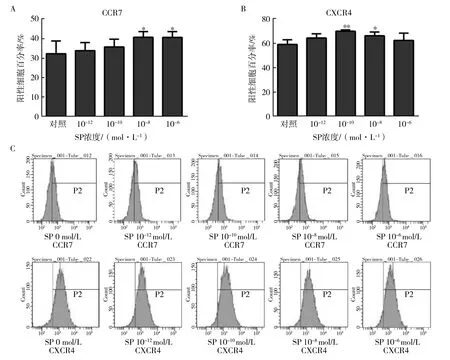
图4 SP对NK92-MI细胞趋化因子受体CCR7和CXCR4膜表达的影响Fig.4 Effects on the expression of chemokine CCR7 and CXCR4 in NK92-MI cells by SP
A: CCR7的表达(阳性细胞百分率);B: CXCR4的表达(阳性细胞百分率);C: CCR7和CXCR4 表达的流式图
A: The percentage of CCR7+cells in NK92-MI cells; B: The percentage of CXCR4+cells in NK92-MI cells;C: FACS histograms of the expression of CCR7 and CXCR4
3 讨 论
生物肽SP属于速激肽类,是主要由神经元分泌的高度保守的11个氨基酸残基组成的多肽。SP广泛分布于机体内,并由多种体内细胞分泌,可介导多种生理和病理活动[9]。 SP可参与传导体内疼痛感受,扩张血管、参与呼吸道、输尿管及膀胱平滑肌生理功能的调节,与此同时,SP也参与炎症的局部反应,并可参与炎症局部多种免疫细胞生理功能的调节;SP能通过促进分泌可溶性调节因子的方式参与免疫调节,多种免疫细胞参与调节并促进免疫功能[10]。SP调节免疫细胞增殖率和细胞因子的产生,神经源性炎症则是基于SP对免疫细胞的募集,SP能将白细胞募集到伤害感受器的外周末端,并释放出导致神经性疼痛的神经活性介质,这也是许多病理过程的关键组成部分[11]。
NK细胞为固有免疫的效应细胞,能裂解靶细胞;成熟NK细胞可分布于外周循环血、脾、肺及肝等器官中,具有较强的迁移活性[1]。在机体遭受细菌、病毒侵袭和癌细胞扩散时,NK细胞可迁移至反应部位。NK细胞的再循环、分布和对各个器官的依赖主要取决于器官特异性的趋化因子[12-13]。趋化因子受体的表达和相应的NK细胞趋化反应可以在细胞因子介导下进行,并受到它的调节,因此表明它们可能更好地归巢于相应配体表达的肿瘤位点[14]。研究表明,NK细胞的迁移活动受多种因素调控,能迅速迁移至病变部位,在炎症感染治疗、肿瘤疾病防御、应激保护和正常免疫调控中起一定作用[15-17]。现有文献主要集中在NK细胞本身的趋化研究上,而生物肽SP对NK细胞迁移活性的研究比较少。前期研究通过小鼠体内实验检测了SP对NK细胞亚群分布的影响,并体外研究了SP对小鼠脾NK细胞迁移及趋化因子受体表达水平的调控作用[18]。本研究中使用NK92-MI细胞,具有与人NK细胞相似的表面分子和功能特征,表型为CD56brightCD16+。以NK92-MI细胞为研究对象,意在进一步研究和讨论SP促进NK细胞迁移的作用机制。
SP作为生物肽类物质,在炎症时具有募集免疫细胞的功能[8]。首先采用Transwell细胞迁移实验检测不同浓度SP对NK92-MI细胞迁移活性的影响,结果表明不同浓度SP均能促进NK92-MI细胞的迁移活动,说明SP对NK92-MI细胞有直接的趋化作用,且SP能协同增强趋化因子CCL21(CCR7的配体)或CXCL12(CXCR4的配体)对NK92-MI细胞的趋化活性,这一作用可能通过增强NK92-MI细胞表面相应趋化因子受体的表达来实现的。
目前的实验研究对趋化因子受体的表达是有争议的,可能是受到NK细胞来源和不同实验方法的影响。大部分静止的细胞很少表达CCR1、CCR2、CCR3、CCR4、CCR5、CCR6、CCR7、CCR8及CCR9[19];NK细胞亚群对趋化因子受体表达具有差异,CD56brightNK细胞通过CCR7靶向迁移至淋巴结,优先表达CXCR3,并且与CD56dimNK细胞相比具有更高的CXCR4表达水平,CD56dimNK细胞则独特地表达CXCR1,ChemR23和CX3CR1[20]。实验研究发现,NK细胞能够表达较低水平的CXCR2和CXCR3,表达较高水平的CXCR1、CXCR4和CX3CR1[21]。机体遭受炎症侵袭时,CCR7具有重要的招募NK细胞抵御炎症的功能,当机体发生感染时,病原体环境可诱发抗原提呈细胞表达IL-18,而富含IL-18的环境能促进NK细胞表达CCR7,对趋化因子CCL19和CCL21所致的迁移作用具有更好的反应性[22]。CXCR3和CXCR4可表达于NK细胞、活化T细胞、树突状细胞和癌细胞等[23-24]。CXCR4在次级淋巴组织中白细胞归巢及炎症部位的募集中起重要作用,且受局部CXCL12浓度的影响[25-26]。基于目前已有的研究,用Real-time PCR和流式细胞术分别检测趋化因子受体CCR7和CXCR4 mRNA表达和膜表达。浓度为10-12~10-6mol/L的SP作用NK92-MI细胞,其CCR7 mRNA的表达均显著增高;CCR7的膜表达与mRNA表达趋势基本一致,在10-8mol/L和10-6mol/L两个浓度组,CCR7的膜表达明显增高。浓度为10-10~10-6mol/L的SP均能明显促进CXCR4 mRNA的表达;且在10-10mol/L和10-8mol/L两个浓度组,SP能明显促进CXCR4的膜表达,SP增加趋化因子受体CXCR4膜表达的变化趋势与其mRNA水平的变化基本一致。SP对NK92-MI细胞趋化因子受体表达的影响与SP对其迁移能力的作用趋势不完全一致,提示可能存在有各趋化因子受体的竞争表达,CCR7和CXCR4可能部分参与了SP对NK92-MI细胞迁移的间接调控作用,还有其他趋化因子受体可能协同作用于SP对NK92-MI细胞的迁移活性的调控。
