海洋石油降解菌AH07的分离鉴定及其石油降解性能分析
2020-06-16陈玉琳于基成
陈玉琳, 刘 秋, 于基成, 陈 超
(大连民族大学 生命科学学院,辽宁 大连 116605)
近年来,随着海洋原油运输、近海采油平台及油港数量急剧增加,海洋石油污染逐年加剧。目前,常用于处理海洋石油污染的方法包括物理或化学方法等,其中生物修复以其费用低、处理效果好、无二次污染等优势被视为最有前途和经济有效的环境治理措施[1]。 由于海洋环境的特殊性(高盐、低温、寡养),对于海洋石油污染的生物修复主要依赖于海洋微生物。目前,已经发现超过100多属200多种微生物能够降解石油[2-3]。但这些微生物多数来自于土壤样品并用于土壤石油污染的修复[4-5]。而关于海洋石油降解微生物的研究相对较少。本研究主要是从大连新港石油污染区域海底沉积物中筛选到高效稳定的石油降解菌株AH07,并对其分类地位及其生长和石油降解特性的影响因素进行研究。以期为制备石油降解菌剂,开展生物修复石油污染环境提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 菌种来源 从大连新港石油污染区域海底沉积物中分离获得1株石油高效降解菌株AH07。保存于大连民族大学海洋微生物研究所。
1.1.2 培养基 ①无机盐培养基:NaCl 30 g/L,MgSO40.35 g/L,KH2PO40.224 5 g/L,微量溶液100 μL/L,刃天青1 mL/L,半胱氨酸0.2 g/L,pH为7.2左右,高温加压灭菌(121 ℃,20 min)备用。微量溶液:CaCl22 mg,FeCl3·6H2O 50 mg,MnCl2·4H2O 0.5 mg,ZnSO4·7H2O 10 mg[6]。无机盐培养基中添加0.3%(体积分数)的原油作为唯一碳源。②LB培养基:NaCl 10 g,蛋白胨10 g,酵母浸粉5 g,琼脂20 g,去离子水1 000 mL,pH 7.0[7]。
1.1.3 仪器与设备 高压蒸汽灭菌锅(5Y0264,日本三洋电子有限公司);GC-MS(GC-MS2010PLUS,日本岛津);全温培养摇床(211B,上海智城分析仪器制造有限公司);扫描电子显微镜(HITACH S-4800,日本日立);全波长紫外分光光度计(UV-1900,日本岛津) 。
1.2 方法
1.2.1 GC-MS分析菌株AH07对石油烷烃的降解效果 将菌株AH07接种至50 mL以原油为唯一碳源的无机盐培养基中,原油含量0.3%(体积分数),pH 7.5,培养温度28 ℃,摇床振荡(150 r/min)培养10 d。用石油醚将培养液连续萃取3次后,合并萃取液置容量瓶中并定容至50 mL,以原油作为对照,以气质联用方法(GC-MS)测定菌株AH07的降解情况。GC-MS运行条件:Rxi-5Sil MS色谱柱(30 m×0.25 mm×0.25 μm);载气为氦气;恒压为73 kPa;流速为1 mL/min;进样口温度300 ℃;离子源温度230 ℃;接口温度250 ℃;柱温(程序升温模式):初始温度100 ℃,保持2 min;以8 ℃/min升温至220 ℃保持15 min;再以6 ℃/min升温至280 ℃并保持10 min;最后以5 ℃/min升温至320 ℃并保持15 min;采用分流进样,分流比为10∶1;进样量为1 μL。
1.2.2 石油降解菌株的形态学观察及生理生化特征的测定 将菌株AH07在LB琼脂培养基上培养2 d,观察其培养特征。同时用浓度为2.5%的戊二醛进行固定,然后经磷酸缓冲溶液洗涤,无水乙醇梯度脱水,最后使用扫描电子显微镜进行外部形态观察。菌株AH07的生理生化鉴定包括硝酸盐还原、脲酶试验、以及糖发酵试验。
1.2.3 菌株AH07的16S rDNA鉴定及系统发育树构建 菌株AH07的16S rDNA鉴定采用细菌通用引物F27(5′-GAGTTTGATCATGGCTCAG-3′)及R1492(5′-GGTTACCTTGTTACGATC-3′)进行PCR扩增。16S rDNA测序工作由生工生物工程(上海)股份有限公司完成。将测序结果利用Mega 5.0软件构建菌株AH07的系统发育树状图。
1.2.4 菌株AH07生长曲线的测定 将菌株AH07接种至LB液体培养基中,28 ℃、150 r/min振荡培养72 h,每隔4 h取培养液用紫外分光光度计,测定其OD600值。以培养时间为横坐标,OD600为纵坐标,绘制其生长曲线。
1.2.5 pH对菌株AH07生长量的影响 将菌株AH07分别接种至pH为6、7、8、9、10 的LB液体培养基中,28 ℃、150 r/min振荡培养,分别测定其OD600。以pH值为横坐标,OD600为纵坐标,测定其菌体生长最佳pH值。
1.2.6 温度对菌株AH07生长量的影响 将菌株AH07分别接种至pH 7的LB液体培养基中,并在20、25、30、35和40 ℃条件下150 r/min振荡培养,测定其OD600。测定其菌体生长的最佳温度范围。
1.2.7 氮源对菌株AH07石油降解性能的影响 考查不同氮源(NH4Cl、NH4NO3、(NH4)2SO4、玉米粉、麸皮)对原油降解率的影响,菌株培养方法见1.2.1。用石油醚将培养液连续萃取3次后合并萃取液到容量瓶中并定容至50 mL。采用紫外分光光度法测定石油烃含量[8],确定菌株的石油降解率。
石油降解率(%)=((AC-A0)/AC)×100%
式中:AC为对照组的吸光值;A0为待测菌株降解后的吸光值。
2 结果与分析
2.1 GC-MS分析菌株AH07对石油烷烃的降解效果
以原油作为对照,采用GC-MS方法对菌株AH07的石油降解效果进行分析,28 ℃、150 r/min振荡培养10 d,菌株AH07对烷烃的降解率为42.56%(图1)。
2.2 菌株AH07的形态学观察与生理生化性质的测定
菌株AH07在LB琼脂培养基上菌落小而凸起、稍透明、微黄、边缘整齐、表面光滑湿润并易挑起(图2)。经电子扫描显微镜观察,菌株AH07呈圆端杆状(图3)。

图2 菌株AH07菌落形态Fig.2 Colony morphology of strain AH07
菌株AH07与苍白杆菌属系统发育近缘种之间生理生化鉴定的差异[9]。通过硝酸盐还原试验及糖发酵试验表明,菌株AH07与O.cytisi结果不同,并与O.anthropi完全一致(表1)。
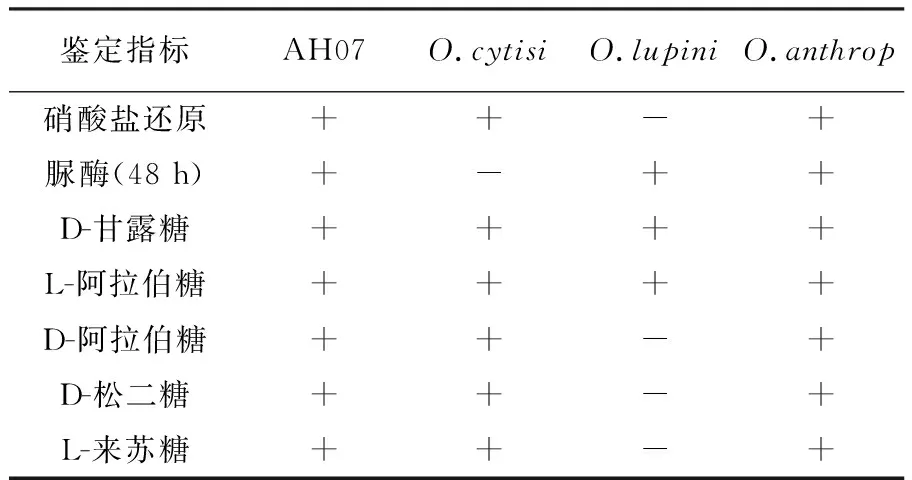
表1 菌株AH07的生理生化特征
注:“+”阳性;“-”:阴性
2.3 菌株AH07的序列测定及系统发育树分析
利用Mega 5.0软件构建菌株AH07的系统发育树。如图4所示,菌株AH07与金雀儿根瘤苍白杆菌(O.cytisi)、羽扇豆苍白杆菌(O.lupini)和人苍白杆菌(O.anthropi)位于同一发育树枝上。同源性检索结果表明,AH07与其他3株菌种的同源性分别为100%、99.93%和100%。
综合形态学观察、生理生化检验以及16S rDNA鉴定,确定菌株AH07为人苍白杆菌(Ochrobactrumanthropi),GenBank序列登录号为KT831449。

图3 菌株AH07扫描电镜图Fig.3 Scanning electron microscope of strain AH07
2.4 菌株AH07的生长曲线
用LB液体培养基对菌株AH07进行摇床培养(条件同1.2.5),每隔4 h测定菌液的OD600。如图5所示,菌株AH07在12 h后呈对数生长,40 h后进入稳定期,从60 h后开始进入衰亡期。
2.5 pH值对菌株AH07生长量的影响
不同pH值对菌株AH07生长量的影响结果如图6所示。菌株AH07在中性偏碱性环境中生长较好,以pH值为7时最佳。当pH值低于7时其生长量急剧下降,在pH 6时几乎不生长。
2.6 温度对菌株AH07生长量的影响
从图7中可以看出,菌株AH07的最适生长温度为30 ℃。当温度超过35 ℃和低于25 ℃时,菌株的生长量出现大幅降低。

图4 菌株AH07的系统发育树
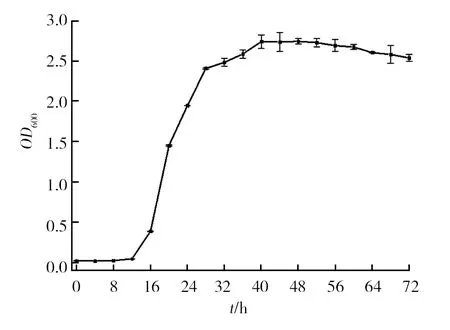
图5 菌株AH07的生长曲线

图6 不同pH条件下菌株AH07的生长曲线
2.7 氮源对菌株AH07石油降解率的影响
由于海洋环境的特殊性,温度(海水温度终年15 ℃左右)、pH值(pH>7)、盐度(NaCl 3%)基本恒定。且作为石油降解菌剂的研发,其降解目标为石油或其有关组分。因为石油降解菌剂中将不再添加其他碳源,而将造成海洋污染的原油及其组分作为唯一碳源。因此,影响菌株石油降解性能的主要因素为氮源。
为了考察不同氮源对菌株原油降解性能的影响,选择3种无机氮源以及2种有机氮源,分别为NH4NO3、NH4Cl、(NH4)2SO4、麸皮以及玉米粉。由图8可见,NH4NO3为菌株AH07石油降解的最佳无机氮源(降解率31.98%),玉米粉为最佳有机氮源(降解率58.25%)。

图7 不同温度条件下菌株AH07的生长曲线Fig.7 Growth curve of strain AH07 under different temperature

图8 不同氮源对菌株AH07石油降解率的影响Fig.8 Effect of nitrogen source on biodegradation rate of crude oil by strain AH07
3 讨 论
1988年Holmes等[10]首次从人类临床标本中分离出人苍白杆菌(O.anthropi)。其一直仅被认为是一种不具有临床意义的条件病原体[11],除此之外人们对其知之甚少。实际上,苍白杆菌属(Ochrobactrumsp.)一直在生物修复方面具有潜在的应用前景。多项研究表明,苍白杆菌属具有降解苯酚以及4-氯-2-甲基苯酚的能力,同时还可减少有毒六价铬并具有吸附重金属离子的功能。另外在苍白杆菌属中还鉴定出了几种能够产生生物表面活性剂和降解尼古丁的酶,包括D-stereo特定的氨基酸酰胺酶、氨肽酶以及谷胱甘肽S-转移酶[12]。Chai等[13]从地层水中分离到1株O.intermedium具有降解石油的能力,并开展其基因组学研究。
但国内外关于苍白杆菌属在石油降解方面的报道极少,且国内研究大多关于土壤污染,在海洋污染方面基本没有报道。如张海荣等[14]从天津大港油田区石油污染盐碱化土壤及油泥中分离出苍白杆菌属(Ochrobactrumsp.)水稻苍白杆菌(Ochrobactrumoryzae),但仅对菌株的耐盐碱性做了相关研究。而李宝明等[15]将小麦苍白杆菌(Ochrobactrumtritici)与其他菌株进行了菌群构建,证明该菌属利用石油烃能力强且生长迅速,且菌群在5 d内原油的降解率可达到55.5%。
今后将继续研究该菌株在石油降解方面的降解机制与规律,以期构建石油降解菌群,制备石油降解菌剂,为海洋溢油生物修复的应用提供技术支持。
