出芽短梗霉Aureobasidium sp. SRF的菌株特性分析及胞外多糖结构鉴定
2020-06-16罗祥莲张殿朋魏步云王升厚赵洪新
罗祥莲, 张殿朋, 王 翰, 魏步云, 李 欧, 王升厚, 赵洪新*
(1.沈阳师范大学 生命科学学院, 辽宁 沈阳 110034;2.浙江理工大学生命科学与医药学院 浙江省植物与次生代谢重点实验室,浙江 杭州 310018;3.北京市农林科学院 植物保护环境保护研究所,北京 100097;4.南阳理工学院 生物与化学工程学院,河南 南阳 473000)
微生物多糖(Microbial polysaccharides, MPS)是细菌、真菌、藻类等微生物代谢过程中产生的糖类高聚物,在材料、食品、化工、医药、环保等领域有着十分广泛的应用,是具有极高开发价值的天然产物[1]。普鲁兰多糖(Pullulan)又称茁霉多糖、普聚多糖和短梗霉多糖,是出芽短梗霉属(Aureobasidium)微生物代谢产物,分泌到胞外的糖类高聚物,是一种天然微生物多糖。其化学结构由无定型、无色无味的麦芽三糖为重复单位,组成高分子聚合物,具有分解性、粘着性、固结性、被覆性、胶囊特性、耐酸耐碱、吸湿性、水溶性等理化性质,在食品、食物、医药、化学工业、化妆等行业具有广泛的应用[2-3]。出芽短梗霉(Aureobasidiumpullulans)又叫黑酵母,是与酵母菌关系极为密切的真菌,在形态学和生理学上跟酵母菌有许多类似的地方[4],是普鲁兰多糖的主要产生菌。出芽短梗霉(A.pullulans)在产生普鲁兰多糖过程中,有些菌株产生黑色素,会随着普聚多糖分泌到细胞外,而影响普鲁兰多糖的产量。因此,寻找和开发色素产量低、普鲁兰多糖产量高的菌株,一直受到研究者的高度关注[5]。本研究以1株从意大利树莓(Rubuscorchorifolius)果实表面分离,产胞外多糖的菌株为出发菌株,通过菌株形态学观察和ITS间隔序列鉴定,确定该菌株属于Aureobasidium,命名为Aureobasidiumsp. SRF。通过薄层层析和红外光谱分析了多糖结构,利用单因素试验和响应面Plackett-Burman和Box-Behnken设计相结合,确定SRF产胞外多糖最优培养基条件。为开发Aureobasidiumsp. SRF以及进一步从自然界中寻找新的普鲁兰多糖产生菌提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 出芽短梗霉SRF(Aureobasidiumsp. SRF)实验室保存,分离自意大利树莓果实表面,-80 ℃冰箱保存。
1.1.2 培养基(g/L) ①LB培养基:胰蛋白胨 10,氯化钠 10,酵母提取物 5,琼脂 20,pH自然;②YPD培养基:蛋白胨 20,葡萄糖 20,酵母提取物 10,琼脂 20,pH自然;③种子培养基:蛋白胨 20,葡萄糖 20,酵母提取物 10,pH自然;④基础发酵产糖培养基:蛋白胨 20,葡萄糖 40,酵母提取物 10,磷酸氢二钾 5,硫酸铵 0.6,pH自然。各培养基115 ℃灭菌30 min。
1.1.3 主要试剂 蔗糖、葡萄糖、麦芽糖、硫酸镁、硫酸铜、氯化钠、氯化钙(分析纯,上海沪试化工有限公司),氯化氢、无水乙醇(分析纯,生工生物工程(上海)股份有限公司)。
1.1.4 仪器与设备 恒温培养箱(DHP-9150B,济南欧莱博医疗器械有限公司);分光光度计(Alpha 1900,上海谱元仪器有限公司);分析天平(TG128,上海美普达仪器有限公司);恒温摇床(XQ-211GZ,上海溪乾仪器设备有限公司);离心机(Z446K,北京毕特博生物技术有限公司);立式电热蒸汽灭菌锅(LDZX-50KBS,上海申安医疗器械有限公司)。
1.2 方法
1.2.1 菌株筛选 将收集的土壤放入烧杯中,加入100 mL蒸馏水,制备成土壤原液。土壤原液32 ℃培养2 d后,取上清液稀释至10-3、10-4,吸取100 μL均匀涂布在LB培养基和YPD培养基上,32 ℃培养3~4 d后取出,观察LB和YPD培养基上菌种形态,分别挑取培养了24 h和48 h的菌落进行电镜观察。挑取菌落颜色较深,表面湿润,产胶较多的菌落在YPD培养基上划线培养,并编号,-80 ℃冰箱保存。
1.2.2 菌株形态学和分子生物学鉴定 ①菌株形态学鉴定:将纯化的菌株在固体培养基上连续划线培养,获得单菌落,连续几天观察菌株生长状况、菌落形态及培养特征,最终确定出某一菌株为实验用出芽短梗霉菌株。②ITS间隔序列分析:用种子培养基对筛选的菌株进行发酵,32 ℃,180 r/min培养2 d,用酵母DNA组试剂盒提取酵母基因组DNA,送至上海生工生物工程股份有限公司测序,采用ITS1和ITS4引物,测序后的拼接结果在NCBI基因库中进行序列对比,构建系统发育树[6],确定筛选菌株。
1.2.3 多糖的粗提取与分离纯化 取5 mL发酵液置离心管中,煮沸30 min,加入预先冷却的无水乙醇,5 000 r/min离心10 min,弃上清液,沉淀在烘箱中干燥后称重,得到粗多糖产物。加入蒸馏水,稀释粗多糖至浓度为5%的多糖水溶液,再加入氯仿、戊醇混合液,充分震荡后5 000 r/min离心10 min,弃沉淀,反复操作至无沉淀后加入4倍体积的无水乙醇,4 ℃静置8 h以上,5 000 r/min离心15 min得到纯多糖。
1.2.4 胞外多糖的鉴定 称取1 g还原糖放入100 mL三角瓶中,加入15 mL蒸馏水、10 mL盐酸,置沸水中水浴30 min完全水解,冷却后加入1滴酚酞试剂,用氢氧化钠中和至中性,混匀。将定容后的水溶液过滤,过滤液去10 mL,移入另一100 mL容量瓶中定容。待测液0.5 mL与1.5 mL蒸馏水和1.5 mL DNS试剂混合,加热30 min冷却后,540 mm波长下测定光密度值。
1.2.5 胞外多糖的结构分析 ①薄层层析:分别取1 g普鲁兰多糖和样品多糖溶解于10 mL蒸馏水中,各制备2份多糖水溶液,分别向其中的一份普鲁兰多糖标准液和样品液中加入100 μL的普鲁兰酶,常温下酶解8 h。将普鲁兰多糖标准溶液、多糖样品溶液、普鲁兰多糖水解液、多糖样品酶解液分别稀释至100倍,按照普鲁多糖标准溶液、多糖样品溶液、普鲁兰多糖水解液、多糖样品酶解液的顺序进行薄层层析。②红外光谱:将得到的多糖组分去溴化钾并与多糖混匀及压片,并在4 000~400/cm进行红外光谱扫描IR吸收。
1.2.6 种子液制备 从YPD培养基中挑取活化的出芽短梗霉SRF菌株接种到种子培养基上,32 ℃,180 r/min培养2 d,得到黑酵母SRF发酵种子液。
1.2.7 基础产糖培养基的优化 ①初始pH值对出芽短梗霉SRF胞外多糖产量的影响:基础产糖培养基的初始pH值分别调至3、4、5、6、7、pH自然(7.45)、8[10]。按10%的接种量,将制备的种子液接种到产糖培养基中,32 ℃,200 r/min培养2 d后测定胞外多糖的产量。②不同碳源对出芽短梗霉SRF产胞外多糖的影响:与①发酵条件相同,以pH 6为最佳pH,在基础产糖培养基中,分别选用麦芽糖、蔗糖、果糖、麦麸糖化液替代葡萄糖,按10%的接种量制备的种子液接种到基础产糖培养基中[7],32 ℃,200 r/min培养2 d后测定胞外多糖的产量。③碳源浓度对出芽短梗霉SRF胞外多糖产量的影响:在上述发酵条件下,以pH 6为最佳pH,基础产糖培养基中以麦芽糖作为最佳碳源,分别调整麦芽糖浓度(质量分数)为4%、6%、8%、10%,按10%的接种量制备的种子液接种到产糖培养基中[7],32 ℃,200 r/min培养2 d后测定胞外多糖的产量。④不同氮源对出芽短梗霉SRF胞外多糖产量的影响:在上述发酵条件下,以pH 6为最佳pH,以麦芽糖和8%(质量分数)麦芽糖作为最佳碳源和最佳碳源浓度条件下,分别用胰蛋白胨、酵母提取物、硫酸铵、硝酸铵代替蛋白胨,接种量10%,32 ℃,200 r/min培养 2 d后测定胞外多糖的产量。⑤氮源浓度对出芽短梗霉SRF胞外多糖产量的影响:在上述发酵条件下,以pH 6为最佳pH,以麦芽糖和8%(质量分数)麦芽糖作为最佳碳源和最佳碳源浓度,酵母提取物作为最佳氮源条件下,分别调整酵母提取物的浓度(质量分数)为2%、2.5%、3%、3.5%,按10%的接种量,将种子液接种到产糖培养基中, 32 ℃,200 r/min培养2 d后测定胞外多糖的产量。⑥不同离子对出芽短梗霉SRF胞外多糖产量的影响:在上述发酵条件下,以pH 6为最佳pH,以麦芽糖和8%(质量分数)麦芽糖作为最佳碳源和最佳碳源浓度,酵母提取物和3%酵母提取物(质量分数)作为最佳氮源和最佳氮源浓度条件下,向基础产糖培养基中添加硫酸镁、硫酸铜、氯化钠、氯化钙[9],使终浓度为0.3 g/L,32 ℃,200 r/min培养2 d后测定胞外多糖的产量。⑦无机离子浓度对出芽短梗霉SRF胞外多糖产量的影响:在上述发酵条件下,以pH 6为最佳pH,以麦芽糖和8%麦芽糖作为最佳碳源和最佳碳源浓度,酵母提取物和3%(质量分数)酵母提取物作为最佳氮源和最佳氮源浓度,以钙离子作为最佳无机离子的条件下,接种量10%,无机离子质量浓度分别设置为0.1、0.2、0.3、0.4和0.5 g/L,32 ℃,200 r/min培养2 d后测定胞外多糖的产量。
1.2.8 响应面Plackett-Burman和Box-Behnken设计 ①Plackett-Burman实验设计:在前期单因素实验的基础上,以短梗霉多糖产量为响应值,选用N=12的Plackett-Burman实验设计对6种因子(麦芽糖、葡萄糖、酵母提取物、镁离子、钠离子、钙离子)进行分析,再选取5个虚拟项对该实验进行误差估计。每个因子取高低两个水平,高水平编码为+1,低水平编码为-1,高低水平包含有最佳因素取值点,具体因子取值见表3。运用Minitab软件对数据进行分析,从而筛选出对胞外多糖产量影响最大的几个因素进行下一步的响应面实验。②响应面Box-Behnken设计:根据Plackett-Burman实验结果,Box-Behnken实验原理。以胞外多糖的产量为影响值,选取培养基中的麦芽糖浓度、酵母提取物浓度、钙离子浓度为自变量,在每个因素中,选择影响多糖产量的最佳区域和适当水平,运用Design-Expert.V8.0.6软件进行数据分析。
1.2.9 基础产糖培养基最优条件的验证 为了验证响应面Plackett-Burman和Box-Behnken实验结果的可靠性,完成上述实验后,对优化后的条件进行验证,进行3次重复实验(培养基pH调为单因素试验中的最优pH 6),测定胞外多糖的产量。
2 结果与分析
2.1 菌株的鉴定
LB和YPD培养基上的圆形菌落表面光滑,黏稠湿润,菌落质地均匀、颜色均一,培养24 h后显微观察,见单一卵圆形细胞,培养48 h,见细胞聚集,出现假菌丝体,初步判定该圆形菌株符合出芽短梗霉属的特征。
将菌株Aureobasidiumsp.SRF进行ITS间隔序列测定、拼接,复制拼接后的序列,在NCBI数据库里进行16S rDNA序列Blast比对,选取与已知序列相似性高的17株菌株构建系统进化树(图1)。菌株Aureobasidiumsp.SRF与菌株DothioracannabinaeAFTOL-ID 1359和EndoconidiomapopuliUAMH 10297源于同一根,与Aureobasidiumpullulansstrain A32A1同源性大于99%以上,具有非常相近的亲缘关系,再结合菌株的形态学特征,确定该菌株属于出芽短梗霉属。

图1 筛选菌株与相似菌株的系统进化树Fig.1 Phylogenetic tree of highly sequence-like strains
2.2 胞外多糖的结构鉴定
图2A中,1、2、3、4依次为普鲁兰多糖标准液、多糖样品液、普鲁兰多糖水解液、多糖样品酶解液。α-1,6葡萄糖苷键可以被普鲁兰酶特异识别并水解,而其他糖苷键不能被普鲁兰酶水解,图2A可知,普鲁兰多糖标准液和多糖样品被普鲁兰酶水解之后,都生成了由α-1,6葡萄糖苷键水解产生的麦芽三糖,证明该多糖样品为普鲁兰多糖[11]。
根据图2B,红外光谱中标准品和样品均有两个特征峰,且他们的特征峰均在基本相同的位置,证明该多糖样品为普鲁兰多糖。

图2 Aureobasidium sp. SRF胞外多糖的结构鉴定Fig.2 Structural identification of extracellular polysaccharides
2.3 基础产糖培养基条件的优化
2.3.1 不同初始pH对出芽短梗霉SRF胞外多糖产量的影响 不同的pH值也会影响胞外多糖的产量,如图3所示,当产糖培养基的pH值从3增加到6时,胞外多糖产量最高,胞外多糖的产量与pH成正比;当超过pH 6,胞外多糖的产量与pH成反比,故pH 6时胞外多糖产量最高。
2.3.2 不同碳源及碳源浓度对出芽短梗霉SRF胞外多糖产量的影响 不同的碳源及碳源浓度影响胞外多糖的产量,如图4所示。图4a中基础产糖培养基中的碳源是麦芽糖时短梗霉多糖产量最高,碳源为葡萄糖、蔗糖、麦麸糖化液、果糖时胞外多糖产量依次降低,故产糖培养基中的最佳碳源为麦芽糖;当产糖培养基中的碳源选作最佳碳源麦芽糖时,该碳源浓度对黑酵母胞外多糖产量的影响如图4b所示,随着碳源浓度的增加,胞外多糖的产量随着增加;当碳源浓度增加到8%(质量分数)时,胞外多糖产量最高,当碳源浓度继续增加,胞外多糖产量与碳源浓度成反比,故8%(质量分数)麦芽糖胞外多糖产量最高。
2.3.3 不同氮源及氮源浓度对出芽短梗霉SRF产胞外多糖的影响 不同的氮源及氮源浓度影响胞外多糖的产量,如图5所示。图5a中产糖培养基中的氮源是酵母提取物时,胞外多糖产量最高,氮源为蛋白胨、胰蛋白胨、硫酸铵、硝酸铵胞外多糖产量依次降低,故产糖培养基中的最佳氮源为酵母提取物;当产糖培养基中的氮源选作最佳氮源酵母提取物时,该氮源浓度对普鲁兰酵母胞外多糖产量的影响如图5b所示,当氮源浓度增加到3%(质量分数)时,短梗霉多糖产量最高,胞外多糖的产量与氮源浓度成正比;当氮源浓度超过3%(质量分数),胞外多糖产量与氮源浓度成反比,故3%(质量分数)酵母提取物胞外多糖产量最高。
2.3.4 无机离子及浓度对出芽短梗霉SRF产胞外多糖的影响 添加不同的离子及离子浓度会影响胞外多糖的产量,本研究主要通过添加不同化合物来添加无机离子,实验结果如图6所示。图6a中,当产糖培养基中的化合物为氯化钙时,胞外多糖产量最高,不同化合物为氯化钠、硫酸镁、硫酸铜时胞外多糖产量依次降低,故最佳化合物为氯化钙;当产糖培养基中最佳化合物为氯化钙时,该化合物浓度对黑酵母胞外多糖产量的影响如图6b所示,当无机离子质量浓度增加到0.3 g/L时,胞外多糖的产量最高,胞外多糖的产量与无机离子浓度成正比;当无机离子浓度超过0.3 g/L时,胞外多糖的产量与无机离子浓度成反比,故0.3 g/L钙离子,胞外多糖产量最高。
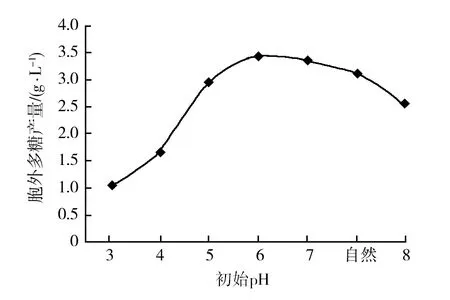
图3 不同初始pH对胞外多糖产量的影响Fig.3 The effect of initial pH on the production of extracellular polysaccharides by Aureobasidium sp.SRF


图4 不同碳源及麦芽糖浓度对胞外多糖产量的影响
Fig.4EffectsofdifferentcarbonsourcesconcentrationandmaltoseconcentrationontheproductionofextracellularpolysaccharidesbyAureobasidiumsp.SRF

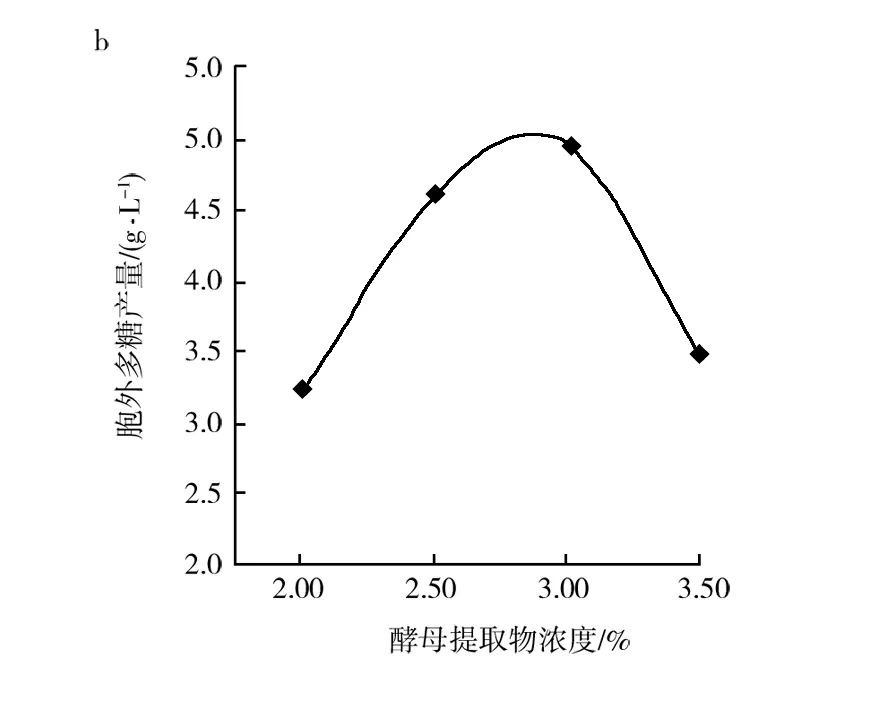
图5 不同氮源及酵母提取物浓度对胞外多糖产量的影响
Fig.5EffectsofdifferentnitrogensourcesconcentrationandyeastextractconcentrationontheproductionofextracellularpolysaccharidesbyAureobasidiumsp.SRF
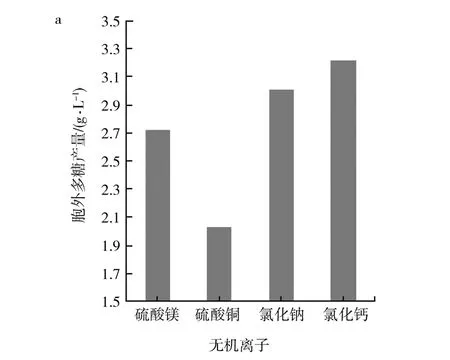
图6 无机离子及钙离子浓度对胞外多糖产量的影响
Fig.6EffectofinorganicionconcentrationandCalciumionconcentrationontheproductionofextracellularpolysaccharidesbyAureobasidiumsp.SRF
2.4 响应面分析
2.4.1 Plackett-Burman结果分析 通过基础产糖培养基条件的优化,确定了最佳产糖培养基条件及最佳取值范围,根据Plackett-Burman实验设计方案,确定6个因子各自的高低水平,见表3。
根据Plackett-Burman的实验设计,按照N=12进行实验,Plackett-Burman实验设计方案及相应的普鲁兰多糖产量的响应值见表4,Plackett-Burman各因素效应分析见表5、图7。
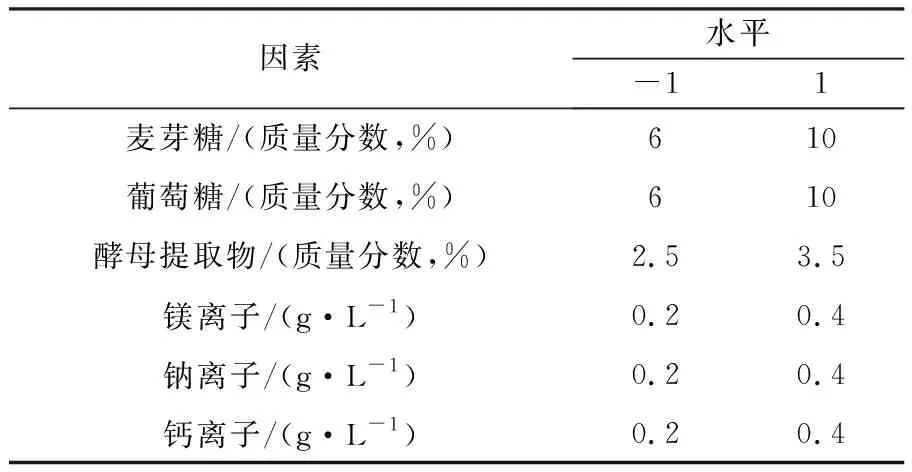
表3 Plackett-Burman实验因素与水平表

表4 Plackett-Burman试验方案与结果
使用Minitab软件进行Plackett-Burman实验分析,表4、表5、图7中实验因素麦芽糖、酵母提取物、无机离子对出芽短梗霉胞外多糖的产量均有显著影响,无机离子中钙离子对胞外多糖产量的影响最大,故选取这3个因素作为出芽短梗霉产胞外多糖的关键因素进行响应面分析来确定它们的最优水平[12]。
2.4.2 Box-Behnken结果分析 通过Plackett-Burman实验确定了麦芽糖、酵母提取物、钙离子浓度为影响出芽短梗霉胞外多糖产量的显著因素。为了确定这3个因素对普鲁兰多糖发酵的综合影响及最佳配比,使用Box-Behnken试验方法对这3个因素进行考察,实验因素见表6,实验方案与结果见表7。

表5 Plackett-Burman因素效应分析

表6 Box-Behnken实验因素与水平表
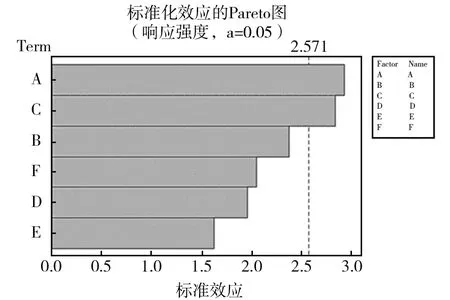
图7 效应Pareto图Fig.7 Effect Pareto diagram
使用Design-Expert.V8.0.6软件对Box-Behnken实验结果进行二次回归分析,回归方程:Y=5.78-0.054×A-0.17×B+0.25×C+7.500E-0.03×A×B-0.085×A×C+0.040×B×C-0.52×A2-0.31×B2-0.50×C2
式中Y为出芽短梗霉发酵液中总多糖含量的预测值,A、B、C分别为被测因素的编码值,“×”表示A、B、C之间的交互作用。
对回归方程进行检验(见表8),自变量A(麦芽糖浓度)、B(酵母提取物浓度)和C(钙离子浓度)与因变量之间的线性关系显著(P<0.05)。其中B、C对Y值的影响达到了极显著水平,从交互作用上来看,A和C交互作用显著,而A和B、B和C的交互作用不显著,这说明自变量因素和响应值之间不是简单的线性关系,二次项对响应值也有很大的影响。
2.4.3 响应曲面分析 通过Design-Expert.V8.0.6软件分析,得到响应面立体分析图(图8、图9、图10),每个响应面分别代表着两个独立变量之间的相互作用关系[13]。直观地反映了麦芽糖浓度、酵母提取物浓度、钙离子浓度各因素之间交互作用对胞外多糖产量的影响,各因素之间交互作用越明显,图形就越近似椭圆形,交互作用越弱,图形越近似圆形,等高线图的形状直接反映出各因素交互作用的强弱[14]。
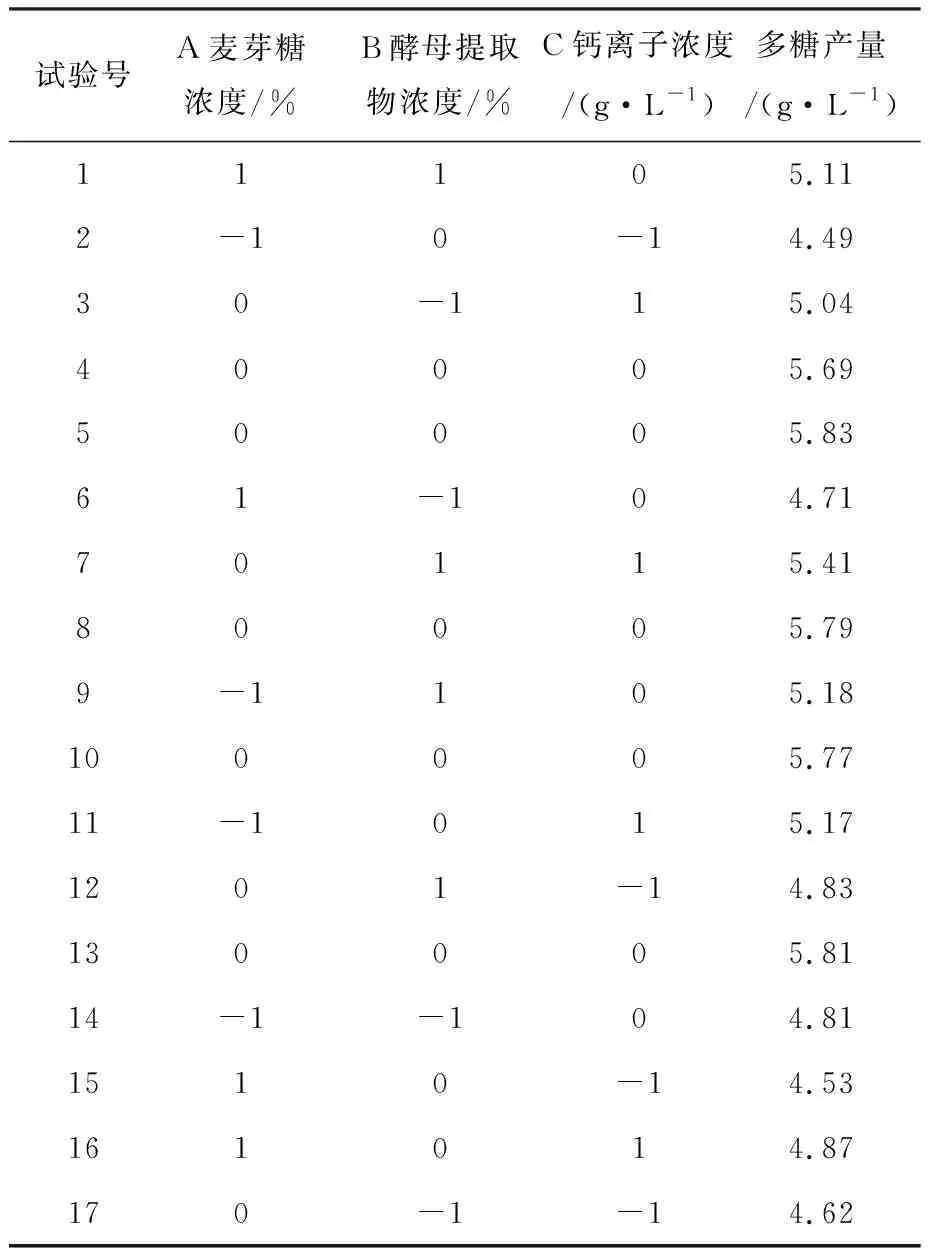
表7 Box-Behnken试验方案与结果
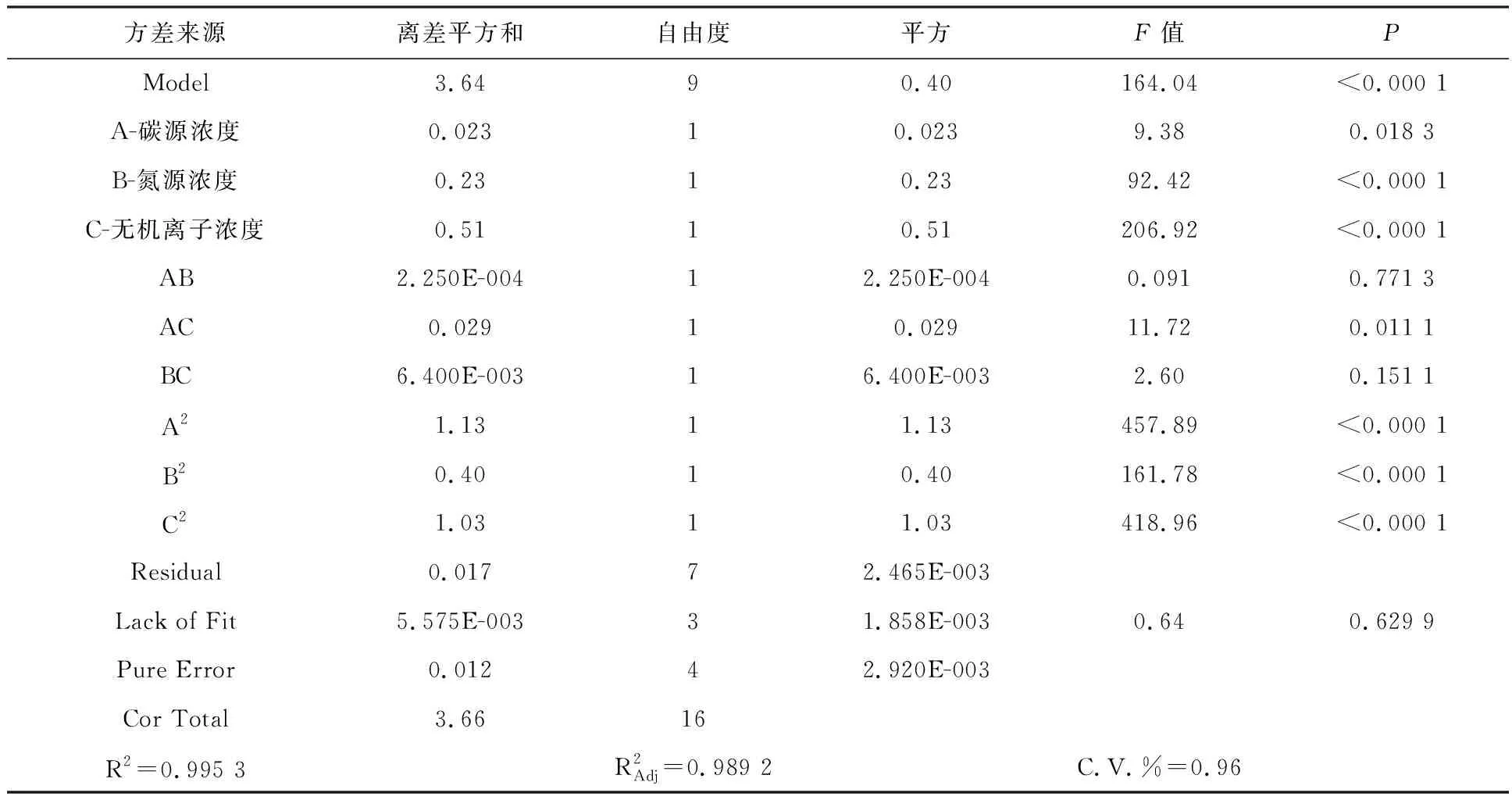
表8 Box-Behnken模型方差分析
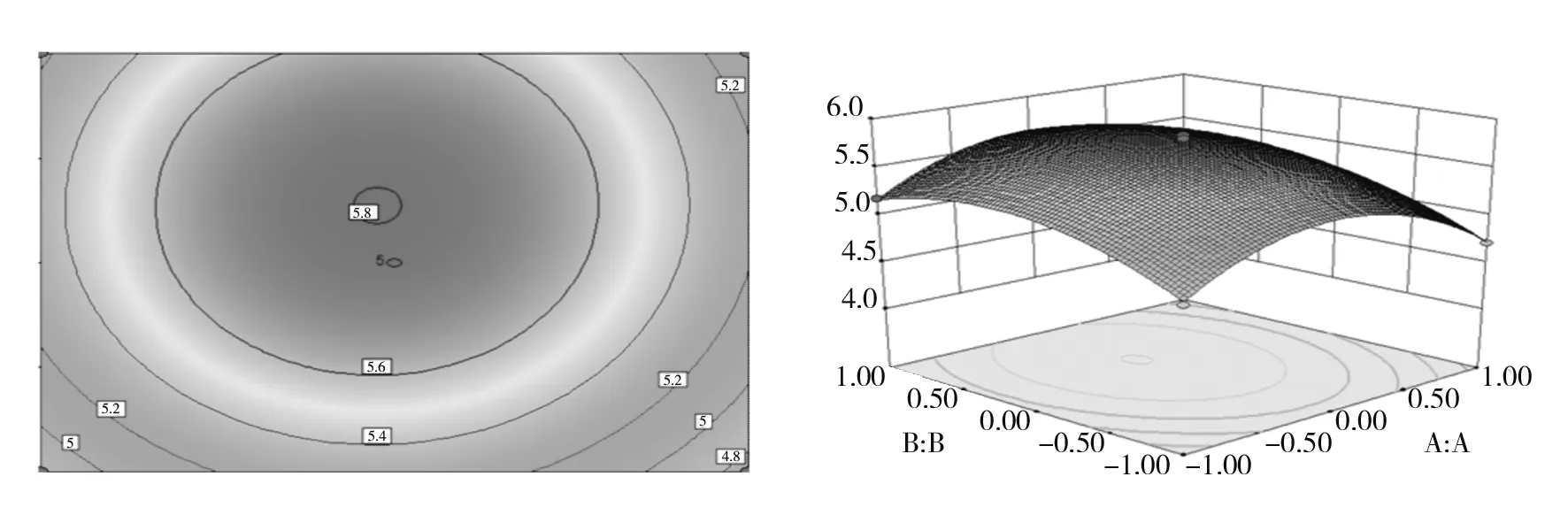
图8 麦芽糖浓度和酵母提取物浓度对普鲁兰多糖产量的响应面图和等高线图Fig.8 Response surface and contour diagrams of maltose concentration and yeast extract concentration to the yield of Prulan polysaccharides
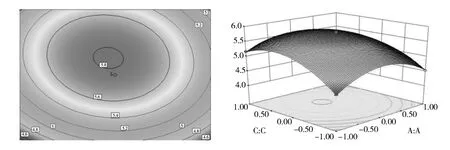
图9 麦芽糖浓度和钙离子浓度对普鲁兰多糖产量的响应面和等高线图Fig.9 Response surface and contour diagram of maltose concentration and Calcium ion concentration to the yield of Prulan polysaccharides
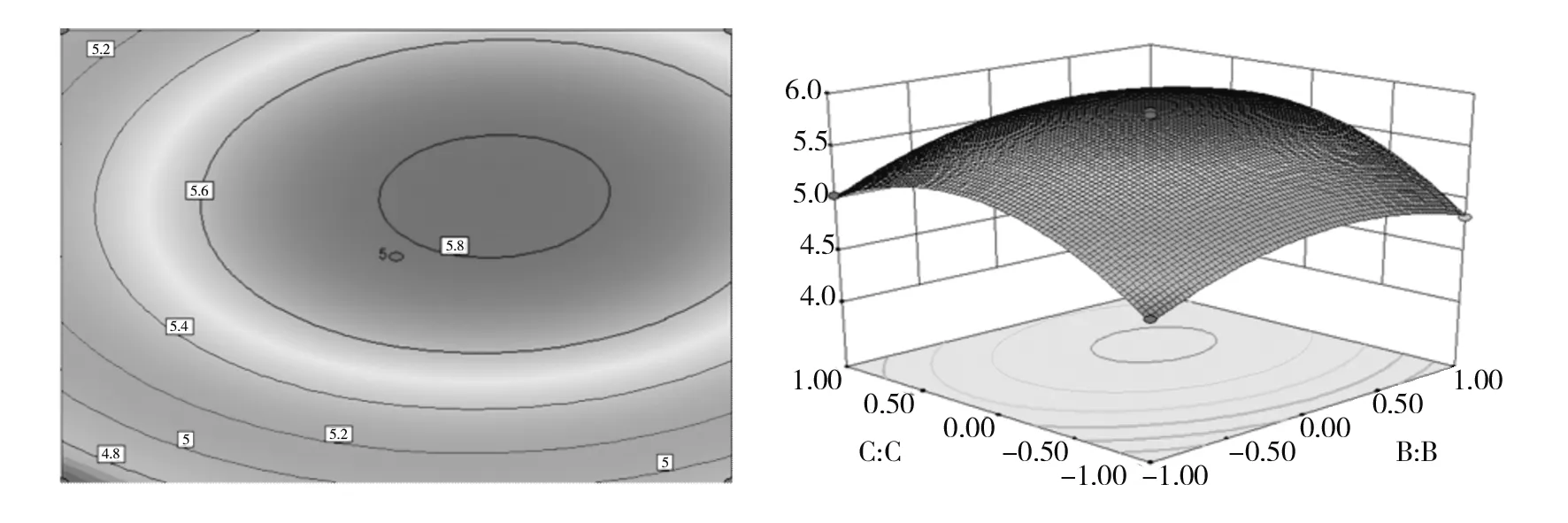
图10 酵母提取物浓度和钙离子浓度对普鲁兰多样产量的响应面和等高线图Fig.10 Response surface and contour diagram of yeast extract concentration and Calciumion concentration to various yields in Plurland
图8~10中响应面图呈向上凸起的趋势,说明麦芽糖浓度、酵母提取物浓度、无机离子浓度在不断变化时,响应值也在随之不断变化。当响应值达到最大值时,麦芽糖浓度、酵母提取物浓度、钙离子浓度达到最优条件(图8、图9、图10)。等高线图呈现椭圆形,说明麦芽糖浓度和钙离子浓度交互作用显著(图9)。而等高线图呈现圆形,说明麦芽糖浓度和酵母提取物浓度的交互作用、酵母提取物浓度和钙离子浓度的交互作用不显著[15](图8、图10)。
2.4.4 基础产糖培养基最优条件的验证 在基础产糖培养基最优条件的验证性试验中,胞外多糖的产量为5.838 94 g/L。这比任一单因素单独设置,胞外多糖的产量都要高。因此得出出芽短梗霉SRF发酵产茁霉多糖的最优条件:麦芽糖8%(质量分数)、酵母提取物3%(质量分数)、钙离子 0.3 g/L、pH 6。
3 讨 论
本研究的出发菌株是从意大利树莓(Rubuscorchorifolius)浆果表面分离的1株野生型菌株。经过形态学及ITS间隔序列测定、拼接和比对后,菌株SRF与Aureobasidiumpullulans同源性大99%以上,具有非常相近的亲缘关系,结合菌株的形态学特征,确定该菌株属于出芽短梗霉属(Aureobasidiumspp.),命名为Aureobasidiumsp. SRF。通过薄层层析和红外光谱分析,确定SRF产胞外多糖的结构与标准品普鲁兰多糖的结构一致[3,16],说明SRF产生的胞外多糖为普鲁兰多糖(Pullulan)。优化基础产糖培养基的条件,如不同碳源、碳源浓度、氮源、氮源浓度,是提高短梗霉多糖产量的重要手段[7,17]。本研究通过优化基础培养基的碳源、碳源浓度、氮源、氮源浓度、无机离子、无机离子浓度、pH值,发现普聚多糖的产量会随着任一单因素水平变化而改变,通过响应面Plackett-Burman和Box-Behnken设计筛选出最优产糖基础培养基:麦芽糖 8%(质量分数)、酵母提取物 3%(质量分数)、钙离子 0.3 g/L、pH 6。优化后普鲁兰多糖的产量达到5.93 g/L。因此,出芽短梗霉Aureobasidiumsp. SRF是一株产普鲁兰多糖新菌株,开展对SFR的基础研究不仅丰富了出芽短梗霉属产普鲁兰多糖的菌种资源,也为进一步寻找新的产糖菌株和开发高产糖菌株资源提供借鉴。
