乳酸菌发酵豆清液制备多肽及其体外抗氧化活性研究
2020-06-15尹乐斌周娟何平廖聪杨爱莲刘丹李立才
尹乐斌,周娟,何平,廖聪,杨爱莲,刘丹,李立才
1(邵阳学院 食品与化学工程学院,湖南 邵阳,422000) 2(豆制品加工与安全控制湖南省重点实验室,湖南 邵阳,422000)
乳酸菌(lactic acid bacteria,LAB)是一类能够利用可发酵碳水化合物产生大量乳酸的无芽孢、革兰氏阳性细菌[1]。研究表明,乳酸菌有多种益生功能,包括促进食物的消化和吸收、降低血液中胆固醇的含量、缓解乳糖不耐症、改善便秘、抗肿瘤及预防衰老[2-4]等,被广泛用于改善食品风味[5]、提高食品营养价值[6]及提高食品保藏性和附加值[7]等方面。乳酸菌在发酵过程中产生的蛋白酶降解蛋白得到不同分子质量的寡肽[8],因此,用乳酸菌发酵制备生物活性肽也是近年来的研究热点。
大豆多肽是大豆蛋白的水解产物,具有多种生理活性功能,包括血管紧张素转化酶抑制活性[9-10]、抗氧化活性[11-13]、抗肿瘤活性[14]等。目前生产大豆多肽的主要原料为大豆粕、大豆分离蛋白、大豆粉等,采用的方法主要有酶水解法和发酵法,利用大豆加工废水生产大豆活性多肽目前还未见报道。豆清液俗称黄浆水,是传统豆制品生产过程中蹲脑和压榨工序产生的废水,含有丰富的营养物质,包括多糖、蛋白质及其他生理活性成分[15],直接排放会导致河水的生物需氧量(biology oxygen demmand, BOD)值和化学需氧量(chemical oxygen demmand, COD)值升高,不仅造成环境污染,同时也是资源浪费。目前,有关豆清液综合利用的研究主要集中在功能物质提取[16-17]、豆清液发酵制品及凝固剂的制备[18-19]、豆清液新产品开发[20-21]等,利用益生菌发酵豆清液制备生物活性多肽还鲜有报道。本研究利用乳酸菌发酵过程中产胞外酶水解豆清液制备大豆多肽,并对其体外抗氧化活性进行测定,以期为豆清液综合利用提供新的思路。
1 材料与方法
1.1 材料与试剂
豆清液,本实验室提供;乳酸菌,本实验室分离鉴定;牛血清蛋白,北京鼎国昌盛生物技术有限责任公司;三氯乙酸(TCA),天津市光复精细化工研究所;2,2-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸) [2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]、1,1-二苯基-2-苦肼基自由基(1,1-diphenyl-2-picrylhydrazyl free radical,DPPH),上海如吉生物科技发展有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
SW-CJ-2FD双人单面(垂直)净化工作台,江苏通净净化设备有限公司;UV2900紫外-可见分光光度计,上海恒平科学仪器有限公司;Velocity V18 R高速冷冻离心机,Dynamica Scientific Ltd;DH-360AB电热恒温培养箱,北京中兴伟业有限公司;FE28型pH计,Mettler Toledo;冷冻干燥机,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 乳酸菌发酵豆清液制备多肽工艺
菌种活化、驯化→调整菌体浓度为108CFU/mL
↓
豆清液收集→分装→灭菌→调pH→乳酸菌发酵制备多肽粗发酵液→离心→调节pH至7→测定多肽含量→冷冻干燥→-20 ℃保藏备用→测定抗氧化活性
1.3.2 乳酸菌菌种活化
将冻存管中菌种室温解冻后于30 ℃水浴30 min,再转接于20 mL液体培养基中,37 ℃下静置培养24 h转接于新的培养基培养24 h;然后将菌种划线到固体培养基上培养24 h,转接2代,得到活化的菌种;用无菌水将平板上的菌种洗下转接至豆清液培养基中,培养24 h,调整种子液中菌体浓度为108CFU/mL得到种子液,保证每次实验菌种活化代数一致。
1.3.3 豆清液多肽含量的测定
参考鲁伟等[22]的方法略作修改:将样品溶液与100 g/L的TCA溶液按1∶1的体积比混合均匀,室温下静置10 min,在7 000 r/min条件下离心15 min,取上清液按V(样液)∶V(双缩脲试剂)=3∶2的混合均匀,室温下静置30 min,测定吸光度值(空白用去离子水代替样品),对照标准曲线计算样品中多肽质量浓度ρ(mg/mL),根据公式(1)计算多肽产率:

(1)
1.3.4 复合发酵菌种配比
将实验室分离鉴定的乳酸菌明串珠菌M-6(LeuconostocmesenteroidesM-6)、植物乳杆菌3-2(Lactobacillusplantarum3-2)、玉米乳杆菌5-1(Lactobacilluszeae5-1)、副干酪乳杆菌5-2(Lactobacilluscasei5-2)、干酪乳杆菌2-1(Lactobacilluscasei2-1)、鼠李糖乳杆菌3-1(Lactobacillusrhamnosus3-1)(分别简称为M-6、3-2、5-1、5-2、2-1、3-1),分别接种至灭菌的豆清液中,以多肽产率为考察指标,挑选去除多肽产率最低的乳酸菌,再对剩下的乳酸菌进行每3株1∶1∶1复配,挑选出多肽产率最高的复配组合菌,确定发酵菌种。
1.3.5 单因素试验
(1)菌种添加量对乳酸菌发酵豆清液制备大豆多肽产率的影响
固定菌种配比(3-1∶5-1∶5-2)为1∶1∶1,初始pH为6.4,发酵温度为37 ℃,发酵时间为16 h,菌种添加量分别为1%、2%、3%、4%、5%(体积分数,下同)探究菌种添加量对乳酸菌发酵豆清液制备大豆多肽的影响。
(2)初始pH对乳酸菌发酵豆清液制备大豆多肽产率的影响
固定菌种配比(3-1∶5-1∶5-2)为1∶1∶1,发酵温度为37 ℃,发酵时间为16 h,菌种添加量4%,初始pH分别为5.2、5.6、6.0、6.4、6.8探究初始pH对乳酸菌发酵豆清液制备大豆多肽的影响。
(3)发酵温度对乳酸菌发酵豆清液制备大豆多肽产率的影响
固定菌种配比(3-1∶5-1∶5-2)为1∶1∶1,初始pH为6.4,发酵时间为16 h,菌种添加量4%,发酵温度分别为27、32、37、42、47 ℃探究发酵温度对乳酸菌发酵豆清液制备大豆多肽的影响。
(4)发酵时间对乳酸菌发酵豆清液制备大豆多肽产率的影响
固定菌种配比(3-1∶5-1∶5-2)为1∶1∶1,初始pH为6.4,菌种添加量4%,发酵温度为42 ℃,发酵时间分别为8、12、16、20、24 h,探究发酵时间对乳酸菌发酵豆清液制备大豆多肽的影响。
1.3.6 大豆多肽工艺制备工艺优化
在单因素试验结果的基础上,选取菌种添加量(A)、初始pH(B)、发酵温度(C)、发酵时间(D)为变量因素,采用响应面分析法中Box-Menken的中心组合试验设计对乳酸菌发酵豆清液制备多肽的工艺进行优化。
1.3.7 体外抗氧化活性测定
·OH清除率测定参考DOU等[23]的方法;ABTS自由基清除率测定参考等YILMAZ-ERSAN等[24]的方法;DPPH自由基清除率测定参考MOYO等[25]的方法。
1.4 试验数据处理
每组试验重复3次,用Office Excel 2003进行误差分析;SPSS进行方差分析、相关性和差异显著性分析;Origin 9.0进行绘图及Design-Expert V 8.0.6.1进行响应面优化。
2 试验结果与分析
2.1 菌种筛选结果
从实验室确定的6株乳酸菌中筛选适合发酵豆清液制备多肽的乳酸菌,从图1可以看出,6株乳酸菌都具有产多肽的能力,其中3-2相较于其他菌株的产多肽能力较差,因此将除3-2以外的其余菌株每3个复配并与纯种发酵的豆清液多肽产率进行比较,结果如图2所示。

图1 不同菌种对多肽产率的影响Fig.1 Effect of different strains on polypeptide yield注:不同小写字母表示具有显著性差异(P<0.05)(下同)
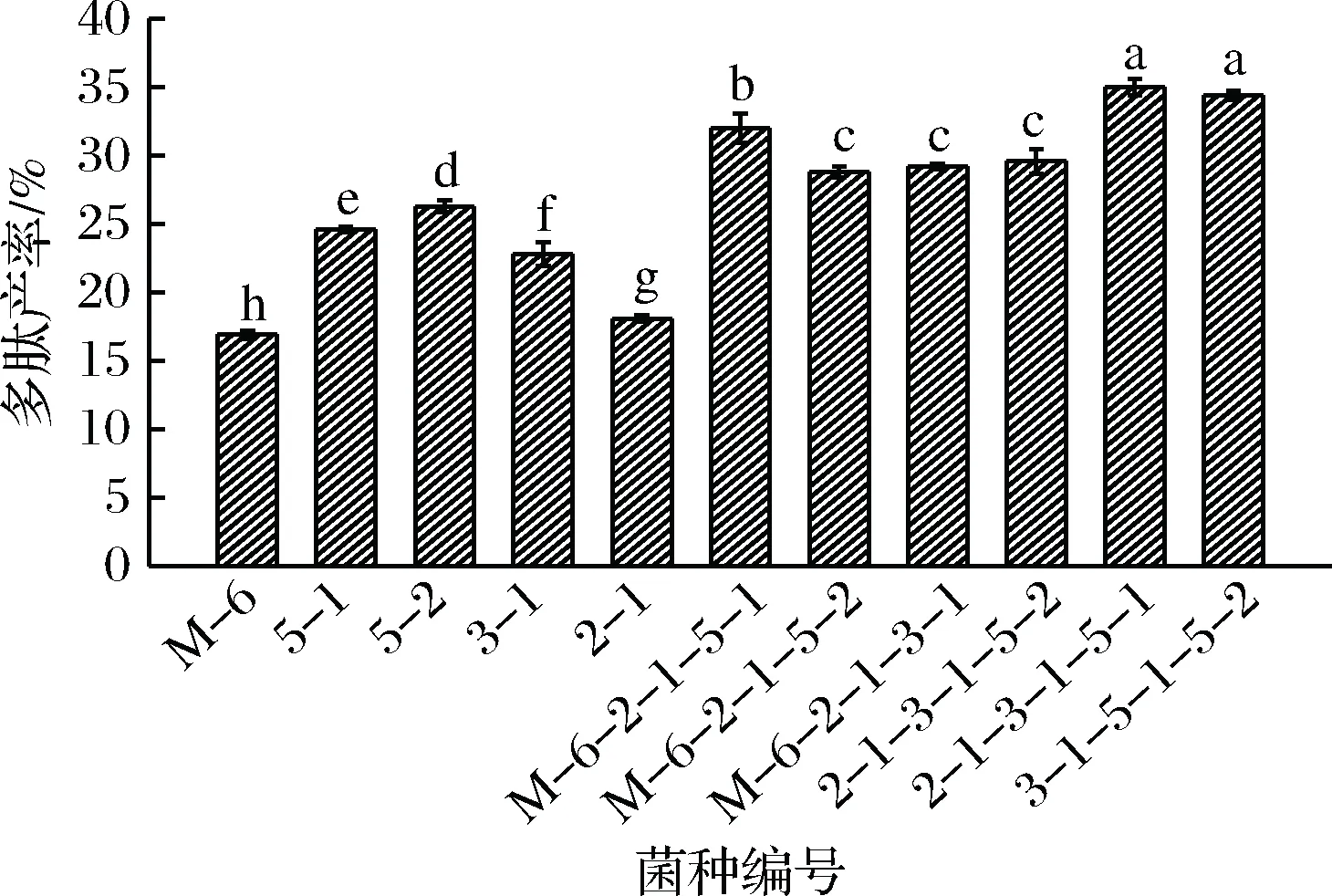
图2 不同菌种复配对多肽产率的影响Fig.2 Effect of different mixed strains on polypeptide yield
总体来说,复配发酵豆清液的多肽产率高于纯种发酵豆清液的多肽产率。2-1、5-1、5-2组合与3-1、5-1、5-2多肽产率最高,且在统计学上没有显著差异,结合实验具体条件干酪乳杆菌2-1生长缓慢不易培养,因此选择3-1、5-1、5-2复配为后续实验所需菌种。
2.2 单因素结果分析
2.2.1 菌种添加量对乳酸菌发酵豆清液制备大豆多肽的影响
菌种添加量对乳酸菌发酵豆清液制备多肽的影响如图3所示,呈先增加后降低的趋势,当菌种添加量为4%时,多肽产率最高,这表明并不是接种量越高乳酸菌发酵豆清液制备多肽的产率就越高。在一定范围内适量地增加接种量有利于菌种适应发酵环境缩短迟缓期的时间,尽快达到对数生长期;但是当乳酸菌接种量过大时发酵体系中乳酸菌快速达到稳定生长期,一方面产蛋白酶的速度较对数生长期慢,另一方面,产乳酸速度增加这些因素都导致多肽产率降低。因此确定4%为后续实验的接种量。

图3 菌种添加量对多肽产率的影响Fig.3 Effect of the amount of bacteria added on thepolypeptide yield
2.2.2 初始pH对乳酸菌发酵豆清液制备大豆多肽的影响
pH对微生物的影响主要包括影响大分子物质、核酸等的电荷变化,影响细胞膜的电荷变化会影响营养物质的吸收,其次就是对环境中营养物质的可给性及有害物质毒性的改变[26],除了对乳酸菌的生长产生影响以外,初始pH对乳酸菌产蛋白酶的能力也有一定影响[27]。在乳酸菌发酵豆清液制备多肽的实验中多肽产率同初始pH的关系如图4所示。从图4中可以看出,多肽产率随着初始pH的变化呈先上升后下降的趋势,当初始pH值为6.4时多肽产率最高为36.3%。因此,选择pH值为6.4的条件对后续试验进一步优化。

图4 初始pH对多肽产率的影响Fig.4 Effect of initial pH on polypeptide yield
2.2.3 发酵温度对乳酸菌发酵豆清液制备大豆多肽的影响
温度高低主要影响微生物的代谢活动,在一定范围内随着温度升高,乳酸菌的代谢活动增强,但是如果温度过高,乳酸菌菌株蛋白发生变性沉降自代谢能力从而受到限制[28](见图5)。温度为27~32 ℃时多肽产率上升明显,32~42 ℃时变化趋势不大,说明乳酸菌生长对温度有一定的适应性,从结果中可以看出当温度为42 ℃时,多肽产率最高。

图5 发酵温度对多肽产率的影响Fig.5 Effect of fermentation temperature on polypeptide yield
2.2.4 发酵时间对乳酸菌发酵豆清液制备大豆多肽的影响
发酵时间对多肽产率的影响如图6所示,在发酵初期多肽产率略微有所增加,当发酵时间为达到8 h时产率有所降低,8~12 h持续增加并在12 h达到最高,后呈缓慢降低趋势。出现这种情况的原因可能是因为发酵初期,菌种需要生长繁殖因此开始分泌胞外酶切割蛋白质,但是菌种在前期适应环境阶段需要蓄积大量营养物质,因此大部分氨基酸、多肽和小分子寡肽被乳酸菌利用导致发酵液中多肽含量降低[10, 29]。当乳酸菌度过适应期进入对数生长期以后,胞外酶分泌量加大发酵液中多肽含量增加。而乳酸菌产胞外酶的主要作用是为了满足自身生长需要,稳定期以后的乳酸菌开始大量吸收肽类物质并产乳酸,胞外酶分泌减少,随着时间增加部分多肽进一步水解成为氨基酸,从而导致多肽产率下降。综上所述确定发酵12 h为最佳发酵时间。

图6 发酵时间对多肽产率的影响Fig.6 Effect of fermentation time on polypeptide yield
2.3 响应面试验结果
2.3.1 响应面设计方案与优化结果
以单因素实验的结果为依据,确定菌种添加量(A)、初始pH(B)、发酵温度(C)和发酵时间(D)为响应面优化的响应变量,借助Design-Expert 8.0.6.1软件Box-Behnken的中心组合设计,以样品的多肽产率(Y)为响应值,对乳酸菌发酵豆清液制备多肽的发酵工艺进行优化。响应面因素与水平见表1,结果见表2。

表1 Box-Behnken试验设计因素与水平Table 1 Factors and levels of Box-Behnken experimentdesign

表2 Box-Behnken试验方案与结果Table 2 Box-Behnken experiment design and results
续表2

试验编号A菌种添加量/%B初始pHC发酵温度/℃D发酵时间/h多肽产率/%14000059.7150-10-155.916-100144.917010-146.91800-1-152.519101046.1200-11051.921010157.32200-1151.723100-151.324000058.725110050.126000058.127-10-1045.128-110048.5291-10048.3
2.3.2 模型方程的建立及显著性分析
运用Design-Expert 8.0.6 软件对表2中的试验结果进行多元回归拟合得到多肽产率和4个因素之间的关系为:多肽产率(Y)=58.76+2.05A+0.84B-1.46C-0.38×D-0.85×A×B-1.70×A×C-0.90×A×D-2.67×B×C+5.45×B×D+0.40×C×D-7.46×A2-3.87×B2-4.12×C2-3.86×D2。对回归方程进行方差分析,结果如表3所示。

表3 回归模型方差分析Table 3 Analysis of variance of the constructedregression model
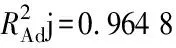

2.3.3 最佳发酵工艺的验证
经过Design-Expert 8.0.6软件分析得到乳酸菌发酵豆清液制备多肽工艺的最佳条件为:菌种添加量为4.71%,初始pH值为6.44,发酵温度为40.21 ℃,发酵时间为11.66 h。在此条件下经软件预测的多肽产率为(56.97±0.27)%。结合发酵过程实际操作方便,调整参数为:菌种添加量为4.70%,初始pH值为6.40,发酵温度为40.00 ℃,发酵时间为12.00 h,经3次验证实验测得多肽产率为(57.33±0.32)%与预测值(56.97±0.27)%无显著差异(P>0.05)。
2.4 体外抗氧化活性测定结果
2.4.1 ·OH清除率
对在最优条件下发酵后的豆清液样品进行冷冻干燥并测定其体外抗氧化活性。从图7-a中可以看出,经过发酵以后的豆清液干燥样·OH清除率高于未发酵的豆清液干燥样,这可能和发酵后豆清液中多肽含量增高有关。发酵和未发酵的豆清液干燥样对·OH清除率的EC50分别是17.84和21.51 mg/mL,但和对照品Vc(图7-b EC50为0.006 4 mg/mL)相比活性还较低。
2.4.2 ABTS清除率
经过发酵以后豆清液对ABTS自由基的清除率有明显提高如图8-a所示,未发酵的豆清液干燥样的EC50为1.14 mg/mL,发酵过后的豆清液干燥样的EC50为0.24 mg/mL,比未发酵样品提高了4.75倍,图8-b是Vc对ABTS的清除率与Vc浓度的关系,其EC50为0.011 mg/mL。通过对比可以得出和·OH清除率相比,样品对ABTS自由基的清除率更强。
2.4.3 DPPH清除率
豆清液发酵前后及Vc对DPPH的清除情况见图9,从图9中可以看出经过发酵以后豆清液对DPPH的清除率有所上升,EC50由7.61 mg/mL降低到了3.53 mg/mL,清除率增加了1.16倍,清除率较强,但是和Vc(EC50=0.007 48 mg/mL)对照相比还是一定的差距。

图7 多肽样品及Vc浓度对·OH清除率的影响Fig.7 ·OH radical-scavenging activity of peptide and Vc
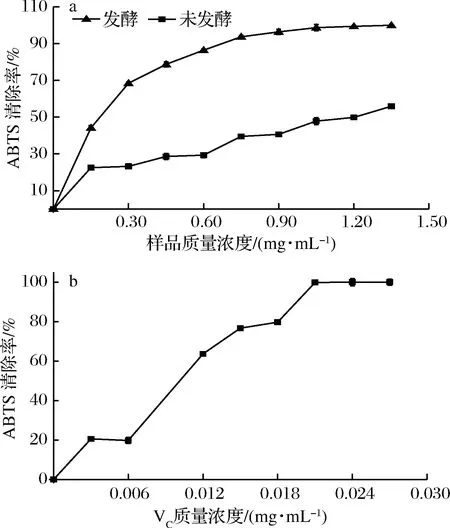
图8 多肽样品及Vc质量浓度对ABTS自由基清除率的影响Fig.8 ABTS radical-scavenging activity of peptide and Vc
3 结论
通过响应面法优化得到的乳酸菌发酵豆清液制备大豆多肽的工艺条件为菌种添加量为4.71%、初始pH为6.44、发酵温度为40.21 ℃、发酵时间为11.66 h,模型预测多肽产率为(56.97±0.27)%。

图9 样品及Vc质量浓度对DPPH自由基清除率的影响Fig.9 DPPH radical-scavenging activity of peptide and Vc
结合发酵生产实际情况调整工艺参数为:菌种添加量为4.70%,初始pH值为6.40、发酵温度为40.00℃、发酵时间为12.00 h,经3次验证实验测得多肽产率为(57.33±0.32)%与理论预测值无显著差异(P>0.05)。
豆清液发酵前后的体外抗氧化活性测定表明,发酵后的豆清液多肽对·OH、ABTS自由基、DPPH自由基清除的EC50分别为17.84、1.14和7.61 mg/mL,较发酵前分别提高了1.2、4.75和2.16倍。
