棒曲霉素对人胃黏膜细胞体外毒性机理研究
2020-06-15徐慧贾丽娜苏婧一徐俐俐左树娜张伟杨倩
徐慧,贾丽娜,苏婧一,徐俐俐,左树娜,张伟,,杨倩*
1(河北农业大学 理工系,河北 沧州,061100) 2(河北农业大学 食品科技学院,河北 保定,071000)
近年来,食品安全问题越来越受人们重视,食品中真菌毒素污染问题备受关注[1]。棒曲霉素(patulin,PAT)是一种主要由曲霉属和青霉属霉菌等真菌产生的有毒代谢产物,在水果及其制品、谷物及其制品、奶酪等均被检测到[2-4]。已有研究表明摄入PAT会诱发机体氧化应激反应、刺激肠胃引发紊乱肿胀、导致肝肾病变等中毒症状[5],严重危害人体健康。PAT被国际癌症研究机构归为第3类可疑致癌物质[6]。虽然美国食品药品监督管理局、世界卫生组织、欧盟、日本等已经制定PAT限量的相关标准[7],但PAT含量超标对于食品安全和人类健康仍然有一定危险。
目前针对食品中PAT的检测技术及吸附解毒研究较多[7-8],且应用相对成熟,但对于PAT的毒理研究不足。国内外诸多研究学者利用动物或细胞模型从生殖毒性[9]、肝毒性[10]、肾毒性[11]以及肠毒性[12]等多个角度进行了PAT毒性的研究。但关于PAT对人胃细胞体外毒性的研究未见报道。本文拟以人胃黏膜细胞(gastric epithelial cells,GES-1)为研究对象,探究PAT对其体外毒性作用机理,对于完善PAT的毒性机制具有重要的科学意义。
1 材料与方法
1.1 材料与仪器
人胃黏膜细胞(GES-1),上海酶研生物科技有限公司;棒曲霉素标准品(纯度≥99%),Sigma公司;DMEM培养基,Gibco公司;胰蛋白酶,Solarbio公司;4%多聚甲醛固定液、4′, 6-二脒基-2-苯基吲哚(4′, 6-Diamidino-2-phenylindole dihydrochloride,DAPI)染色液、四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT)细胞增殖及细胞毒性检测试剂盒、总SOD活性检测试剂盒、过氧化氢酶检测试剂盒、GSH和GSSG检测试剂盒、脂质氧化(MDA)检测试剂盒,上海碧云天生物技术有限公司;RNAprep pure培养细胞/细菌总RNA提取试剂盒,北京天根生化科技有限公司。
CP-50A型CO2培养箱,湖南湘仪科学仪器设备有限公司;680型酶标仪,美国BIO-RAD公司;OPTIMAL-100XP型超速离心机,美国Beckman公司;MRX-152型冷冻高速离心机,日本TOMY公司;EVOS F1型倒置荧光显微镜,美国LIFE公司;ABI PRISM 7500型实时定量PCR仪,美国Applied Biosystems公司。
1.2 试验方法
1.2.1 细胞培养
将GES-1细胞接种于含有DMEM培养基(含体积分数为10%的胎牛血清)的培养瓶中,在体积分数5% CO2、37 ℃、95%饱和大气湿度条件下进行培养,用2.5 g/L胰蛋白酶进行消化传代,每隔3 d传代1次,待细胞生长至对数生长期进行后续试验。
1.2.2 PAT对GES-1细胞存活率的影响
取1.2.1中生长良好的GES-1细胞,用2.5 g/L胰蛋白酶消化处理,收集细胞,调整细胞浓度至105个/mL,接种于96孔培养板,每孔100 μL,培养至融合状态。依次设置对照组(不含PAT),1.0、2.5、5.0、7.5、10.0 μmol/L PAT组(实验组)和空白组,37 ℃培养24 h。然后按照MTT细胞增殖及细胞毒性检测试剂盒说明书进行操作,在570 nm处测定各个反应孔的吸光值,参照公式(1)计算细胞存活率。
实验过程中,每组设置5个重复孔。实验重复3次进行。

(1)
式中:A实验组,PAT处理组测得的吸光度;A对照组,不加PAT所测得的吸光度;A空白组,不加细胞只含DMEM培养基的吸光度。
1.2.3 细胞凋亡形态观察
取1.2.1中生长良好的GES-1细胞,用2.5 g/L胰蛋白酶消化处理,用DMEM培养基重悬细胞,置入已处理好的玻片,以104个/mL接种于细胞培养板中培养至融合状态,弃去培养基。分别加入终浓度为0、1.0、2.5、5.0、7.5、10.0 μmol/L的PAT,24 h后取出细胞爬片,在室温下用4%多聚甲醛固定液处理15 min。干燥后与10 μL DAPI(1.0 mg/L)染色液混合,室温下染色3 min,弃DAPI染色液,然后用PBS洗涤5 min后,重复洗涤1次,在荧光显微镜下进行观察。
1.2.4 反转录-聚合酶链式扩增反应(reverse transcription polymerase chain reaction,RT-PCR)检测Bax和Bcl-2 mRNA的相对表达量
用终浓度0、1.0、2.5、5.0、7.5、10.0 μmol/L的PAT作用于生长良好的GES-1细胞,24 h后收集细胞,并用RNAprep pure培养细胞/细菌总RNA提取试剂盒提取总RNA(详细操作见试剂盒说明书),反转录成cDNA作为后续实验模板。进行荧光定量PCR反应,内参为β-actin。每组实验重复3遍。用2-ΔΔCt计算所得数据,得到Bax、Bcl-2 mRNA的相对表达量。
1.2.5 细胞样品准备
取1.2.1中生长良好的GES-1细胞,用2.5 g/L胰蛋白酶消化处理,收集细胞,调整细胞浓度至105个/mL,接种于96孔培养板,每孔100 μL。培养24 h,将培养液更换为分别含有0、1.0、2.5、5.0、7.5、10.0 μmol/L PAT的培养液,放入体积分数5% CO2培养箱中,37 ℃培养24 h,备用。
1.2.6 PAT对GES-1细胞超氧化物歧化酶(superoxide dismutase, SOD)活性的影响
取1.2.5中细胞样品,按照总SOD检测试剂盒说明书进行操作,用酶标仪测定各个反应孔在560 nm处吸光值。
1.2.7 PAT对GES-1细胞过氧化氢酶(catalase, CAT)活力的影响
取1.2.5中细胞样品,按照CAT检测试剂盒说明书进行操作,用酶标仪测定各个反应孔在520 nm处吸光值。
取1.2.5中细胞样品,按照GSH和GSSG检测试剂盒说明书进行操作,用酶标仪测定各个反应孔在412 nm处吸光值。
1.2.9 PAT对GES-1细胞丙二醛(malonaldehyde,MDA)含量的影响
取1.2.5中细胞样品,按照MDA检测试剂盒说明书进行操作,用酶标仪测定各个反应孔在553 nm处吸光值。
1.2.10 PAT对GES-1细胞γ-H2AX表达量的影响
参照SINGH等[13]的检测方法进行检测。
1.2.11 数据分析
记录1.2.6~1.2.9中检测值,并按照各说明书计算各检测指标含量。实验重复3次,各指标均为3组平行,结果以“平均值±标准差”来表示。采用SPSS 21.0对实验数据进行统计学分析,3组数据间采用“One-way ANOVA”的Duncan’s法进行比较分析,P<0.05为差异显著,标记为“*”。文中图均采用EXCEL软件处理。
2 结果与讨论
2.1 PAT对GES-1细胞存活率的影响
由图1可知,PAT对GES-1的生长具有一定抑制作用。1.0~10.0 μmol/L的PAT对GES-1细胞的存活率分别为92.93%、79.97%、70.54%、59.96%、19.12%,即当PAT浓度低于10.0 μmol/L时,随着PAT浓度的增加,GES-1细胞存活率逐步降低。
尽管,中国古代社会管理与“以人为本”的现代社会管理不可相提并论,但在中国历史上至少相当长的一段时期内不失为一种有效的社会管理模式。至今,对于现代人在创新社会管理体制,探寻新的社会管理模式上仍然具有一定的历史启迪意义。
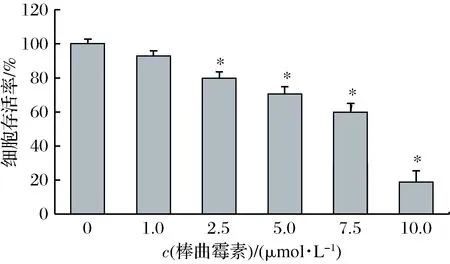
图1 PAT对GES-1细胞存活率的影响Fig.1 The effect of PAT on cell viability of GES-1
2.2 PAT对GES-1细胞凋亡的影响
由图2可知,未经PAT处理的细胞形态完整,核染色区成椭圆形态,且细胞边缘清晰。当PAT浓度为1.0 μmol/L时,细胞未见明显核浓缩现象,染色未见明显加深。当PAT浓度增为2.5 μmol/L时,部分细胞可见体积增大或外形皱缩,且视野内显见染色加深现象,部分细胞核染色质成新月形聚集于核膜一侧。当PAT浓度为5.0和7.5 μmol/L时,视野内可见圆形核染色区,细胞膜界限模糊不可分辨。当PAT浓度为10.0 μmol/L时,可见被细胞膜包绕的圆形小体。检测结果表明当PAT浓度为2.5 μmol/L时,细胞处于凋亡早期,当c(PAT)≥7.5 μmol/L后,细胞处于凋亡晚期。

A-0;B-1.0;C-2.5;D-5.0; E-7.5;F-10.0 μmol/L图2 PAT对GES-1细胞形态的影响Fig.2 Effect of PAT on the morphology of GES-1 cells
2.3 PAT对Bax和Bcl-2 mRNA相对表达量的影响
EDLICH[14]研究发现,Bcl-2家族的表达和调控在细胞凋亡中起关键作用。Bcl-2家族中Bax和Bcl-2是一对功能基因,前者是典型的促凋亡基因,而后者为抗凋亡基因。与对照组相比,PAT处理后Bax mRNA转录水平表达量上调(图3),其中1.0 μmol/L组增幅不显著,2.5~10.0 μmol/L均显著增高(P<0.05);而Bcl-2 mRNA转录水平表达量在2.5~10.0 μmol/L均显著下调(P<0.05)。结合图1和图2结果可以看出,PAT处理浓度≥2.5 μmol/L时能够引发GES-1细胞凋亡现象发生。

图3 PAT对GES-1细胞Bax和Bcl-2 mRNA相对表达量的影响Fig.3 Effect of PAT on the relative expression levels ofBax and Bcl-2 mRNA in GES-1 cells
2.4 PAT对GES-1细胞SOD活性的影响


图4 PAT对GES-1细胞T-SOD活性的影响Fig.4 Effect of PAT on the activity of T-SOD inGES-1 cells
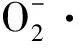
2.5 PAT对GES-1细胞CAT活力的影响
CAT可促使H2O2分解为分子氧和水,从而使细胞免遭H2O2的毒害,是生物防御体系的关键酶之一[17]。LI等[18]研究发现,彭泽鲫鱼受镉刺激后体内有活性氧产生且CAT酶含量和活性增加,由此验证了CAT在抗氧化防御系统中的重要作用。AROCKIARAJ等[19]在罗氏沼虾中也有类似发现。
由图5可知,与对照组相比,处理组中1.0、5.0、7.5、10.0 μmol/L组差异显著(P<0.05)。经过1.0 μmol/L PAT处理后,CAT检测值有明显增长,这可能是由于此时PAT的处理浓度激发了细胞的CAT防御系统,引起CAT酶合成量增加,从而使得CAT检测值比对照组高且差异显著(P<0.05)。而当PAT处理浓度≥2.5 μmol/L时,CAT检测值下降,可能是由于PAT处理后,引发细胞氧化损伤,引起CAT大量消耗;另外,PAT处理后引起细胞膜结构损伤,CAT随内容物一起泄露至外环境中。

图5 PAT对GES-1细胞CAT活力的影响Fig.5 Effect of PAT on the activity of CAT in GES-1 cells
2.6 PAT对GES-1细胞GSH含量的影响
GSH在细胞内主要以还原性谷胱甘肽存在,GSH结构中半胱氨酸侧链基团上连有一个活泼巯基[20],可与过氧化物和自由基结合,保护细胞膜结构,使组织免受自由基损害[21]。
由图6结果可知,经PAT处理后GES-1细胞GSH值逐步降低,且2.5~10.0 μmol/L处理组与对照组相比差异显著(P<0.05)。当c(PAT)≥5.0 μmol/L时,GSH检测值下降幅度超过42.71%,当浓度增大至10.0 μmol/L,GSH值降幅达到56.54%。结果表明,PAT引起了GES-1内氧化还原水平的改变,致使GSH含量大量下降,且随着PAT浓度增加,细胞内的氧化损伤程度加剧。

图6 PAT对GES-1细胞GSH含量的影响Fig.6 Effect of PAT on the content of GSH inGES-1 cells
2.7 PAT对GES-1细胞MDA含量的影响
细胞内MDA含量能够反映胞内脂质过氧化的程度,间接的反映出细胞损伤的程度[22]。由图7可知,随着PAT处理浓度的增加,MDA含量急速升高。与对照组相比,2.5~10.0 μmol/L处理组差异显著(P<0.05),且当c(PAT)≥5.0 μmol/L时,MDA含量增幅超过2倍。结果表明,PAT会引发GES-1细胞发生脂质氧化反应,导致MDA积累,引发GES-1细胞的氧化损伤,在一定程度上促进了GES-1细胞的变形、畸形和碎裂。
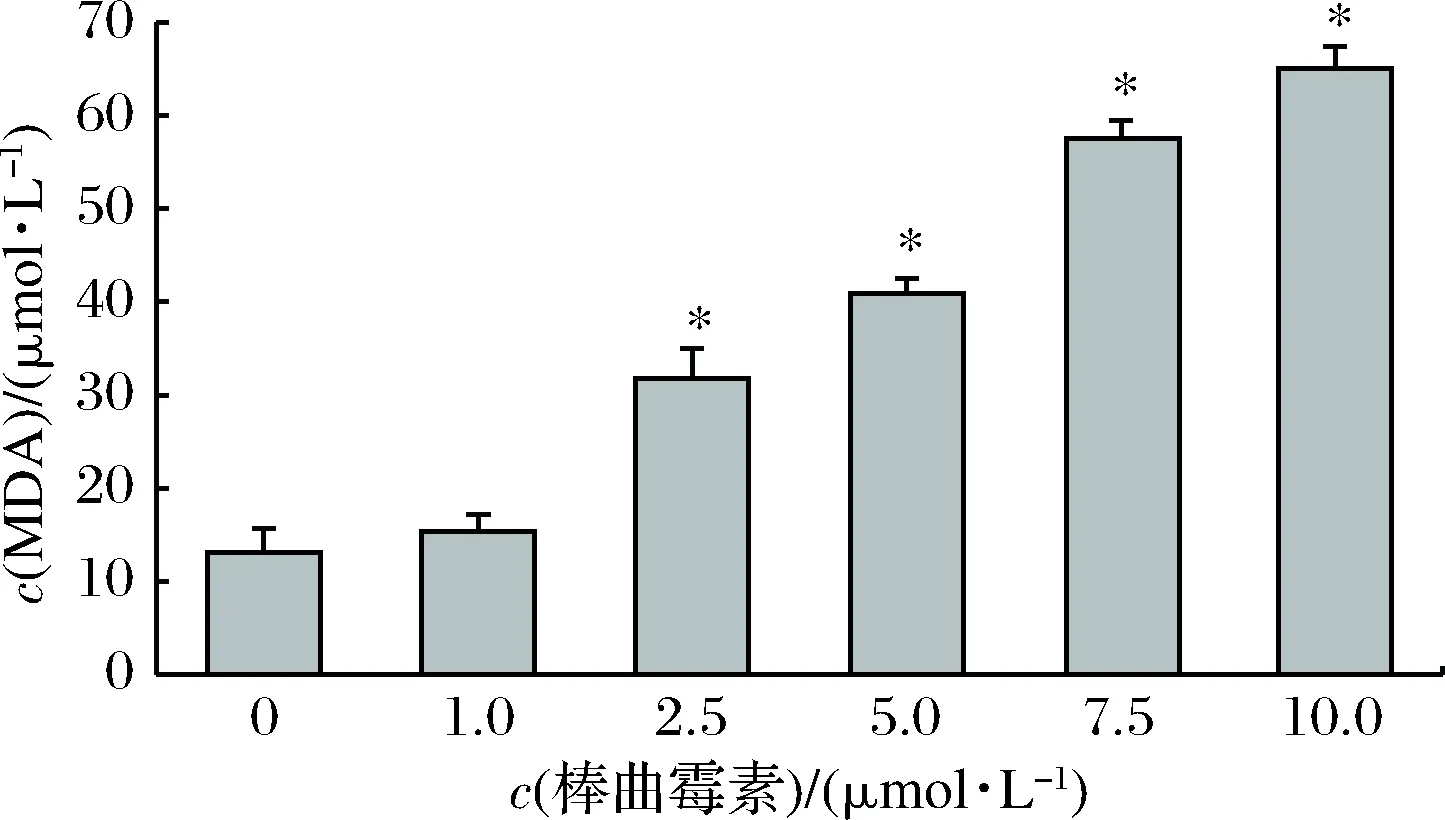
图7 PAT对GES-1细胞MDA含量的影响Fig.7 The effect of PAT on the content of MDA inGES-1 cells
2.8 PAT对GES-1细胞γ-H2AX表达量的影响
研究表明,组蛋白H2AX在DNA损伤修复和基因组稳定性的维持中起重要的作用,γ-H2AX的形成是DNA双链断裂的一个标志,伴随DNA双链断裂的发生而出现[23]。由图8可以看出,γ-H2AX随着PAT浓度的增加表达量明显上调,由此表明细胞内DNA发生了损伤,并且随着PAT浓度的增加DNA损伤程度增大。
3 结论

a、b、c、d-PAT处理量依次为0、2.5、5.0、7.5 μmol/L图8 PAT对GES-1细胞γ-H2AX表达量的影响Fig.8 Protein expression of γ-H2AX varied in responseto PAT in GES-1 cells
经不同浓度PAT体外处理后,GES-1细胞核、细胞形态及细胞内部氧化还原系统发生了不同程度的改变。当c(PAT)≥2.5 μmol/L时,对GES-1细胞抑制率大于20%,荧光染色镜检发现明显的凋亡特征;同条件下,Bax mRNA转录水平表达量上调,而Bcl-2 mRNA转录水平表达量显著下调(P<0.05),表明GES-1细胞进入了凋亡阶段。同时,和对照组相比,与氧化还原系统相关的SOD、CAT检测值降幅最高可达53.76%,GSH检测值降幅最高可达56.55%,而MDA最低增幅为139.59%,指标变化趋势与细胞凋亡发展趋势一致。依据本文研究结果得出PAT体外处理对GES-1细胞损伤机制可能是:初期激发GES-1细胞抗氧化损伤机制,引起DNA损伤、MDA等有害物质累积,破坏细胞结构完整性,引发了细胞凋亡机制,最终导致细胞裂解、凋亡。
