燕麦β-葡聚糖及其寡糖对肠道菌群结构和代谢的影响
2020-06-15王如月余讯徐静静朱莉詹晓北张洪涛
王如月,余讯,徐静静,朱莉,詹晓北*,张洪涛
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 2(南京医科大学附属无锡第二医院,江苏 无锡,214002) 3(无锡格莱克斯生物科技有限公司,江苏 无锡,214125)
人类肠道中有数万亿个微生物,已发现有超过1 500个不同的种类[1],这些肠道微生物群构成了一个复杂的群体,它们对于宿主的免疫和代谢至关重要,与人类的健康和疾病息息相关[2-3]。膳食是影响人体肠道菌群微生态最重要的因素之一,肠道微生物本身及其代谢产物不仅能够调节人体代谢,更能在膳食和宿主之间起到重要的桥梁作用[4-5]。ZHAO等[6]发现,膳食纤维可以选择性地促进肠道中产短链脂肪酸(short chain fatty acids, SCFAs)菌的生长,从而增加短链脂肪酸产量,进而减轻2型糖尿病的症状。MIYAMOTO等[7]通过将无菌小鼠与普通小鼠进行对比实验,发现大麦β -葡聚糖的有益代谢作用,是通过肠道微生物群产生的SCFAs促进肠激素分泌诱导而起作用的。
燕麦是一种全价营养谷物,近年来,随着人们对健康的关注,燕麦因其高膳食纤维含量成为研究热点。β -葡聚糖天然存在于燕麦的细胞壁中,被认为是具有潜在益生元特性的功能物质[8]。燕麦β -葡聚糖作为常见的膳食纤维具有降低胆固醇和餐后血糖反应等功效,这在针对动物[9]以及人类[10]的许多研究中都得到了证实。β-葡聚糖的水解产物β-葡寡糖,作为一种不可消化的低聚糖,也被证实具有促进乳酸菌生长[11]和免疫调节[12]等的作用。
燕麦β-葡聚糖(oat β-glucans, OGs)及其寡糖(oat β-glucans oligosaccharides, OGOs)不可以被人体自身消化吸收,但可以进入结肠被肠道菌群利用,能够作为益生元影响肠道微生物的组成以及其代谢产物的变化。近年来,国内外对β-葡聚糖益生功能的研究日趋增多,SHEN等[13]报道了燕麦β-葡聚糖可以促进小鼠肠道菌群双歧杆菌和乳酸菌生长,并减少大肠杆菌数量。LAM等[8]对不同分子质量的β-葡聚糖进行了益生元效果评价,发现分子质量为28 000 Da的β-葡聚糖的益生元效果最佳。但是目前国内外对低聚糖类益生元的研究主要集中在低聚果糖、低聚半乳糖等,关于植物来源的β-葡寡糖对肠道菌群改善作用的研究较少,有关肠道菌群对β-葡聚糖和其水解产物β-葡寡糖的发酵特性差异的研究更是鲜有报道。
本研究通过以OGs及其水解产物OGOs为碳源,对健康人和2型糖尿病人来源的粪便菌群进行体外厌氧发酵,研究OGs和OGOs对不同来源肠道菌群结构和代谢物的影响,初步探索肠道菌群对OGs及其水解产物OGOs的发酵特性差异。
1 材料与方法
1.1 实验材料
1.1.1 主要实验材料
燕麦(AvenasativaL.)麸皮,河北省张家口市万全县;菊粉,比利时cosucra公司;耐高温α-淀粉酶、木瓜蛋白酶、刃天青,麦克林生化科技有限公司;维生素K1、L-半胱氨酸盐酸盐、胆汁盐,Sigma-Aldrich公司;TIANamp粪便基因组DNA提取试剂盒,天根生化科技有限公司;荧光定量试剂Fast SYBR Green Master Mix,美国应用生物系统公司;其他试剂,国药集团化学试剂有限公司。
1.1.2 主要仪器与设备
多角度激光光散射凝胶色谱系统(DAWN HELEOS Ⅱ),美国怀雅特技术公司;MALDI-TOF/TOF基质辅助激光解析电离串联飞行时间质谱仪,美国布鲁克·道尔顿公司;厌氧培养箱(HYQX-Ⅱ),上海跃进医疗器械有限公司;气相色谱仪(7890A),安捷伦科技有限公司;StepOnePlus实时荧光定量PCR仪,美国应用生物系统公司。
1.2 OGs和OGOs的制备
1.2.1 OGs的提取纯化方法
β-葡聚糖提取采用热水浸提法,参考PAPAGEORGIOU等[14]的方法,略有改动。提取流程见图1。利用MCCLEAR等[15]的方法测定β-葡聚糖的纯度,不同批次制得的OGs纯度范围在85.7%~93%。
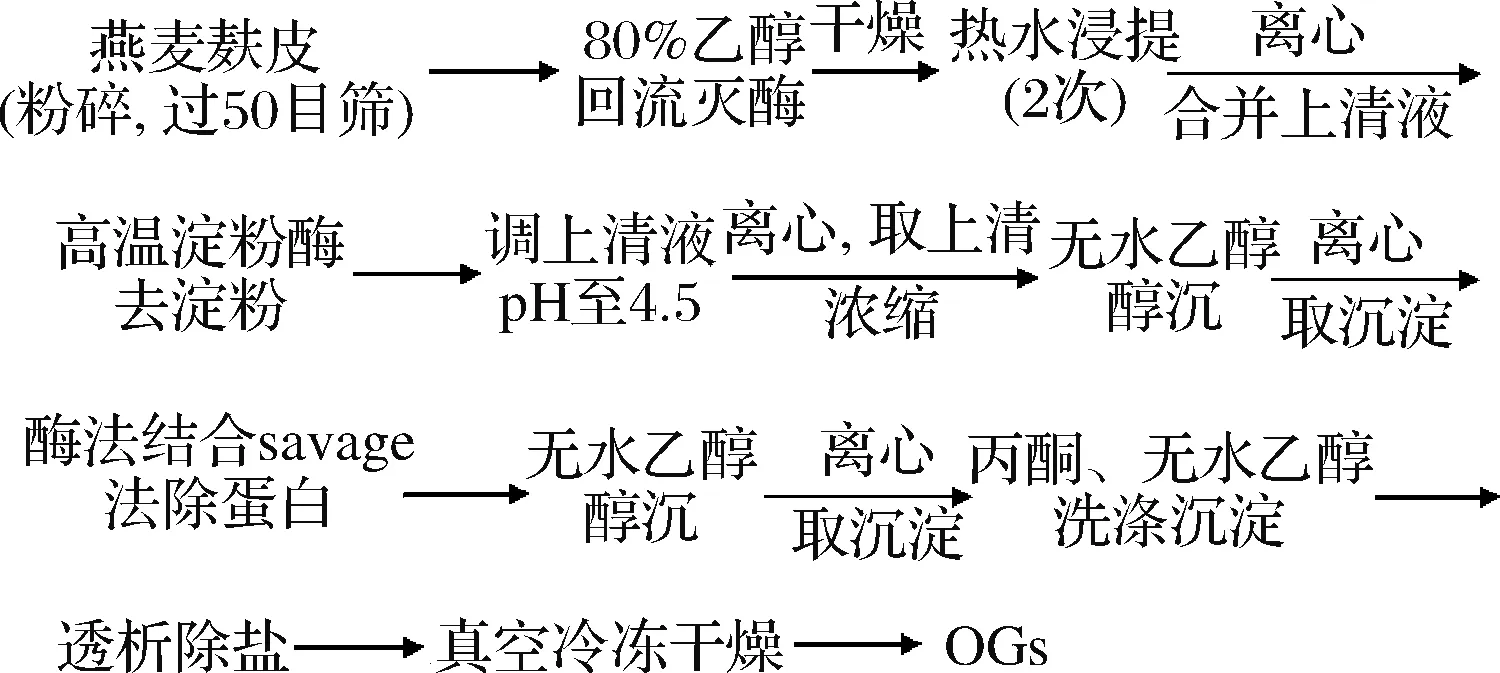
图1 OGs的提取流程图Fig.1 The extraction flow chart of OGs
1.2.2 OGOs的制备方法
OGOs由OGs酸解制得,准备10 g/L的OGs溶液,80 ℃水浴预热,加入等体积的H2SO4溶液(2 mol/L)。在80 ℃水浴振荡下酸解3.5 h,使用Ba(OH)2中和样品,过滤除去BaSO4沉淀,并用去离子水洗涤沉淀。将水解液体积浓缩至1/5,用3倍体积乙醇醇沉除去大分子多糖,10倍体积乙醇醇沉,将寡糖醇沉下来,取沉淀,复溶于水,透析48 h除盐(透析袋截留分子质量为100~500 Da),冷冻干燥得OGOs。
1.2.3 OGs和OGOs的分子质量测定
OGs的分子质量测定采用凝胶渗透色谱和十八角度激光散射联用技术测定,采用分子筛柱SHODEX SB-804-HQ,柱温30 ℃,流动相100 mmol/L NaNO3,流速0.5 mL/min。利用基质辅助激光电离飞行时间质谱分析OGOs的聚合度分布,质谱扫描范围(m/z)100~3 000。
1.3 体外发酵方法
1.3.1 粪便样品的收集
新鲜的粪便样品取自无锡市当地医院和大学,共5位2型糖尿病患者和5位健康志愿者,其中5位健康志愿者,3男2女,年龄47~63岁,身体质量指数(body mass index, BMI)为(26.60±1.64) kg/m2,空腹血糖为(4.92±1.02) mmol/L。5位2型糖尿病患者,4男1女,年龄45~64岁,BMI为(24.82±1.87) kg/m2,空腹血糖为(8.97±2.15) mmol/L。所有的志愿者均遵循正常中国饮食,没有消化系统疾病,且至少3个月没有服用抗生素。粪便样品用专用的粪便收集盒收集后,低温保存运输。将收集到的新鲜粪便样品,分为健康组和2型糖尿病组,每组粪便样品等质量混合后,用无菌PBS缓冲液(0.1 mol/L,pH 7.0)按照100 g/L稀释样品,涡旋均质,用无菌纱布(4层)过滤掉杂质,得到的粪便匀浆用于接种。此研究方案已由无锡市第二人民医院伦理委员会审批通过,并且从每位参与研究的志愿者处获得了书面知情同意书。
1.3.2 OGs和OGOs的体外发酵
体外发酵粪便微生物的方法参考YANG等[16]的方法,略有修改。以添加OGs/OGOs为碳源的培养基,体外发酵健康人和2型糖尿病人粪便微生物。以菊粉为阳性对照组、无碳源为空白对照组。体外发酵是在厌氧管中进行的,工作体积为5.5 mL。碳源的添加量为5.0 g/L,基础培养基(1 L)包括:2 g胰蛋白胨,2 g酵母提取物,0.1 g NaCl,0.04 g K2HPO4,0.04 g KH2PO4,0.01 g MgSO4·7H2O,0.01 g CaCl2·6H2O,2 g NaHCO3、2 mL吐温80、0.025 g氯化血红素,0.002 g维生素K1、0.5 gL-半胱氨酸盐酸盐,0.5 g胆汁盐和4 mL刃天青溶液(0.25 g/L),pH 6.8~7.0。每个厌氧管中注入添加相应碳源后的基础培养基5 mL,灭菌。将准备好的粪浆接种液按10%的接种量分别接入到培养基中,在37 ℃厌氧环境下培养。在发酵0和48 h,取出样品测定pH、总糖含量、产气量、SCFA含量等。其中pH用pH计直接测定,总糖含量采用苯酚硫酸法[17]测定。以上所有实验,均1式3份进行。
1.4 产气量的测定
参考RYCROFT等[18]的方法。将装有无菌针的活塞注射器插入到每个培养瓶的橡胶塞中,在发酵过程中,伴随着产气体积的增加,培养瓶的顶部压力增加,推动注射器活塞上移,进而达到测产气量的目的。
1.5 SCFAs含量的测定
将每个待测样品的发酵液取出1 mL,以13 000 r/min离心3 min,并将上清液贮存在-20 ℃,备用。将上清液(1 mL)中加入10 μL内标(100 mmol/L 2-乙基丁酸)和250 μL HCl溶液,用1 mL无水乙醚萃取目标产物,分离出有机相,加入无水Na2SO4除水,过0.22 μm有机系滤膜。使用配备有氢火焰检测器(flame ionization detector,FID)的气相色谱仪定量测量样品,载气为N2,分流比20∶1,流速为1.5 mL/min,采用熔融石英毛细管色谱柱(Agilent,HP-INNOWAX,30 m×0.25 mm×0.25 μm)。温度程序如下:以20 ℃/min从60 ℃升温到190 ℃,维持4 min。检测器温度250 ℃,进样口温度220 ℃,进样量为5 μL。使用集成的安捷伦数据库记录和处理数据。乙酸、丙酸和丁酸浓度根据相同条件下测定的标准曲线确定。
1.6 实时荧光定量PCR方法
1.6.1 DNA的提取
分别提取健康组和糖尿病组接种液的基因组DNA,以及每份发酵样品发酵48 h后的基因组DNA。采用TIANamp粪便基因组DNA提取试剂盒,根据生产商的操作步骤提取DNA,将提取的基因组DNA贮存在-20 ℃,备用。
1.6.2 实时荧光定量PCR条件
每份发酵样品的每个扩增反应均1式3份进行。反应体系10 μL:Fast SYBR Green Master Mix 5 μL,20 μmol/L上下游引物各0.2 μL,DNA模板0.5 μL,ddH2O 4.1 μL。反应条件:先在95 ℃下进行120 s的预变性,然后95 ℃进行3 s、60 ℃退火延伸30 s,共40个循环。最后进行溶解曲线分析,判断扩增子特异性。在95 ℃下进行15 s,60 ℃下保持1 min后以0.3 ℃逐渐加热,直到95 ℃,在此温度下保持15 s。由系统软件StepOne Software v2.3自动分析CT值。表1列出了使用的16S rRNA靶向引物。

表1 本实验使用的16S rRNA靶向引物Table 1 16S rRNA gene primers used in this study
1.6.3 实时荧光定量PCR数据处理
参考VIGSNAES等[19]的相对定量方法。靶向引物编码的16S rRNA序列对应的目标菌的相对含量,由E-ΔCT计算得到。其中ΔCT是相应细菌的CT值减去总细菌的CT值;E是引物效率,E=10-1/s,s是该引物对应标准曲线的斜率。标准曲线测定方法:将其中1个发酵样品的基因组DNA稀释10n倍,用同样方法进行实时荧光定量PCR,以CT-lg(1/10n)作图。
1.7 数据处理
以上所述实验均独立重复3次,采用SPSS 22软件的单因素方差分析(one-way ANOVA)分析方差,采用Tukey HSD法进行多重比较,P<0.05为差异显著。
2 结果与分析
2.1 OGs和OGOs的分子质量
OGs和OGOs分别通过热水浸提法和OGs酸解制得。图2为OGs的多角度激光散射凝胶色谱谱图,采用系统软件ASTRA 5.3.4分析,表明OGs的分子质量为1.34×105Da。OGOs的MALDI-TOF质谱谱图如图3所示,分析可知OGOs是由聚合度为3~11的β-葡寡糖组成。

图2 OGs多角度激光散射凝胶色谱谱图Fig.2 Multi-angle laser scattering gel chromatogram of OGs

图3 OGOs的MALDI-TOF质谱谱图Fig.3 MALDI-TOF mass spectrum of OGOs
2.2 总糖含量变化
分别以OGs、OGOs和菊粉为培养基碳源,对健康人和2型糖尿病人来源的粪便菌群进行体外厌氧发酵。通过测定0和48 h各组发酵液中的总糖含量(表2),计算出健康人和2型糖尿病人粪便菌群发酵48 h后对不同碳源的利用情况。发酵48 h后,OGs的利用率在健康组和糖尿病组分别为96.29%和95.07%,OGOs的利用率在健康组和糖尿病组分别为93.92%和94.66%,菊粉在2组的利用率分别为92.89%和93.05%。可以看出,健康组和2型糖尿病组的肠道菌群都可以较好地利用OGs、OGOs和菊粉。

表2 健康人和2型糖尿病人粪便菌群以不同碳源发酵0和48 h后发酵液的总糖含量Table 2 Total carbohydrate content in fermented brothof healthy and type 2 diabetics after fecal flora fermentationwith different carbon sources for 0 and 48 h
2.3 pH和产气量
通过测定0和48 h各组发酵液的pH(表3),可以发现,在无碳源添加(空白)的情况下,各组发酵液的pH略微下降;以OGs、OGOs和菊粉为碳源进行粪菌发酵,各组发酵液的pH均明显降低,其中健康组以OGs和菊粉为碳源的发酵液pH明显低于OGOs组;2型糖尿病组以OGs为碳源的发酵液pH明显低于OGOs组和菊粉组。以上结果说明,OGs和OGOs可能对结肠环境pH的降低有作用,结肠pH降低可以抑制病原菌,改善结肠环境[22]。

表3 健康人和糖尿病人粪便菌群以不同碳源发酵0和48 h后发酵液的pHTable 3 pH value of fermented broth of healthyand type 2 diabetics after fecal flora fermentation withdifferent carbon sources for 0 and 48 h
健康人和2型糖尿病人粪便菌群以不同碳源发酵48 h后,对各发酵体系的产气量进行测定,结果如图4所示,健康人的粪便菌群在分别利用3种不同碳源后,在产气量上没有显著差异。但是2型糖尿病人的粪便菌群在分别利用3种不同碳源发酵后,在产气量方面有较大差异:OGs组发酵体系的产气量显著低于菊粉组(P<0.05);另外,OGOs组的产气量也明显低于菊粉组(P=0.087);而OGs组与OGOs组的产气量则无明显差异。说明相比于菊粉,2型糖尿病人粪便菌群以OGs和OGOs为碳源发酵会产生较少气体,这与文献[23]报道的以葡聚糖或葡寡糖为碳源发酵粪菌比菊粉产气量少的研究结果相一致。

图4 健康人和2型糖尿病人粪便菌群以不同碳源发酵48 h后的产气量Fig.4 Gas production of healthy and type 2 diabeticsafter fecal flora fermentation with different carbon sourcesfor 48 h注:同一组中标注的不同字母表示显著差异(P<0.05)(下同)
2.4 SCFAs含量变化
肠道微生物发酵碳水化合物的主要代谢产物是SCFAs,主要包括乙酸、丙酸和丁酸。SCFAs在调节宿主代谢、降低结肠pH、免疫系统调节和细胞增殖方面具有关键作用[24]。采用气相色谱法定量测定了健康人和2型糖尿病人粪便菌群以不同碳源发酵48 h后的发酵液中乙酸、丙酸以及丁酸的浓度,结果如图5所示。从图5-a和图5-b可以看出,相比于空白组,以OGs、OGOs和菊粉为碳源发酵粪菌,健康人和2型糖尿病人粪便菌群发酵液中乙酸和丙酸浓度均显著增加。由图5-a不难看出,以OGs和OGOs为碳源发酵48 h后,健康人粪菌发酵液中OGs组和OGOs组乙酸浓度无显著差异,而2型糖尿病人粪菌发酵液中,OGOs组乙酸浓度显著高于OGs组。同样,由图5-b可以发现,经过48 h发酵后,2型糖尿病人粪菌发酵液中,OGOs组丙酸浓度显著高于OGs组。图5-c表明,与OGOs和菊粉相比,以OGs为碳源时,健康组和2型糖尿病组粪便菌群发酵48 h后发酵液中丁酸浓度均显著增加。综合以上结果,OGs和OGOs对肠道菌群代谢产SCFAs均有显著的促进作用,其中,以OGs为碳源,可以显著促进健康人和2型糖尿病人肠道菌群产丁酸;与OGs相比,以OGOs为碳源则可以显著促进2型糖尿病人肠道菌群产乙酸和丙酸。
2.5 菌群组成变化
采用实时荧光定量PCR方法,测定了健康人和2型糖尿病人初始粪便菌群(0 h)和以不同碳源发酵粪菌48 h后发酵液中Firmicutes phylum、Bacteroidetes phylum、Lactobacillusspp.、Bifidobacteriumspp.以及主要产丁酸菌属Clostridiumleptumsubgroup(C.leptumsubgroup)相对于总细菌的含量,结果如图6和图7所示。

图5 健康人和2型糖尿病人粪便菌群利用不同碳源发酵48 h后发酵液中SCFAs含量Fig.5 SCFAs content in fermented broth of healthy and type 2 diabetics after fecal flora fermentationwith different carbon sources for 48 h
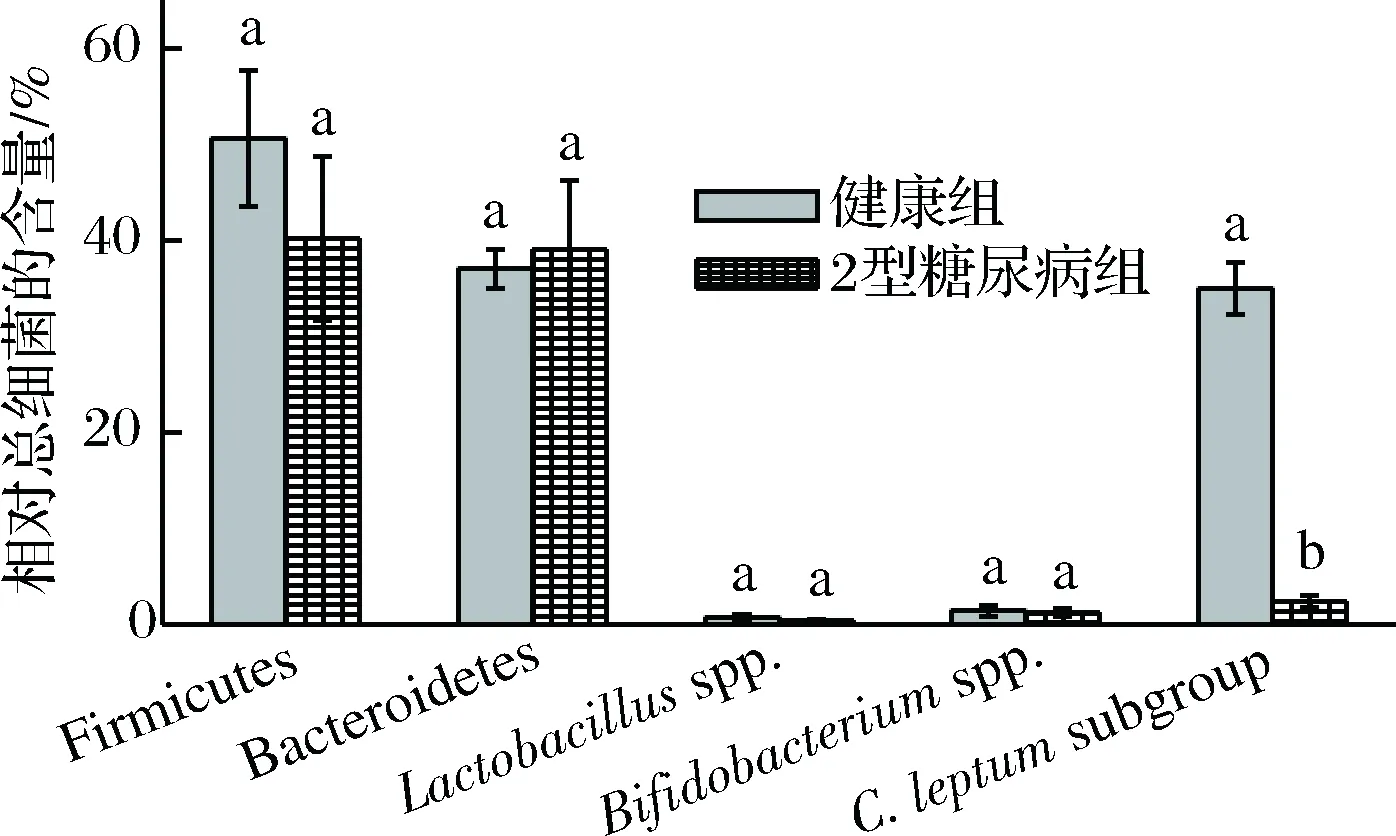
图6 健康人和2型糖尿病人粪便菌群中各细菌相对总细菌的含量Fig.6 Relative quantities of target bacteria to totalbacteria in feces of healthy and type 2 diabetics注:各细菌相对总细菌的含量,由E-ΔCT计算得到。其中ΔCT是相应细菌的CT值减去总细菌的CT值;E是引物效率,E=10-1/s, s是该引物对应标准曲线的斜率。总细菌的相对含量为100%
从图6中可以看出,与健康人相比,2型糖尿病人粪便菌群中厚壁菌门减少,拟杆菌门增多,乳酸杆菌和双歧杆菌减少,但是差异均不显著。但2型糖尿病人肠道菌群中产丁酸菌C.leptumsubgroup与健康人相比,相对含量显著降低,健康组为35.05%,2型糖尿病组仅为2.42%。由此结果得出,相比于健康人,2型糖尿病患者粪便菌群中厚壁菌门/拟杆菌门比值(F/B值)下降,乳酸杆菌、双岐杆菌含量减少,产丁酸菌含量显著降低。以上结果与QIN等[25]关于2型糖尿病人产丁酸菌含量显著下降的研究结果一致。FURET等[26]的研究结果也表明,2型糖尿病患者粪便菌群中F/B值下降,这是肠道菌群失调的重要标志之一[3]。以上结果表明,本研究中涉及到的2型糖尿病人的肠道菌群呈现中度失调。
从图7可以看出,经过48 h发酵后,健康组和2型糖尿病组的乳酸杆菌和双歧杆菌的相对含量均(比0 h时)显著提高,其中健康组以菊粉和OGOs为碳源效果最佳,2型糖尿病组以OGOs为碳源提高作用最为显著。以OGs和OGOs为碳源,健康人和2型糖尿病人粪便菌群中产丁酸菌C.leptumsubgroup相对总细菌的含量均显著提高,其中,OGs组对产丁酸菌相对含量的提高作用显著高于OGOs组。综合以上结果,OGs和OGOs对健康人和2型糖尿病人粪便菌群组成有不同的调控作用:OGs对粪便菌群产丁酸菌丰度提高作用显著,这一结果与OGs可以显著提高粪便菌群发酵液中丁酸含量相对应;OGOs对粪便菌群中乳酸杆菌和双歧杆菌的促生长作用较好。
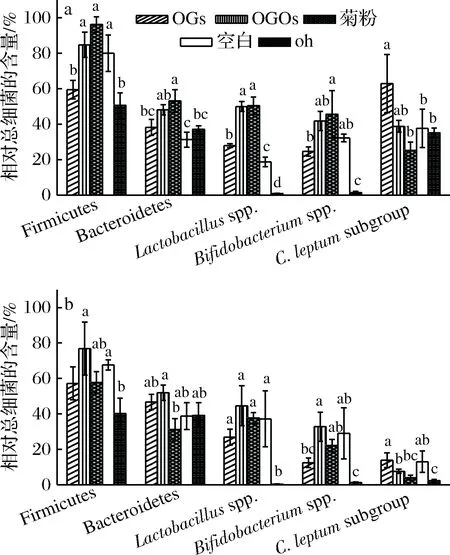
a-健康组;b-2型糖病组图7 健康人和2型糖尿病人粪便菌群利用不同碳源发酵0和48 h后各细菌相对总细菌的含量Fig.7 Relative quantities of target bacteria to totalbacteria in feces of healthy and type 2 diabetics fermentedwith different carbon sources for 0 and 48 h注:“OGs”、“OGOs”、“菊粉”、“空白”为以对应的碳源发酵48 h后各细菌相对总细菌的含量;“0 h”为粪便菌群发酵0 h,即健康人和2型糖尿病人原始肠道菌群中各细菌相对总细菌的含量
3 结论
本研究通过以OGs及其水解产物OGOs为碳源,对菌群结构相对平衡的健康人粪便菌群和菌群中度失调的2型糖尿病人粪便菌群进行体外发酵,探究了OGs及OGOs对健康人和2型糖尿病人肠道菌群结构及其代谢产物的影响。通过检测体外发酵48 h后的发酵液pH、发酵体系产气量、SCFAs含量和菌群组成变化,发现OGs和OGOs均可以明显改善健康人和2型糖尿病人的肠道菌群结构,并对肠道菌群代谢产物SCFAs的产生有明显的促进作用。由于OGs和OGOs在结构上存在聚合度和分支率的差异,它们在肠道菌群中可能有不同的酵解途径,进而对肠道菌群的结构和代谢产物产生不同的影响:与OGOs相比,OGs可以显著提高肠道菌群中产丁酸菌C.leptumsubgroup相对总细菌的含量,进而提高发酵液中丁酸的浓度;OGOs则较好地增加了肠道菌群中乳酸杆菌和双歧杆菌相对含量,并提高了发酵液中乙酸和丙酸的浓度。研究还发现,OGs和OGOs对肠道菌群的改善效果随菌群来源不同而有所差别:OGs对产丁酸菌丰度的提高作用在健康人肠道菌群中较为显著;OGOs对乳酸杆菌和双歧杆菌的促生长作用以及对肠道菌群产乙酸和丙酸的促进作用,在2型糖尿病人肠道菌群中较显著。综合以上结论,OGs和OGOs对肠道菌群的组成和代谢有不同的改善作用,这种改善作用随肠道菌群来源不同而有所差别,OGs和OGOs可能可以有针对性地改善2型糖尿病人肠道菌群的结构和相关代谢。
