基于代谢工程构建产β-胡萝卜素重组毕赤酵母
2020-06-15刘洁王宏涛钱和徐建中张伟国
刘洁,王宏涛,钱和,徐建中*,张伟国*
1(江南大学 生物工程学院,江苏 无锡,214122) 2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 3(江南大学 食品学院,江苏 无锡,214122)
β-胡萝卜素(β-carotene)具有多种关键的生物学功能[1],被广泛应用于食品添加剂、保健品和饲料添加剂[2]。近年来,有研究报道β-胡萝卜素具有预防癌症、心血管疾病和抗衰老的功效[3],因此其市场需求急剧增加。然而,提取法和化学合成法生产β-胡萝卜素存在产量低及食品安全等问题[4-5]。近年来,随着代谢工程的快速发展和人们对异源表达系统的深入研究,构建工程菌株异源合成β-胡萝卜素成为热点[6-7]。目前,用于异源生产β-胡萝卜素的模式菌株主要是大肠杆菌和酿酒酵母,但由于存在缺少蛋白修饰、培养条件较复杂及发酵规模不易扩大等问题而不易实现工业化[8-9]。毕赤酵母表达系统成本低、周期短、表达量高且可高密度培养,为大规模生产β-胡萝卜素带来了希望[10-12]。ARAYA-GARAY等[12]首次构建了异源表达欧文氏菌类胡萝卜素相关基因的巴斯德毕赤酵母突变菌株,所得菌株的β-胡萝卜素产量仅为339 μg/g(DCW)。我们预测,引入锁掷酵母类胡萝卜素途径可以获得更高β-胡萝卜素产量的重组巴斯德毕赤酵母。
本研究首次克隆来自锁掷酵母的类胡萝卜素基因并在巴斯德毕赤酵母中异源表达以产生β-胡萝卜素,并探索单个或多个类胡萝卜素基因对β-胡萝卜素生产的影响。这项研究为基于代谢工程异源合成β-胡萝卜素提供了新的案例并有望推进β-胡萝卜素工业化生产的进程。
1 材料与方法
1.1 菌株和质粒
锁掷酵母(Sporidioboluspararoseus) JD2保藏于中国典型培养物保藏中心(China Center for Type Culture Collection, CCTCC),记录号为CCTCC M2010326;大肠杆菌DH5α、野生型巴斯德毕赤酵母X-33和大肠杆菌-酵母穿梭质粒pGAPZA、pPIC9k购自Invitrogen。
1.2 试剂与仪器
限制性内切酶,Thermo Scientific;TaqDNA聚合酶、DNA Mark、MutExpress®快速诱变试剂盒、DNA切胶回收试剂盒、cDNA合成试剂盒,Vazyme;T4DNA连接酶、酵母RNA提取试剂盒,TaKaRa;PCR引物、质粒快速提取试剂盒,上海生工;酵母基因组提取试剂盒,康为世纪;qPCR染料试剂盒,BBI;博来霉素、卡那霉素,Invitrogen;标准品β-胡萝卜素、玻璃珠,Sigma;色谱纯二氯甲烷、乙腈,国药沃凯;其他试剂均为国药分析纯。
台式高速冷冻离心机,德国Sigma公司;真空冷冻干燥机,日本Toshiba公司;高效液相色谱仪,德国Agilent公司;电脉冲基因转移仪,美国BIO-RAD公司;StepOne Plus荧光定量PCR仪,美国ABI公司。
1.3 培养基
LLB培养基(g/L):蛋白胨10,酵母膏5.0,NaCl 5.0;YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母膏10;BMGY培养基(g/L):蛋白胨20,酵母膏10,甘油10,YNB 13.4,生物素0.5,100 mmol/L 磷酸钾缓冲液 (pH 6.0)。
1.4 β-胡萝卜素表达载体的构建
提取锁掷酵母总RNA并进行琼脂糖凝胶电泳验证其完整性。合成第1条链cDNA,设计寡核苷酸引物(表1)。通过PCR获得含有相应限制位点的crtE、crtYB和crtI基因片段,并通过测序验证。

表1 本实验用于PCR的引物Table 1 Primers used in this experiment for PCR
质粒pGAPZA的定点诱变按照制造商的说明进行,以产生不含有AvrⅡ位点的载体pGAPZA*并通过DNA测序验证。将基因片段与载体连接以分别产生质粒pGAPZA-E,pGAPZA*-I和pGAPZA*-YB,将来自pGAPZA*-I和pGAPZA*-YB的表达盒无缝克隆到pGAPZA-E的BamHⅠ位点以产生质粒pGAPZA-EYBI(图1)。

图1 质粒pGAPZA-EYBI构建过程Fig.1 Construction of plasmid pGAPZA-EYBI
1.5 巴斯德毕赤酵母的转化和筛选
用AvrⅡ将pGAPZA-EYBI线性化,按照ARAYA-GARAY等[12]的方法进行巴斯德毕赤酵母感受态细胞的制备和电穿孔。电击后,立即加入1 mL预冷的无菌山梨糖醇,混合物30 ℃静置1 h,涂布在含有100 μg/mL博来霉素的YPD板上。将平板置于30 ℃培养箱中2~4 d以筛选重组菌落。使用快速酵母基因组DNA分离试剂盒提取巴斯德毕赤酵母基因组DNA,并通过PCR验证基因整合到基因组中。
1.6 细胞质量浓度测定
发酵液经过适当的稀释后,以清水作为对照,测定OD600值。取1 mL发酵液于10 000 r/min下离心,弃上清液,用清水洗涤2次后于烘箱中90 ℃烘干至恒重,得到菌体干重。
1.7 β-胡萝卜素含量的测定
在参考文献[13]的基础上稍作改动,进行β-胡萝卜素提取。培养72 h后,离心菌体用双蒸水洗涤2次,收集细胞进行冷冻干燥。将细胞干粉溶于1 mL二甲基亚砜(dimethyl sulfoxide,DMSO)并加入玻璃珠涡旋1 min,55 ℃提取30 min,重复提取直至细胞无色。萃取液在氮气流下干燥,然后溶解在丙酮中进行HPLC分析。在配备有ZORBAX SB-C18(5 μm, 4.6 mm×250 mm) 的Agilent Technologies 1 260 Infinity HPLC系统上于30 ℃进行β-胡萝卜素分离和定量。流动相由溶剂A(乙腈) 和溶剂B(二氯甲烷)组成[14],梯度程序如下:A在10 min内从100%到50%线性梯度洗脱5 min;然后回到100%。流速为1 mL/min,检测波长为450 nm,通过比较样品和β-胡萝卜素标准品的峰面积进行定量分析。
1.8 β-胡萝卜素合成途径中crt基因的qPCR分析
菌株在YPD培养基中摇瓶培养至对数生长期,使用酵母RNA提取试剂盒提取重组毕赤酵母总RNA并合成cDNA第1条链。将引物(表2)和荧光染料添加到cDNA中进行qPCR。

表2 本实验用于qPCR的引物Table 2 Primers used in this experiment for qPCR
为了校正起始量的差异,将核糖体18S RNA作为管家基因。通过溶解曲线确认PCR产物的特异性,并且通过2-ΔΔCt方法进行相对基因表达分析[15]。
1.9 重组毕赤酵母摇瓶发酵条件优化
为了进一步提高重组毕赤酵母中β-胡萝卜素的产量,对影响酵母生长和表达的重要因素进行优化。将重组菌接种于10 mL YPD培养基中,于30 ℃、200 r/min下过夜培养作为种子液。以5%的接种量接种于含有50 mL BMGY培养基的500 mL摇瓶中进行发酵培养。选取合适的梯度范围进行单因素优化[16-19],每组试验设置3个平行,分别测定β-胡萝卜素产量。
2 结果与分析
2.1 锁掷酵母类胡萝卜素基因的克隆与序列分析
常用于异源合成β-胡萝卜素的类胡萝卜素基因主要来自欧文氏菌(Erwiniauredovora)和红发夫酵母(Xanthophyllomycesdendrorhous)[12]。据报道,锁掷酵母合成类胡萝卜素的能力更强,这表明其类胡萝卜素基因可能更适合于β-胡萝卜素的合成[20]。通过逆转录从锁掷酵母中获得crtE(KY652916.1)、crtYB(KR108013.1)和crtI(KR108014.1)(图2)。为了了解锁掷酵母类胡萝卜素基因,进行氨基酸多序列比对,如图3所示。
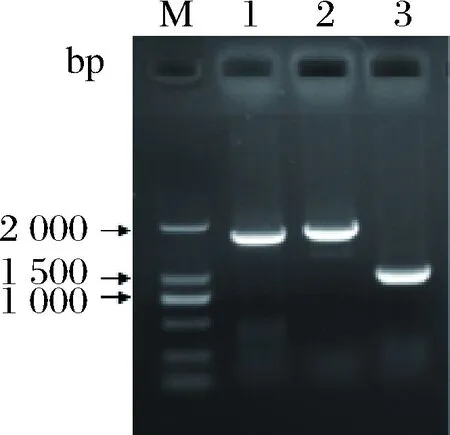
1-crtI;2-crtYB;3-crtE图2 锁掷酵母类胡萝卜素基因扩增电泳图Fig.2 Electrophoresis of target gene amplification andrecombinant plasmid verification
来自锁掷酵母的类胡萝卜素基因与来自X.dendrorhous和E.uredovora的类胡萝卜素基因具有较高的同源性,推测其活性位点一致。另外,锁掷酵母高效的类胡萝卜素合成途径显示出其编码酶基因可能具有更高的催化活性。
2.2 巴斯德毕赤酵母中β-胡萝卜素生物合成途径的构建
巴斯德毕赤酵母中不存在天然质粒,外源基因需要整合在基因组中进行表达[12]。因此,本研究构建了稳定表达质粒pGAPZA-EYBI,将其整合到巴斯德毕赤酵母基因组中以获得重组菌株Pp-EYBI。Pp-EYBI在BMGY培养基摇瓶培养72 h,用于色素提取。

a- crtE氨基酸序列比对;b- crtYB氨基酸序列比对;c- crtI氨基酸序列比对图3 不同来源的类胡萝卜素基因氨基酸多序列比对Fig.3 Amino acid multiple sequence alignment of carotenoid genes from different sources
如图4所示,HPLC分析表明,重组毕赤酵母Pp-EYBI中β-胡萝卜素的产量为818 μg/gDCW,是ARAYA-GARAY等[12]先前报道的2.4倍。这些结果证实,由于宿主偏好和相关酶的催化活性,来自锁掷酵母的类胡萝卜素基因在巴斯德毕赤酵母中表现更好。
2.3 重组毕赤酵母β-胡萝卜素合成限速酶基因的确定
编码限速酶基因的过表达是代谢工程提高产量的重要策略之一[21]。为确定重组巴斯德毕赤酵母中β-胡萝卜素合成的限速步骤,构建了重组菌株Pp-EYBI+I和Pp-EYBI+YB。摇瓶培养72 h后,HPLC结果显示,菌株Pp-EYBI+YB中β-胡萝卜素产量增至1 576 μg/gDCW,而Pp-EYBI+I菌株中β-胡萝卜素积累量下降了16%。
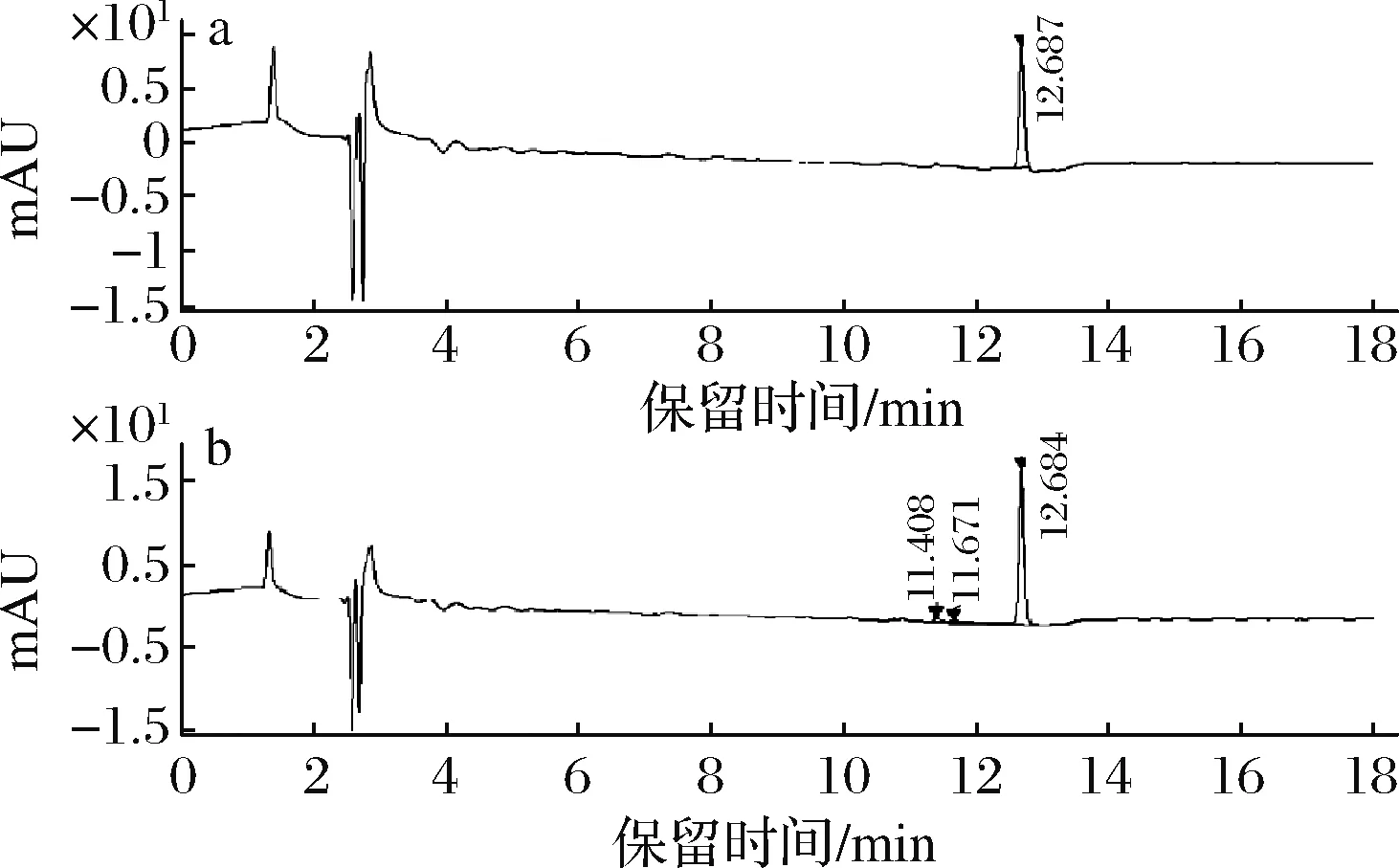
a- β-胡萝卜素标准品;b- 重组菌株Pp-EYBI中提取的色素图4 β-胡萝卜素HPLC色谱图Fig.4 β-carotene HPLC chromatogram
为了确定类胡萝卜素基因是否正确表达并进一步了解产生不同β-胡萝卜素的原因,分别在Pp-EYBI、Pp-EYBI+I和Pp-EYBI+YB菌株中研究了crt基因的转录水平(图5)。在野生型细胞中,无法检测到crtE、crtYB和crtI的表达(数据未显示)。与Pp-EYBI相比,Pp-EYBI+I菌株中crtE和crtI基因的转录水平显著增加,而crtYB基因几乎不变。相反,Pp-EYBI+YB菌株中crtYB基因的表达水平比Pp-EYBI细胞高2.44倍。这些结果表明,crtYB是菌株Pp-EYBI合成β-胡萝卜素的限速酶编码基因。

图5 不同重组菌株中β-胡萝卜素合成相关基因的转录水平Fig.5 Transcription levels of β-carotene synthesis-related genes in different recombinant strains
2.4 β-胡萝卜素合成限速酶基因拷贝数的优化
为进一步提高重组巴斯德毕赤酵母中β-胡萝卜素的产量,连续引入限速酶基因crtYB。SacⅠ/EcoR Ⅰ双酶切将AOX1启动子和α因子替换为GAP启动子,构建了基于pPIC9k携带crtYB的质粒pPIC9k-YB并电转到Pp-EYBI+YB的感受态细胞中,因其所带抗性为卡那霉素而不是博来霉素,从而保证筛选顺利进行。随后的研究表明,菌株Pp-EYBI+(YB)2中crtYB表达水平是Pp-EYBI的3.32倍,β-胡萝卜素的产量达到2.5 mg/gDCW,比Pp-EYBI菌株的产量高310%。结果表明,Pp-EYBI+YB菌株中crtYB拷贝数的增加提高了其表达量表达,从而提高了流向β-胡萝卜素的通量。为了研究crtYB是否仍然是Pp-EYBI+(YB)2中的限速步骤,构建菌株Pp-EYBI+(YB)3。尽管crtYB的表达水平高达Pp-EYBI的4.53倍,Pp-EYBI+(YB)3中β-胡萝卜素的产量略有下降,但纯度较高(图6)。推测原因可能是合成β-胡萝卜素前体物质供应不足所致。
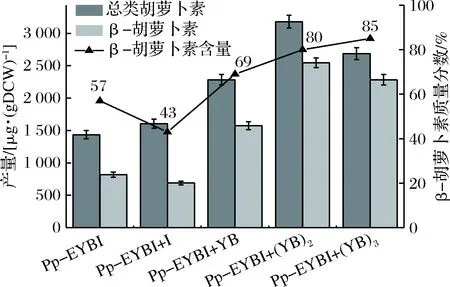
图6 不同重组菌株合成β-胡萝卜素的能力Fig.6 The ability of different recombinant strains tosynthesize β-carotene
2.5 β-胡萝卜素合成前体物质供应的增强
HMG1基因是MVA途径的限速酶基因,截短的HMG1(tHMG1)基因可以有效解除麦角固醇的反馈抑制提高MVA路径的通量[22]。为提高工程菌Pp-EYBI+(YB)3中β-胡萝卜素合成的前体物质供应,克隆来自酿酒酵母(Saccharomycescerevisiae)S288C的tHMG1基因(图7)。构建质粒pGAPZA-H电转到Pp-EYBI+(YB)3感受态细胞中,筛选获得重组菌株Pp-EYBI+(YB)3H。结果显示,Pp-EYBI+(YB)3H中β-胡萝卜素产量为3.7 mg/gDCW,是Pp-EYBI+(YB)2的1.48倍。

M-marker;1-tHMG1图7 目的基因tHMG1扩增电泳图Fig.7 Electrophoresis of target gene tHMG1 amplification
2.6 单因素试验结果
为进一步提高β-胡萝卜素产量,对重组菌株Pp-EYBI+(YB)3H摇瓶发酵条件进行单因素优化。优化条件为:甘油添加的体积分数为2%,最适pH 6.0;接种量10%,装液量50 mL;转速200 r/min;温度28 ℃。
3 结论
本研究将来自锁掷酵母的类胡萝卜素合成途径引入巴斯德毕赤酵母中以获得产β-胡萝卜素的重组菌株。这是首次报道克隆锁掷酵母来源的类胡萝卜素基因并用于异源生产β-胡萝卜素。本研究对β-胡萝卜素合成限速酶基因crtYB拷贝数进行优化并过表达MVA途径限速酶基因tHMG1以提高类胡萝卜素合成前体物质的供应,最终成功构建一株重组毕赤酵母Pp-EYBI+(YB)3H,其β-胡萝卜素产量达到3.7 mg/gDCW,是ARAYA-GARAY等[12]报道的10.9倍。本研究构建的巴斯德毕赤酵母工程菌培养基组分成本低廉,成分简单,方便后期分离纯化,为大规模发酵生产β-胡萝卜素提供了新的策略。
