光激化学发光分析法定性检测血清CMV-IgM 抗体
2020-06-15刘浩李军普崔亚琼于洋张月香李会强
刘浩,李军普,崔亚琼,于洋,张月香,李会强
(1.天津医科大学医学检验学院,天津300203;2.天津市中心妇产科医院检验科,天津300100)
巨细胞病毒(cytomegalovirus, CMV)是孕前或孕早期TORCH 检测重要指标之一[1]。CMV 是引起全世界先天性和围产期感染的重要病原体。CMV 感染通常是无症状的,但在免疫功能不全的患者以及通过胎盘传染的胎儿,它的发病率和死亡率会显著提高。孕妇在怀孕初期前3 个月内首次感染CMV可能导致胎儿流产、死胎、畸形[2];新生儿先天性CMV 感染可能导致新生儿黄疸、肝脾肿大、皮肤瘀点、感音神经性听力损失、宫内发育迟缓,甚至死亡[3]。因此,产前筛查CMV 感染有助于优生优育、发病风险评估以及后期抗病毒治疗。目前国内TORCH 的实验室检测方法主要为血清学检测和病毒核酸检测,其中血清学检测IgM 抗体已作为初步诊断早期感染的重要依据和流行病学的筛查,广泛应用于临床[4]。
迄今为止,国内外已开展多种检测CMV-IgM抗体的实验室方法,包括胶体金免疫层析法、荧光免疫分析法、酶联免疫检测法、化学发光免疫分析法等。其中胶体金免疫层析法操作简单、快速,但灵敏度较低;荧光免疫分析法特异性较高,但试剂所需费用昂贵,不适合大规模筛查;酶联免疫检测法是临床最常见的一种方法,灵敏度较高,但操作步骤繁琐、耗时较长;化学发光免疫分析法发展至今已逐渐替代其他方法,成为实验室检测CMV-IgM抗体的主要方法,具有快速、灵敏度高,易于自动化等特点,虽日渐成熟,但操作仍繁琐,需多次分离和洗涤过程,提高了结果出错的概率。光激化学发光分析法(light initiated chemiluminescent assay, LiCA)是一种新型均相检测技术[5],此方法无分离和洗涤过程,目前尚无LiCA 检测IgM 抗体的相关报道。本研究旨在探索一种新的基于LiCA 技术的CMVIgM 抗体检测方法,建立一套完善的检测体系,并进行方法学评价和临床结果比对。
1 材料与方法
1.1 临床标本 实验所用临床标本均取自天津市中心妇产科医院产前筛查妇女和孕早期妇女。共210 例血清样本,其中40 例阳性和70 例阴性血清样本由雅培ARCHITECT 化学发光免疫分析仪两次检测确定,100 例血清来自随机产前筛查妇女。所有血清样本分装并保存于-80℃。
1.2 主要试剂 CMV(pp150, pp65, pp52)重组抗原购自厦门万泰沧海生物公司;鼠抗人IgM 抗体购自英国ABcam 公司;长臂活化生物素(Sulfo-NHSLC-Biotin) 购自美国 Pierce 公司;发光微球(chemibead, CB)与链霉亲和素(streptavidin, SA)包被的感光微球(sensibead, SB)由北京科美生物公司提供。
1.3 仪器 LiCA 分析仪器购自上海博阳生物公司。
1.4 发光微球的包被 分别用抗人IgM 抗体和CMV 抗原包被发光微球。参考使用说明书,取2 mg发光微球于0.1 mol/L pH 6.0 的2-吗啉乙磺酸(MES)缓冲液中离心洗涤,将抗体/抗原与处理过的发光微球以质量比20:1 混合于0.1 mol/L pH 6.0 的MES 缓冲液中,所得混合溶液再与25 mg/mL 氰基硼氢化钠(NaBH3CN)以体积比25:1 于37℃避光48 h,之后用0.1 mol/L pH 6.0 的MES 缓冲液反复离心洗涤3 次,使抗体/抗原包被于发光微球,并调节其浓度为10 mg/mL。
1.5 生物素的标记 分别用生物素标记抗人IgM抗体和CMV 抗原。根据参考文献[6-7],取生物素于二甲基甲酰胺溶液中进行溶解,将抗体/抗原于0.1 mol/L pH 8.0 的 Na2CO3/NaHCO3缓冲液中充分透析,然后取处理过的生物素和抗体/抗原以摩尔比20:1 混合于37℃搅拌1 h,最后于4℃条件下在0.1 mol/L pH 7.4 的PBS 缓冲液中透析24 h,去除游离生物素,获得生物素化(biotinylation,Bio)抗体/抗原。
1.6 检测模式 对CMV-IgM 抗体而言,有两种分析模式可供选择[8-9],分别是捕获二抗模式和固相抗原模式,前者称为捕获法,后者称为间接法,检测原理见图1。具体检测步骤如下:捕获法中于微孔依次加入 15 μL 稀释血清,25 μL CB-抗人 IgM 抗体,25 μL Bio-CMV 抗原(图1A);间接法中依次将15 μL 稀释血清,25 μL CB-CMV 抗原,25 μL 的Bio-抗人IgM 抗体加入微孔(图1B);然后将微孔板37℃孵育17 min,避光条件下加入175 μL SB-SA,37℃孵育15 min,孵育完成后,用LiCA 分析仪器读取CB-SB 偶联后产生的光信号。
1.7 条件优化 对反应体系中的缓冲液、抗原浓度、抗体稀释比例和血清稀释比例进行优化。
1.8 临界指数 检测收集来的50 例阳性和60 例阴性血清样本,将检测结果进行ROC 曲线分析。曲线下面积(AUC)范围为 0.5~1.0,一般情况下 AUC>0.9时表示该方法具有较高的诊断性能[10]。间接法LiCA采用定性检测CMV-IgM 抗体,实验结果以样本信号值/临界信号值(S/Co)表示。
1.9 方法学评价
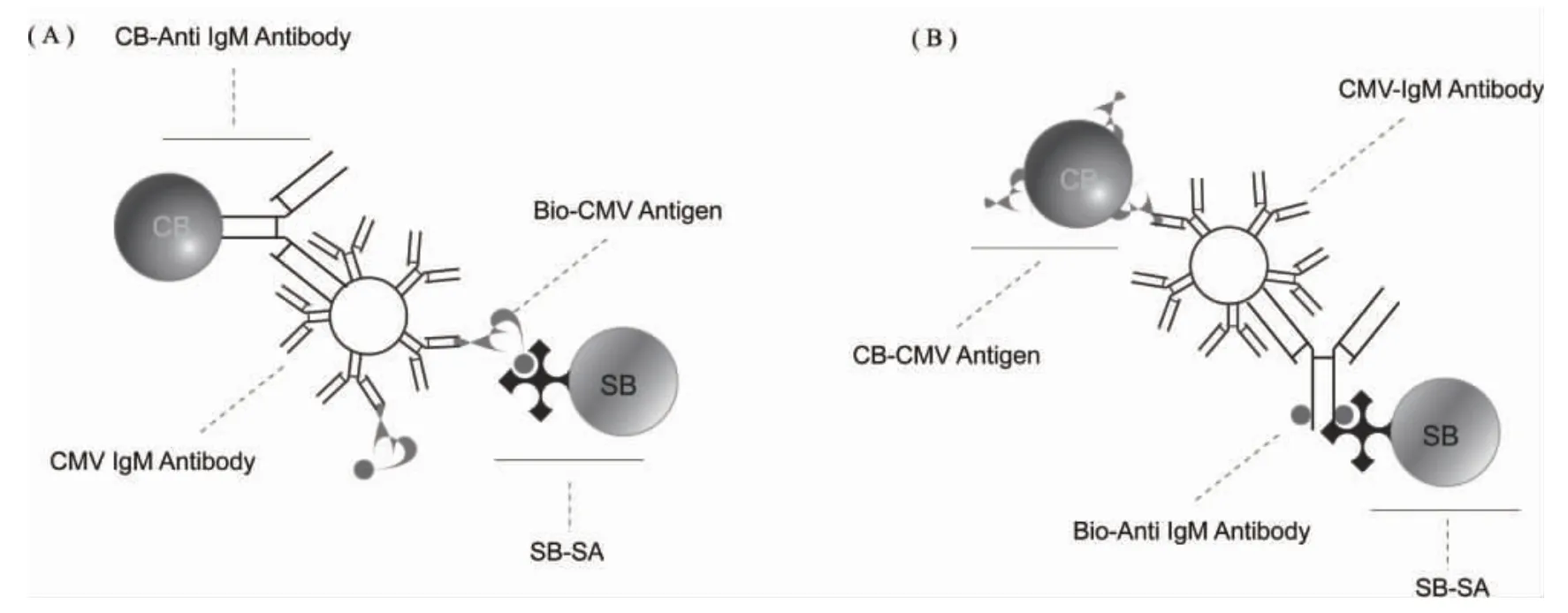
图1 捕获法(A)和间接法(B)CMV-IgM 抗体检测原理示意图Fig 1 Schematic diagram of the capture(A)and indirect(B)formats for detecting CMV-IgM antibody on LiCA
1.9.1 精密度 当批内变异系数(CV)<10%,批间CV<20%时,表明实验精密度为可接受。准备阴性、弱阳性、强阳性3 个水平的混合血清样本,每个血清在同一天相同条件下重复检测10 次,计算反应批内CV;每个血清做副孔在相同条件下连续检测10 d,计算反应批间CV。
1.9.2 特异性 为评价其他IgM 抗体对CMV-IgM抗体检测的影响,利用本实验建立的方法分别对5份弓形虫、5 份风疹病毒、5 份单纯疱疹病毒和5份类风湿因子IgM 抗体阳性的血清进行检测。
1.9.3 检测结果比对 分别用本实验建立的间接法LiCA 与意大利索灵公司LIAISON 化学发光免疫分析仪对100 例临床血清样本进行检测。
1.10 统计学分析 采用SPSS 22.0 软件进行统计学分析。对LiCA 与LIAISON 检测结果进行Kappa一致性检验,P<0.05 为差异有统计学意义。
2 结果
2.1 确定检测模式 从图2A 中能明显看出,捕获法中两组样本的光信号值没有显著差别,不能正确区分阳性样本和阴性样本;而如图2B 所示,在间接法中两组样本的光信号值相差较大,阳性样本和阴性样本区分明显;并且间接法的总CMV-IgM 抗体阳性信号值/阴性信号平均值(P/N)比值高于捕获法(图2C)。因此,本实验的最终检测模式为间接法。
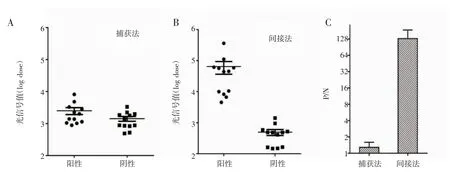
图2 捕获法和间接法比对结果Fig 2 Comparison of the results between capture and indirect formats
2.2 条件优化
2.2.1 缓冲液 准备4 种缓冲液,缓冲液A:0.1 mol/L pH 8.0 Tris-HCl 缓冲液、0.3 mol/L NaCl 溶液、10 mg/mL 牛血清白蛋白(BSA);缓冲液 B:10 mmol/L pH 7.4 磷酸盐缓冲液;缓冲液C:0.1 mol/L pH 6.0 MES 缓冲液、10 mg/mL BSA;缓冲液 D:0.02 mol/L pH 8.0 Hepes 缓冲 液 、0.15 mol/L NaCl 溶 液 、0.03 mg/mL BSA。利用4 种缓冲液分别检测4 个不同浓度的阳性混合血清和20 例阴性血清,通过对P/N 比值的比较选出反应最优缓冲液。如图3A 所示,在使用缓冲液A 时4 个阳性混合血清的P/N 比值均最高;进一步优化缓冲液A,向其中加入了一种表面活性剂-0.01% 吐温-20,结果显示添加了吐温后的总P/N 高于不添加的(图3B)。因此,实验最终缓冲液为0.1 mol/L pH 8.0 Tris-HCl 缓冲液、0.3 mol/L NaCl 溶液、0.01% 吐温-20 和 10 mg/mL BSA。
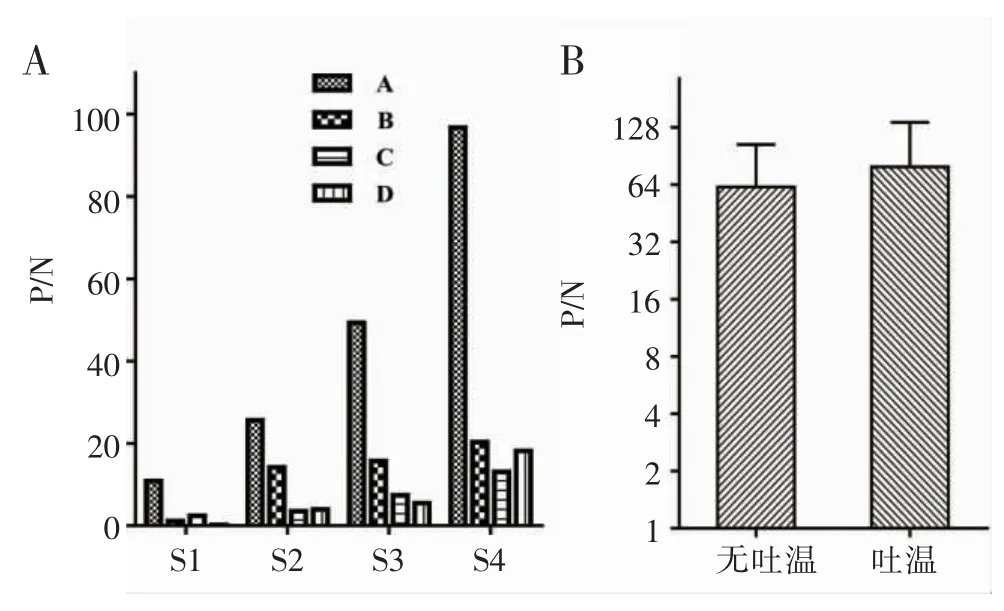
图3 缓冲液对检测结果的影响Fig 3 Effect of different buffers on the testing results
2.2.2 工作浓度 将CB-CMV 抗原稀释至1.25、2.50、3.75、5.00 μg/mL,如图4A 所示,保持其他条件不变,低、中、高3 个水平的阳性混合血清在CBCMV 抗原浓度为 2.50 μg/mL 时 P/N 达到了最大值,实验开始出现钩状效应。将Bio-抗人IgM 抗体倍比稀释至1:500,1:1 000 和1:1 500,保持其他条件不变,3 个水平的阳性血清在Bio-抗人IgM 抗体稀释比例为1:500 时P/N 最大(图4B)。因此,本实验最终 CB-CMV 抗原浓度为 2.50 μg/mL,Bio-抗人IgM 抗体稀释比例为1:500。
在 CB-CMV 抗原浓度为 2.50 μg/mL,Bio-抗人IgM 抗体稀释比例为1:500 的条件下,将待检血清样本倍比稀释至 1:100、1:200、1:400 和 1:800。结果(图4C)显示P/N 比值随着血清稀释比例的增加而增加,直至达到1:400 开始下降。因此,本实验选择1:400 作为待检血清稀释比例。

图4 各组分稀释比例对检测结果的影响Fig 4 Effect of different dilution ratio of each component on the testing results
2.3 最佳临界指数 如图5A 所示,AUC 为0.997(95% CI: 0.992~1.002),此时临界值为 5819 cps,灵敏度为97.1%(95%CI:0.901~0.997),特异度为100%(95% CI: 0.912~1.000)。当 IgM(S/Co)为 1.45 时,特异度达到了最大,为100%(95% CI: 0.961~1.000),此时的灵敏度较低,为92.5%(95%CI:0.796~0.981)。当IgM(S/Co)为1 时,灵敏度达到最大值,为100%(95% CI: 0.912~1.000),此时的特异度也较高,为98.9%(95%CI:0.941~0.999)。故当 IgM(S/Co)<1 时,样本可视为阴性,当IgM(S/Co)≥ 1 时,样本可视为阳性(图5B)。

图5 临界指数的选择Fig 5 Selection of cutoff value
2.4 方法学评价
2.4.1 精密度 如表1 所示,本实验的批内CV 分别为5.9%,6.1%,5.3%;批间 CV 略高,分别为9.8%,9.7%,6.9%。

表1 LiCA 检测CMV-IgM 抗体的精密度结果Tab 1 Precision for detecting CMV-IgM antibody on LiCA
2.4.2 特异性 检测结果均为阴性,结果表明弓形虫、风疹病毒和类风湿因子与本实验CMV-IgM 抗体的检测无交叉反应。
2.4.3 检测结果比对 如表2 所示,相对于LIAISON,间接法LiCA 的总体符合率为95%,阳性符合率为92.5%(37/40),阴性符合率为96.7%(58/60),灵敏度为94.9%(37/39),特异性为95.1%(58/61)。一致性检验,Kappa=0.895,P<0.01。

表2 两种方法检测结果比对Tab 2 Comparison of LiCA and LIAISON
3 讨论
CMV-IgM 抗体是产前筛查CMV 感染的常用血清学指标。本实验探索了一种基于LiCA 技术定性检测血清CMV-IgM 抗体的新方法。LiCA 是一种由光激发的均相免疫分析技术,最早起源于20世纪90 年代的鲁米诺氧通道免疫法[11]。具有免洗涤、免分离、高通量、灵敏度高、易使用、易于自动化、成本低等优势[12-14]。其核心在于发光微球和感光微球在距离200 nm 时的化学能量传递,感光微球在680 nm 激发光的作用下,将周围的氧气转化为单线态氧,单线态氧会将能量传递到相聚200 nm 范围内的发光微球上的化学发光物质,使其在520~612 nm处产生光信号;当两者相聚超过200 nm,单线态氧将衰变到基态氧并进入下一个能量循环[15-16]。
在本研究中,相较于捕获法分析模式,采用Li-CA 间接法分析模式,待检抗体优先与感光微球表面的抗原结合,游离于液相中的抗人IgM 抗体更能够抵抗待检血清标本中其他IgM 抗体的干扰。本方法的AUC 为0.997,表明该方法能较好的区分样本的阴性和阳性,具有较高的诊断性能。批内和批间CV 均<10%,表明该方法具有良好的重复性;与弓形虫、风疹病毒和类风湿因子均无交叉反应,证明该方法具有较高特异性;与LIAISON 相比,总体符合率为95.0%,阳性符合率为92.5%,阴性符合率为96.7%,灵敏度为94.9%,特异性为95.1%,经一致性检验,Kappa=0.895,P<0.01,说明该方法与 LIAISON之间具有较好的一致性,具有潜在的临床应用前景。此外,在 LiCA 技术中,1 μg 化学微球包含 2×108微球,在680 nm 激发光的作用下,每个感光微球每秒均可释放60 000 个单线态氧,如此强的信号放大使得LiCA 具有较高灵敏度[17]。本研究利用LiCA 高灵敏度的特点,将血清进行两次20 倍稀释,降低血清中总IgM 抗体浓度的同时有效削弱了非特异性IgM抗体对检测的干扰,而LiCA 的高灵敏度,使得LiCA体系仍具有检测低浓度CMV-IgM 抗体的能力。
以上实验结果表明本研究初步建立的LiCA 检测CMV-IgM 抗体的方法具有良好的分析性能。此外,该检测体系还具有很多其他优点,如无洗涤和分离步骤,减少了因分离洗涤过程带来的误差;全程共需32 min,整个过程操作简单,快速;实验仅需15 μL稀释血清,样本用量较少;试剂稳定性高,成本低,易配制;易实现商业化和自动化,适合大规模筛查等。
本研究成功建立了LiCA 间接法分析模式检测CMV-IgM 抗体,改善了传统方法干扰因素多,时间长,过程繁琐等缺点,实现了均相、免分离、免洗涤检测,为临床提供了一种新的微量、便捷、高效的CMV-IgM 抗体的检测方法。
