口服蛋氨酸饲料致大鼠心室重塑的研究
2020-06-15涂代苗阚晨星马向红
涂代苗,阚晨星,马向红
(天津医科大学第二医院心脏科,天津市心血管病离子与分子机能重点实验室,天津心脏病学研究所,天津300211)
心力衰竭是许多心血管疾病的终末阶段,严重影响患者的生存。人口老龄化和其他心血管疾病生存率的提高使心力衰竭的发病率增加[1]。目前认为,心室重构是心力衰竭发生、发展的重要机制[2]。心室重构是各种原因导致心脏结构和(或)功能的改变,其机制十分复杂,除了代偿机制外,心肌细胞的氧化应激损伤、免疫和炎症改变,能量利用障碍、神经体液调节失衡,细胞因子表达异常等因素的互相影响也参与其中。
同型半胱氨酸(HCY)是蛋氨酸代谢的中间产物,与冠心病、高血压等发病密切相关[3],也与心力衰竭的严重程度(NYHA 分级)相关[4]。HCY 既是心力衰竭的危险因素,也是判断心力衰竭患者预后的预测因子。笔者先前的研究表明HCY 致动脉粥样硬化机制主要与内皮细胞损伤、平滑肌细胞增生、氧化应激和炎症反应有关[5]。近年研究提出,同型半胱氨酸引起心力衰竭的机制除了与血管机制有关,还可以直接引起心肌损伤,导致心肌肥大、心肌细胞凋亡和间质纤维化,引起心肌重塑[6]。程序性细胞死亡蛋白 4(programmed cell death protein 4,PDCD4)是一种抑癌基因,有促进细胞凋亡的作用,研究发现PDCD4 在心肌纤维化中呈低表达。本研究通过口服蛋氨酸饲料构建高HCY 大鼠模型,探索HCY致大鼠心脏功能的变化,以及引起大鼠心室的病理改变及PDCD4 信号通路在其中发挥的作用。
1 材料与方法
1.1 实验动物 5 周龄健康雄性Wistar 大鼠30 只,体质量(200± 20)g,清洁级,购自北京华阜康公司,适应性喂养1 周后,随机分为对照组15 只,实验组15 只。对照组予普通饲料喂养,不做特殊处理;实验组予3%蛋氨酸饲料喂养。各组均不定量按需给食,250 mL 饮水瓶每日换水,每周记录体质量。
1.2 主要试剂及设备 HCY 酶联反应试剂盒购自上海抚生生物公司,大鼠PDCD4(ab51495)单克隆抗体购自abcam 公司,GAPDH 单克隆抗体购自天津百倍生物科技公司,Vevo2100 小动物超声仪,Biorad 电泳仪。
1.3 模型的制备及样本的留取 各组大鼠分别喂养12 周后检测心脏彩超,留取内眦静脉血,4℃,2 000 rpm×20 min 离心制备血浆,处死动物,切取心室,称体质量,用作组织学研究的心室用4%的中性甲醛固定,脱水,石蜡包埋,4℃保存、备用;其余-80℃保存后续用于分子研究。
1.4 血浆HCY 及NT-proBNP 测定 采用ELISA法测定已制备的血浆HCY 浓度,具体步骤为:(1)设计标准孔与样本孔,标准孔加不同浓度的标准液50 μL,样本每孔加样 50 μL。(2)加入酶标试剂100 μL。(3)37℃温育 60 min。(4)洗涤 5 次。(5)加入显色剂 37℃避光 15 min。(6)终止反应。(7)测定,以450 nm 波长依序测定各孔吸光度。
1.5 心脏超声的测量 3%蛋氨酸饲养12 周后,实验组与对照组大鼠均进行超声心动图检查。应用GE Vivid 7 型超声仪,使用7.5 MHz 探头对大鼠行心脏超声检查,应用Vevo 2100 小动物超声系统用来测量分析,配备M-型超声,B-型超声和组织多普勒。大鼠采用异氟醚麻醉,仰卧固定,胸前备皮,于左侧胸骨旁取左室长轴切面,连续记录至少3 个心动周期,保存二维图像,测定室间隔厚度(IVS)、左室收缩内径(LVES)、左室舒张末径(LVED)、左室后壁厚度(LVPW)、左室收缩期容量(LVSV),计算射血分数(EF%),缩短分数(FS%),所有测量数值取3次结果的平均值。
1.6 血流动力学指标的测定 取大鼠称体质量,记录,腹腔麻醉后仰卧固定,充分暴露手术区域。大鼠左侧上肢、左右下肢通过尖端连接针穿刺皮下,另一端连接于血流动力学换能机器上,连续记录肢体导联心电图。连接压力传感器管路系统,压力传感器系统血压调零,于大鼠颈部正中做一纵行切口,钝性逐层分离肌肉,暴露出一侧的颈总动脉,动脉夹夹闭动脉近心端,传入2 根001 号手术缝线,远心端结扎,近心端打单节,用动脉剪剪开动脉管径的1/3,将自制内径为1.5 mm 聚苯乙烯心导管(导管内充满含有肝素的氯化钠注射液)通过切口插入右颈总动脉内,导管的另一端通过三通、用压力换能器与BL-420S 生物机能试验系统相连,随后近心端缝线结扎固定动脉及导管,防止导管脱出,用镊子夹住导管固定,再松开动脉夹,并将导管缓慢插入动脉内,计算机通过生物机能实验系统,进入血流动力学模块。此时波形为动脉血压曲线,待血压稳定1 min。截取10 个心动周期的心电图及血压,分别测量各种心电数据,分析测定HR、血压测量主动脉收缩压(SBP)、舒张压(DBP)、左室收缩压(LVSP)、左室舒张压(LVDP)等。
1.7 HE 染色 每个标本选取3 张心肌石蜡切片进行HE 染色,用Olympus CX21FSI 光学显微镜留取心肌组织结构图片。石蜡切片5 μm 厚,经过脱蜡、染色、脱水、透明、封固后光镜观察。
1.8 Masson 染色 每个标本选取3 张心肌石蜡切片按Masson 三色染色试剂盒说明进行染色。用Olympus CX21FSI 光学显微镜观察心肌组织胶原纤维沉积的情况,每张切片在同一光照强度下,随机选取5 个视野并在相同条件下拍照,应用Image pro plus 7.0 图像分析软件对组织切片进行图像分析。
1.9 组织蛋白提取 剪取一小块心室肌组织(50 g),放入研钵内,冰上研磨,加入RIPA 裂解液(500 μL)裂解 20 min,收集裂解液,4℃,12 500 r/min,离心20 min,取上清液。-80℃保存备用。
1.10 Western blot 法检测PDCD4 的表达 配胶,每孔加样品5 μL,经电泳,转膜后,5%脱脂奶粉室温封闭2 h,PDCD4 (1:5 000)一抗4℃孵育过夜后,TBST 洗 3 次,二抗室温孵育 1 h,TBST 洗 3次,曝光。
2 结果
2.1 两组大鼠一般情况及体质量的测定 随机分组后,每周记录大鼠体质量,可见3%蛋氨酸饲料喂养组大鼠约1 个月后出现体质量增长缓慢。并且,实验组大鼠出现萎靡不振,毛发无光泽,进食减少表现,个别出现体质量不增长或负增长(图1)。
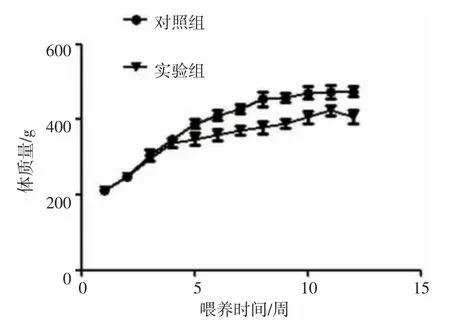
图1 时间-体质量增长曲线Fig 1 Time-weight growth curve
2.2 血浆HCY 与NT-proBNP 结果 3%蛋氨酸喂养组大鼠血浆HCY 浓度明显高于对照组大鼠[(5.62±0.44)μmol/L vs.(13.25±0.57)μmol/L],两组比较差异有统计学意义(P<0.05),图2 为标准曲线。
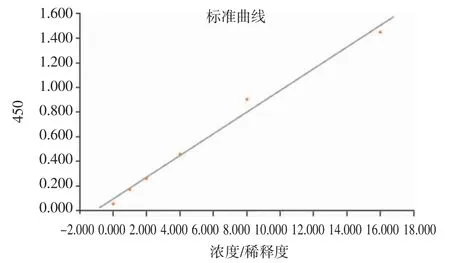
图2 HCY 测量标准曲线Fig 2 Standard curve of HCY
2.3 心脏超声 经过统计后发现实验组大鼠的射血分数,缩短分数,室间隔厚度减低,左室收缩末径及左室舒张末径增加。左室收缩期末内径[(3.86±0.64)vs.(4.88±0.41),P<0.05],舒张期末内径增高[(6.79±0.50)vs.(7.45±0.62),P <0.05],射血分数[(72.76±7.30)vs.(61.68±5.72),P <0.05],缩短分数[(43.40±6.60)vs.(34.45±4.32),P<0.05],室间隔厚度降低[(1.76±0.26)vs.(1.35±0.07),P<0.05],图3、4。
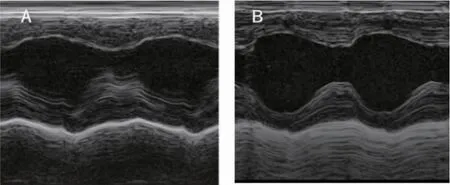
图3 M 型超声心动图Fig 3 Representative M-mode echocardiography image of the ventricle
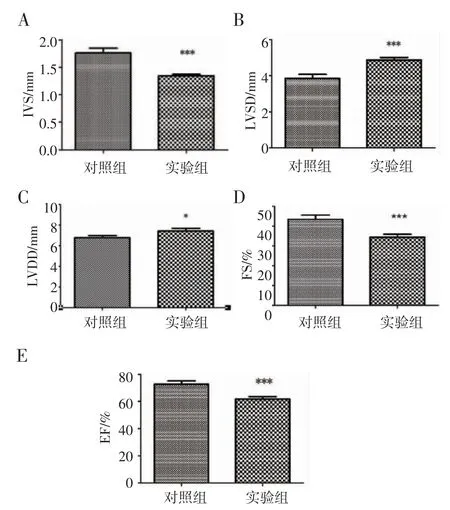
图4 心脏超声指标结果比较Fig 4 Comparison of echocardiographic index between two groups
2.4 血流动力学结果 血流动力学指标显示,3%蛋氨酸组大鼠SBP 和DBP 较对照组降低(P<0.05)LVSPLVDP、HR 等在两组中无差异,见表 1。
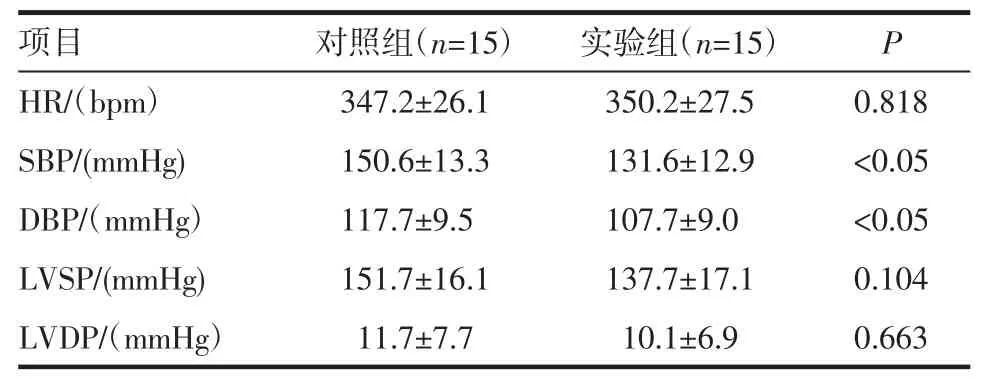
表1 两组大鼠血流动力学对比Tab 1 Comparison of hemodynamic parameters between two groups
2.5 病理 各组分别喂养12 周后,取大鼠心室肌组织进行固定,切片,HE 染色光镜下可见,对照组大鼠心肌细胞排列有序、胞浆均匀,心肌间隙小;实验组大鼠心肌组织排列紊乱,大小不均,组织间隙增大(图5)。Masson 染色显微镜下观察到,与对照组相比,实验组大鼠心肌间质纤维化明显,纤维组织增生显著,可见大量被染成蓝色的胶原纤维呈条索状广泛分布。计算两组大鼠心室组织胶原容积分数,结果显示实验组大鼠心肌组织胶原分数较对照组升高,有统计学意义(图6)。
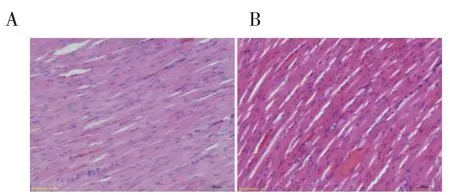
图5 心肌组织HE 染色(20×)Fig 5 HE staining of ventricular tissues(20×)
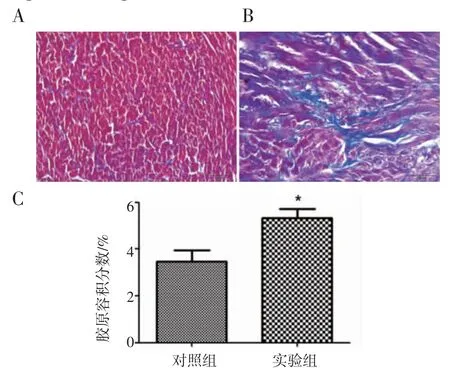
图 6 心肌 Masson 染色(20×)Fig 6 Masson staining of ventricular tissues(20×)
2.6 蛋白定量实验 Western 印迹实验显示,蛋氨酸喂养大鼠PDCD4 表达上调,见图7。
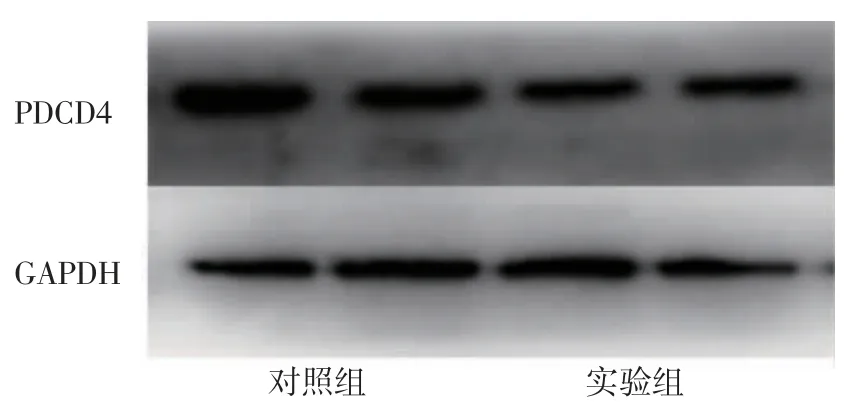
图7 PDCD4 蛋白表达量Fig 7 Expression of protein PDCD4
3 讨论
心力衰竭即心脏难以泵出足够的血液以满足机体对血液和氧气的需求而导致机体出现相关症状与体征的复杂的临床综合征。为多种心血管疾病的终末阶段,其发病率高,有临床症状患者的5 年存活率与恶性肿瘤相仿。近期心力衰竭的发病率持续增长,正在成为21 世纪最重要的心血管病症[7]。据统计, 人群中心力衰竭的患病率约为1.5%~2.0%,65岁以上可达6%~10%;在过去的40 年中,心力衰竭导致的死亡增加了6 倍[7]。冠心病、心肌梗死、心律失常、心肌病、心瓣膜病以及代谢性疾病等都可导致心力衰竭的发生。心肌细胞死亡影响心室的收缩功能,纤维化程度的增加导致心室舒张功能的下降,心功能受损、心腔扩大进而导致心室重构,最终发展为心力衰竭。
为了寻求心力衰竭的治疗,以往的研究构建了多种动物模型,多以增高心脏前后负荷,或通过缺血性心肌病,心脏快速起搏,或直接损伤心肌的药物如蒽类抗癌药物来模拟心力衰竭[8-10]。尚无成熟的代谢性疾病导致心力衰竭的动物模型建立,HCY 是多种心血管疾病的危险因素[4,11-12]。随着生活水平的提高,蛋白质摄入增多,中国人群的血HCY 水平较高[13],高HCY 血症的总体患病率高达27.5%,而中国人群中不仅叶酸缺乏比例增高,MTHFR 基因突变比例较高,单纯补充叶酸水平可能难以降低血HCY 水平[14-15]。故模拟高HCY 导致心力衰竭模型,研究其对心室重塑的作用机制,寻求心力衰竭的新的治疗手段,十分有必要。有研究表明高HCY 血症可致大鼠心力衰竭[16]。且有实验应用蛋氨酸喂养大鼠构建高HCY 血症模型[17-20],但应用蛋氨酸喂养构建大鼠心力衰竭模型尚未得到广泛验证与认可。笔者通过喂养3%蛋氨酸饲料构建心力衰竭模型,证实蛋氨酸喂养组血浆HCY 浓度明显高于对照组[(5.62±0.44)μmol/L vs(13.25±0.57)μmol/L,P<0.05],与 Liu 等[16]实验中的 HCY 测量值有差异(HCY>20 μmol/L),可能与喂养时间、采血时间不同有关。大鼠的超声心动图结果趋势与Liu 实验中大鼠心功能改变的趋势相似,两组间差别存在统计学意义,故可以认为高蛋氨酸喂养大鼠心肌重塑模型成功,之后笔者通过HE 染色和Masson 染色证实了HCY对大鼠心肌的病理损害,可见实验组大鼠心肌细胞排列紊乱,细胞肥大,组织疏松,心室肌纤维化明显。经过蛋白定量实验证实蛋氨酸饲料喂养组大鼠的心室肌PDCD4 蛋白表达下调,表明蛋氨酸饲料喂养大鼠导致的高HCY 血症对心肌细胞的直接损伤可能是通过下调PDCD4 所致。
总之,笔者发现蛋氨酸在体内转化为HCY 后可直接作用于心肌,损伤心功能,其机制可能与下调PDCD4 通路有关,调控PDCD4 通路表达,可能成为心力衰竭治疗的新方向。
