CFL1 的表达对前列腺癌进展影响的研究
2020-06-15肖龙飞彭华红杨阔王玉琢
肖龙飞,彭华红,杨阔,王玉琢
(天津医科大学第二医院泌尿外科,天津市泌尿外科研究所,天津300211)
前列腺癌是男性最常见的恶性肿瘤,也是癌症死亡的主要原因[1]。中国是前列腺癌发病及死亡较低的国家之一,但我国前列腺癌的发病率在近年来呈现持续快速增长趋势。肌动蛋白细胞骨架的动态变化,如肌动蛋白丝的解聚和断裂,是细胞存活、成形、胞质分裂、迁移等细胞过程所必需的。这些均表明细胞骨架是治疗肿瘤的潜在靶点[2-4]。肌动蛋白解聚因子(ADF)/辅酶蛋白(cofilin)是调节肌动蛋白和细胞骨架动力学的蛋白质家族之一[5]。CFL1(cofilin-1)是一种普遍存在的调节细胞周期和增殖[6]、凋亡[7]和兴奋性毒性神经变性[8]等细胞功能的蛋白质。此外,CFL1 表达量的增加与某些类型肿瘤和转移的进展有关[9-10]。虽然有报道CFL1 在前列腺癌中充当某种药物或基因的中间因子[11-12],而且CFL1 在前列腺癌中高表达已被证实[13],但是,CFL1 在前列腺癌中的具体作用仍不清楚。本研究中,笔者收集天津医科大学第二医院2016 年1 月-2018 年12 月良性前列腺增生和前列腺癌组织标本,并检测其中CFL1 的表达水平,发现CFL1 在前列腺癌中明显高表达,且其高表达与前列腺癌不良分化及患者不良预后密切相关。此外,降低内源性CFL1 水平可显著抑制人前列腺癌细胞的增殖及转移。因此,CFL1 是评价前列腺癌发病及疾病进展的可能的分子标志物,其可能是未来前列腺癌分子治疗的有效靶点之一。
1 材料和方法
1.1 细胞培养及组织 人前列腺癌细胞系LNCaP、DU-145、PC-3 及正常前列腺细胞系 RWP-1 均由天津市泌尿外科研究所冻存、复苏,于含10%的胎牛血清(FBS)的RPMI-1640 培养液中37℃ 5%CO2培养。20 例良性前列腺增生及40 例前列腺癌组织均取自患者前列腺切除术后的石蜡标本(天津医科大学第二医院)。该研究已经获得天津医科大学伦理委员会的批准。
1.2 免疫组织化学法检测 每张切片厚度为4 μm,脱蜡后将切片放于0.01 mol/L 的 pH 为6.0~6.5 的枸橼酸盐中,然后用在微波炉中高火加热8 min 进行抗原修复。3% H2O2阻断内源性过氧化物酶,正常山羊血清工作液封闭非特异性结合位点后,滴加稀释好的CFL1(1:100)抗体,4℃过夜。滴加生物素标记的二抗,室温孵育15 min,用PBS 洗后,滴加辣根过氧化物酶标记的链卵白素,室温孵育15 min,DAB显色及苏木素复染,最后脱水封片。所有切片均由3名经验丰富的病理科医师在相同条件下盲法阅片。随机选取5 个高倍镜视野进行观察,以胞浆出现淡黄色至棕黄色为阳性标志。染色结果分为阴性(-):细胞无染色或很弱;阳性结果分为3 个等级:“+”为弱阳性染色;“++”为阳性染色;“+++”为强阳性染色。
1.3 Western blot 检测 将蛋白酶抑制剂(Solarbio,China)与总蛋白提取试剂(Solarbio,China)以 1∶100 的比例混合,充分摇动并与培养细胞混合。通过BCA 法测定蛋白质浓度,与上样缓冲液混合后每孔加30 μg 蛋白行SDS 聚丙烯酰胺凝胶电泳分离蛋白并在PVDF 膜上电转移。将膜浸润于相应的一抗中4℃孵育过夜,再于二抗中室温孵育1 h。最后,采用ECL 化学发光法对蛋白条带进行成像处理。抗体浓度 anti-GAPDH (1∶1 500,Proteintech, USA),anti-CFL1(1∶500,Proteintech,USA),anti-Caspase 3(1:1 000,Proteintech, USA),anti-BCL-2(1:1 000,Proteintech,USA)。
1.4 实时定量PCR(qRT-PCR)检测 用TRIzol 试剂(Invitrogen,Carlsbad,CA)从前列腺癌细胞中提取总RNA。使用逆转录试剂盒(CWBIO,China)将总RNA(3 μg)反转录成 cDNA。接下来,用 SYBR Green Master 试剂盒(Roche,Basel,Switzerland)扩增 cDNA。GAPDH 的表达用于标准作为每个样品中的内源对照mRNA。所用引物如下:CFL1 上游引物为:5′-TTATGCCAGCTCCAAGGACG-3′,下游引物为:5′-CCTCGTAGCAGTTTGCTTGC-3 ′;GAPDH 上游引物为:5 ′-CAGGAGGCATTGCTGATGAT-3 ′,下游引物为:5′-GAAGGCTGGGGCTCATTT-3 ′。qRT-PCR 引物从Genewiz(Suzhou,China)获得。
1.5 细胞转染 针对CFL1(siCFL1)的特异性siRNA 购自 GenePharma(Suzhou,China)具有暂时沉默CFL1 表达的作用。使用一个杂乱的无作用的序列作为对照 siRNA(siCtrl)。使用 Roche 转染试剂(Basel,Switzerland)将细胞与 siCFL1 或 siCtrl 一起孵育6 h,通过蛋白质印迹和qRT-PCR 检测敲低效率[14]。
1.6 CCK-8 增殖实验 细胞增殖采用CCK-8 试剂进行检测,将细胞铺板每组6 孔,饥饿过夜,然后采用10%血清培养基在37℃、5%CO2条件下培养,分别于接种 24、48、72 h 后在 450 nm 光下进行吸光度检测,绘制细胞生长曲线。
1.7 细胞侵袭及迁移实验 使用具有8.0 μm 孔径的 Transwell 小室(Corning Costar,Corning,NY,USA)进行体外侵袭测定和迁移测定。对于侵袭实验,将密度为6×104/200 μL 的细胞接种在无血清培养基中。上腔室加入 50 μL 的基质胶,而 600 μL 含有10%血清的1640 培养基加入下腔室。24 h 后,对通过膜的细胞用DAPI 染色,并在荧光显微镜下计数细胞数。随机选取5 个视野进行计数并做统计分析[15]。对于迁移实验,除了不加入基质胶外,操作流程与侵袭实验相同。
1.8 统计学分析 使用SPSS22 进行数据分析。所有实验至少进行3 次。所有数据均表示为。t 检验用于比较两组之间的差异。多组样本均数的比较采用单因素方差分析,P<0.05 被认为反映了统计学上的显着差异。
2 结果
2.1 TCGA 数据库显示CFL1 在前列腺癌中的表达较正常前列腺高 为了明确CFL1 是否在前列腺癌的发生或进展中发挥重要作用,首先利用TCGA 数据库对CFL1 在前列腺癌中的表达进行预测,显示CFL1 在前列腺癌样本中的表达较正常前列腺样本明显升高(图1A)。而且,CFL1 与前列腺癌的无进展生存期密切相关(图1B),结果显示,CFL1 的表达越高,前列腺癌患者的无进展生存期越短。
2.2 免疫组化染色显示CFL1 蛋白在前列腺癌中高表达 CFL1 蛋白在良性前列腺增生组织中低表达,在前列腺癌分期Ⅰ、Ⅱ期的组织中中度表达,而在Ⅲ、Ⅳ期的组织中CFL1 呈现高表达(图2)。各组织的具体阳性率比较见表1。
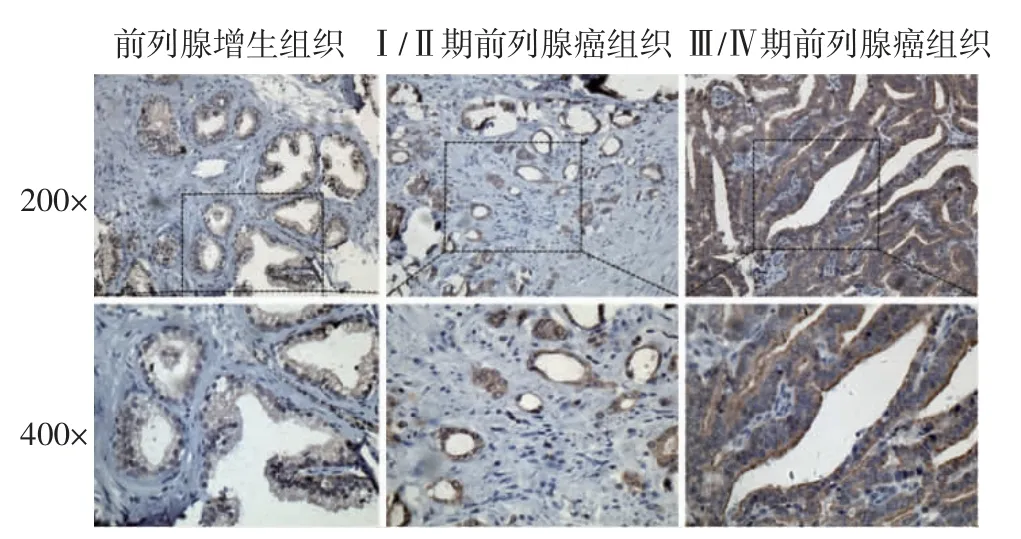
图2 CFL1 在前列腺增生及前列腺癌组织中的表达Fig 2 Expression of CFL1 in benign prostatic hyperplasia and prostate cancer
2.3 CFL1 在恶性程度高的前列腺癌细胞系中表达量较高 为了进一步了解CFL1 在前列腺癌中的作用,验证它在正常前列腺细胞系RWP-1 和不同恶性程度前列腺癌细胞系LNCaP、DU-145、PC-3 中的表达水平,发现CFL1 在RWP-1 中表达量最低,LNCaP 中次之,DU-145 和 PC-3 中最高(图3),而DU-145 和PC-3 细胞系的恶性程度比LNCaP 和RWP-1 细胞系高。上述结果表明,CFL1 的表达随前列腺癌细胞的恶性程度增高而增高。
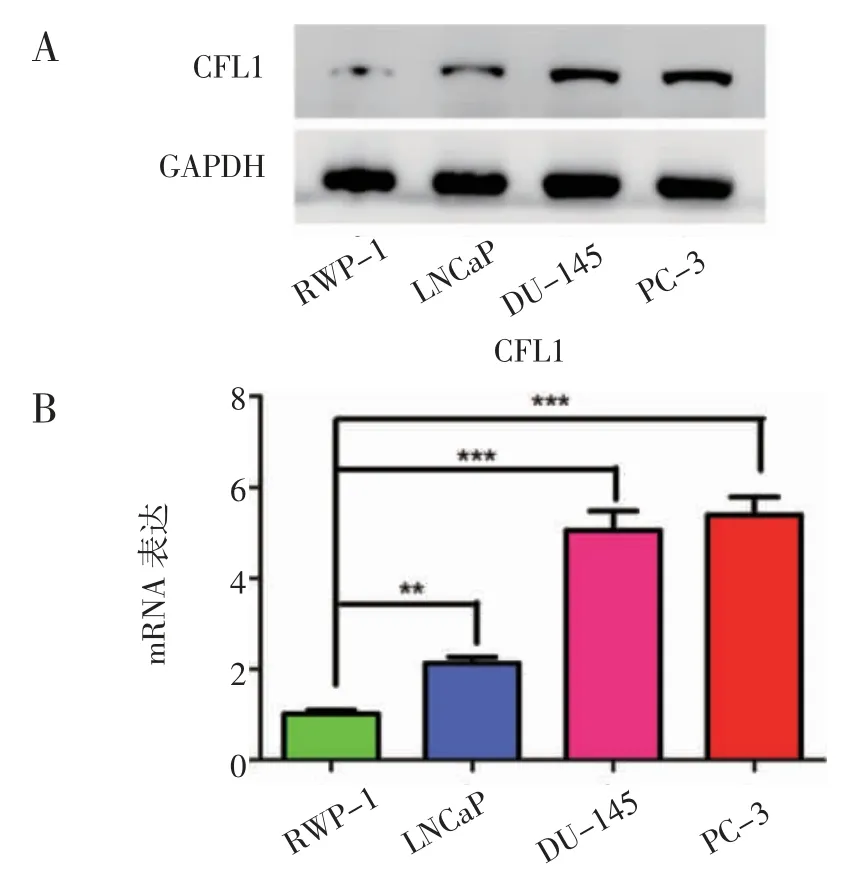
图3 CFL1 在不同细胞系中的表达Fig 3 Expression of CFL1 in different cell lines
2.4 验证CFL1 的敲低效率 笔者用siRNA 分别在 PC-3(图4A)和 DU-145 细胞系(图4B)中敲低CFL1,并在mRNA 和蛋白水平上检测敲低效率。经验证,在两个细胞系中CFL1 均达到敲低效果。
2.5 敲低CFL1 可抑制前列腺癌细胞的迁移和侵袭 为了评价CFL1 的生物学功能,使用Transwell实验检测敲低CFL1 后前列腺癌细胞迁移和侵袭能力的变化。实验结果表明,敲低CFL1 后PC-3 细胞的迁移和侵袭能力均有明显的降低(图5A)。在DU-145 细胞系中也可以看到同样的结果(图5B)。
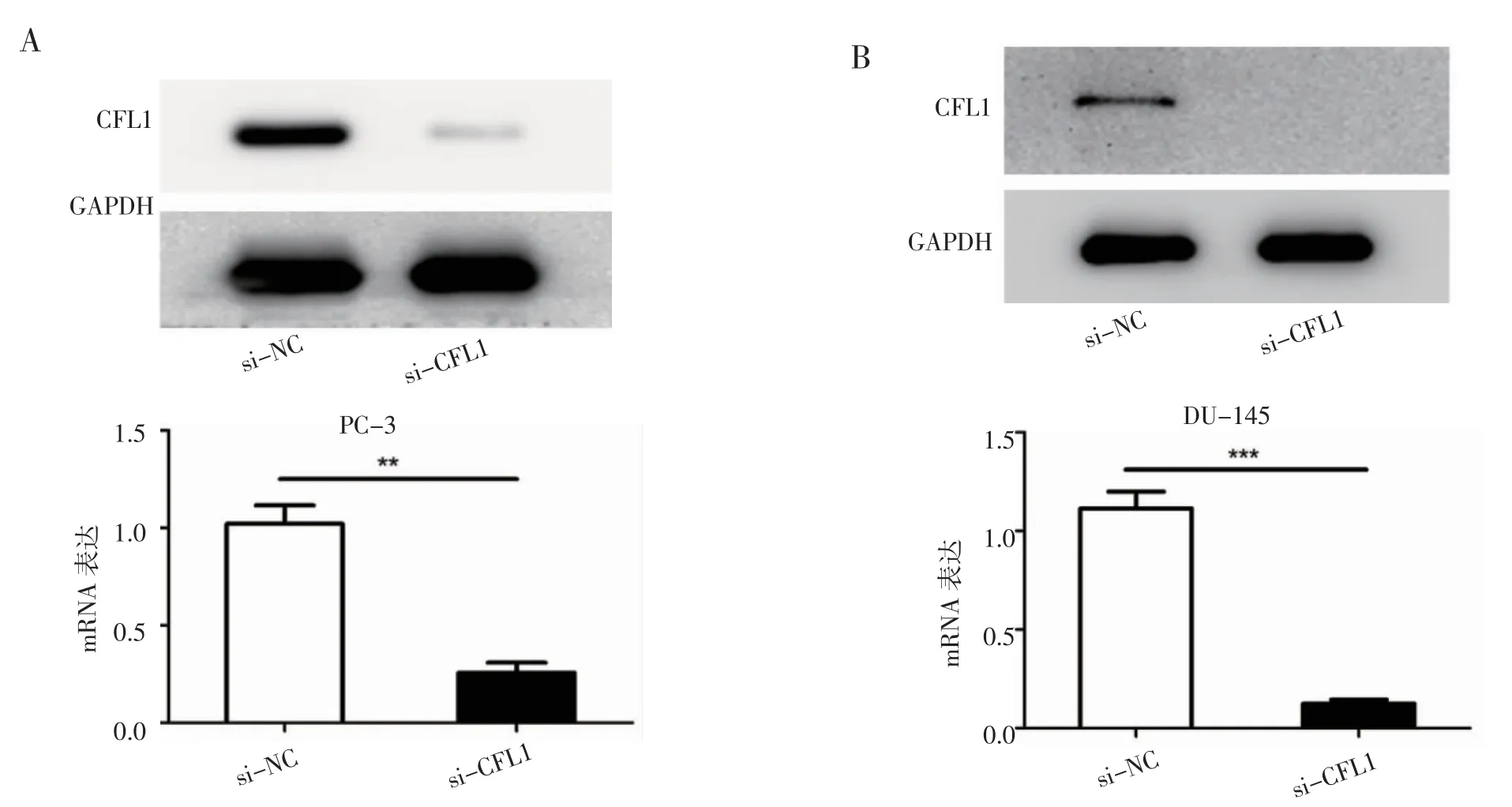
图4 验证CFL1 的敲低效率Fig 4 Verify the knockdown efficiency of CFL1
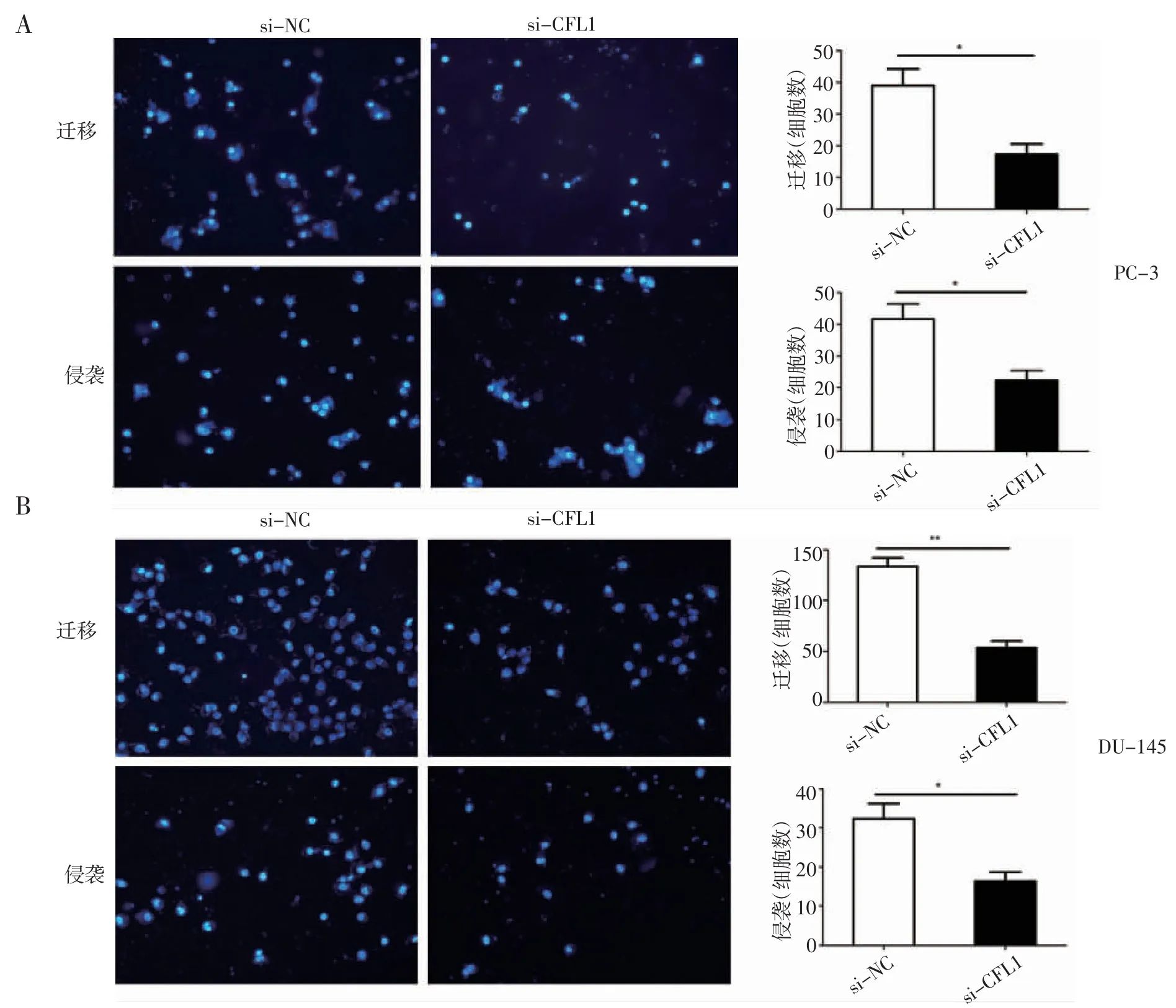
图5 敲低CFL1 后细胞迁移和侵袭能力的改变Fig 5 Changes in cell migration and invasion capacity after CFL1 knockdown
2.6 CFL1 低表达可抑制前列腺细胞的增殖并且促进凋亡 为了进一步探索CFL1 在前列腺癌中的生物学功能,在PC-3 细胞系中敲低CFL1,然后通过CCK-8 实验检测细胞增殖能力的改变,结果显示,敲低CFL1 后,PC-3 细胞的增殖能力显著降低(图6A)。通过Western blot 实验检测敲低CFL1 后细胞凋亡标志物的改变,发现凋亡促进因子caspase3 的表达量增加,凋亡抑制因子BCL-2 的表达量降低(图6B)。结果表明,敲低CFL1 可以促进前列腺癌细胞的凋亡。
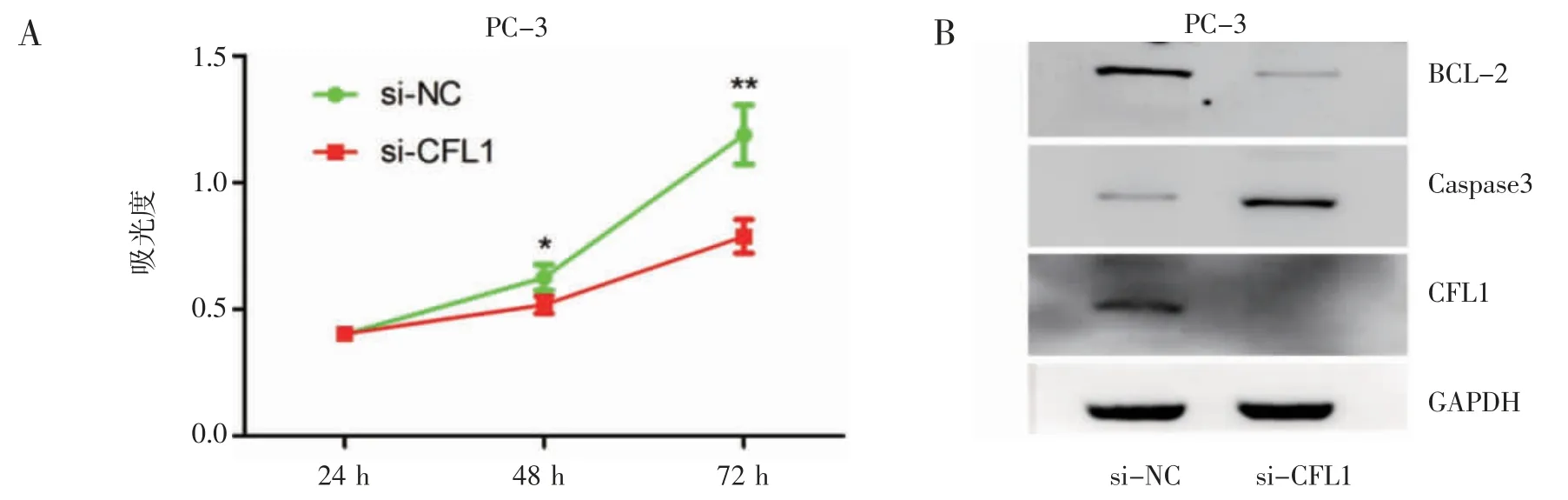
图6 敲低CFL1 后细胞增殖和凋亡能力的改变Fig 6 Changes in cell proliferation and apoptosis after CFL1 knockdown
3 讨论
CFL1 在很多肿瘤中都扮演着很重要的作用。已有研究显示,CFL1 在乳腺癌中高表达并且可以作为预测治疗反应的生物标志物[16-17]。而且,Aurora激酶A 可以通过诱导CFL-1 活性,从而促进乳头状甲状腺癌迁移及淋巴结转移[18]。还有报道,miR-182-5p 可以通过调节CFL1,影响人膀胱癌细胞的增殖、迁移和侵袭[19]。CFL1 在前列腺癌中也起着某些作用,CFL1 是人前列腺癌细胞中转化生长因子β信号转导的细胞内效应物[20]。同时,通过碳纳米角递送siRNA 敲低CFL1,增强了人前列腺癌细胞中多西紫杉醇介导的细胞毒性[21]。然而,关于CFL1 在前列腺癌中具体的作用及影响尚未有人研究。在这项研究中,笔者试图研究CFL1 在前列腺癌中的不同作用。
在目前的研究中,笔者证明了CFL1 在晚期前列腺癌中的表达高于早期前列腺癌和良性前列腺增生。此外,还发现CFL1 在侵袭性前列腺癌细胞系DU-145 和PC-3 中高度表达。当CFL1 在DU-145和PC-3 细胞系中被敲低时,前列腺癌细胞的迁移、侵袭及增殖均被抑制,而凋亡却增加。然而,关于CFL1 具体影响前列腺癌进展的机制尚不清楚,这些需要进一步研究。
总的来说,本研究数据证实了CFL1 在前列腺癌细胞中高表达,而且可以促进前列腺癌的发生、发展。这些均表明,CFL1 可作为前列腺癌潜在的肿瘤分子标志物及可能的靶向治疗分子靶点,对于前列腺癌的治疗进展有着极大地借鉴作用。
