对粗盐提纯实验的深度思考
2020-06-13胡明波
胡明波
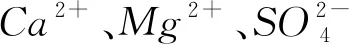
1 粗盐中的可溶性杂质及其影响
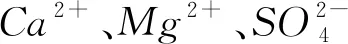
1)CaCl2、MgCl2、Na2SO4的存在让粗盐易潮解,不容易储存.
2)粗盐中杂质离子的过量摄入会对身体产生不良影响.当血钙浓度大于3mmol·L-1时, 会导致贫血、厌食、腹泻、腹痛等.长期高血钙还会引起肾脏病变, 发展为高血钙性肾脏病, 慢性肾功能衰竭, 肾小管对钙的重吸收减少可导致高钙尿症、肾结石等.镁补充过量会发生恶心、呕吐、腹泻、发热和口渴、低钾血症、代谢性碱中毒等症状, 严重时则出现嗜睡、血压降低、呼吸减慢、心动过缓、体温降低、四肢瘫痪甚至死亡.摄入过量硫酸盐可出现腹泻、脱水甚至胃肠道功能紊乱.
3)食盐作为生活中常见的调味剂,杂质离子的存在会影响口感.
4)Ca2+、Mg2+的存在让食盐在使用过程中产生难溶物.
所以粗盐进行提纯是必要的,同时,粗盐提纯的副产物碳酸钙、氢氧化镁、硫酸钡也在工业、医药等方面有重要用途.
2 粗盐中Ca2+、Mg2+的检验
高中化学教材《必修1》(2004年人教版)实验1-2,对粗盐中硫酸根离子的存在进行了检验,硫酸根离子的检验也是高中化学的重要的知识点,该部分知识也出现在了2019年新人教版高中化学《必修2》第五章中.教材中没有提及Ca2+、Mg2+的检验,但是在教学过程中,学生会问到这个问题.用常见的试剂及沉淀法进行Ca2+、Mg2+的检验说服力不强,2种离子相互干扰,见表1.如果出现沉淀,都是白色,很难通过观察判断微溶和难溶.
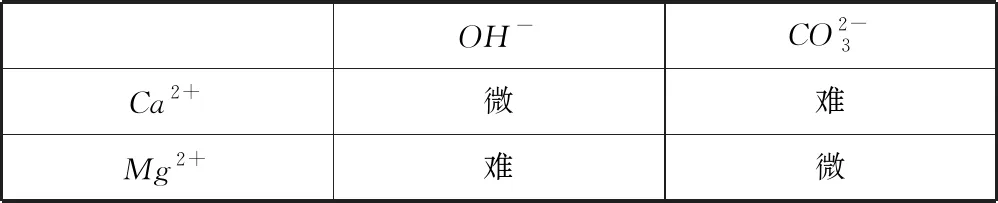
表1
这两种离子的检验虽然不是高中化学需要掌握的知识点,但是一个很好的探究式教学课题.建议采取课外探究式学习的方式,引导学生小组合作、分析讨论、查找资料,得出结论后教师进行点评.
目前来说操作简单又比较适合高中学生检验Ca2+、Mg2+的方法如下:
1)Ca2+的检验:向粗盐水中加入草酸钠溶液,出现白色沉淀再加入稀盐酸,沉淀不溶解.草酸钙沉淀非常难溶于水而且也较难溶于稀强酸(如1mol·L-1的盐酸).而相似的草酸钡、草酸镁却可溶于稀强酸,这是草酸钙的特别之处,所以常用于钙离子的检验.
2)Mg2+的检验:向粗盐水中加入氢氧化钠溶液,加入1滴镁试剂Ⅱ(对硝基苯偶氮-1-萘酚) 产生天蓝色沉淀,表示有Mg2+.
3)提高沉淀和溶液分离效率的方法.
高中化学课程标准指出,化学教学要从社会实际出发,贴近生活,贴近实际.通过实验,让学生体验科学研究的过程,激发学生学习化学的兴趣.教师对教学的内容要有广度和深度的思考,而不是拘泥于教材和考试.教师通过化学课堂的教学,让学生学会思考、学会质疑、学会探究、学会学习,使学生受益终生.
