新型冠状病毒肺炎合并肝脏生化学异常的特点
2020-06-13黄春明李凌华詹远京郭家伟谢梦兰胡中伟
黄春明, 李凌华, 詹远京, 郭家伟, 谢梦兰, 胡中伟
广州医科大学附属市八人民医院消化内科,广东 广州 510060
新型冠状病毒肺炎(corona virus disease 2019,COVID-19)是新发传染病,目前已在全球蔓延成为全球公共卫生事件[1]。新型冠状病毒(SARS-CoV-2)主要靶点为肺部,肝脏也是一个靶点[2-3],COVID-19合并肝脏生化学异常是当前研究热点之一,本研究拟通过COVID-19患者早期肝功能和凝血功能等结果,分析肝脏生化学异常的特点和危险因素。
1 资料与方法
1.1 研究对象回顾性分析2020年1月至2月广州医科大学附属市八人民医院收治的218例COVID-19患者的临床资料,COVID-19诊断标准参照《新型冠状病毒肺炎诊疗方案(试行第七版)》[2],病例分型以出院最后诊断作为标准,轻型和普通型统称为轻症,重型和危重型统称为重症。肝脏生化学异常定义:总胆红素(TBIL)>21 μmol/L、ALT>50 U/L或AST>40 U/L,入院24 h或第1周至少一项达标。肝脏生化学轻度升高:ALT或AST<3×正常值上限(ULN),总胆红素<2×ULN。慢性肝病基础病:既往乙肝表面抗原阳性、丙肝抗体阳性、酒精性肝硬化史。基线:入院24 h内结果。本研究所有患者均签署知情同意书,本研究取得广州医科大学附属市八人民医院伦理委员会批准(202007140)。
1.2 临床资料收集基本资料包括性别、年龄、入院记录、最后诊断等,实验室生化包括血常规、C-反应蛋白(CRP)、肝肾功能、D-二聚体(DD)和心肌酶等;SARS-CoV-2咽拭子由广州市疾病预防控制中心检测。
1.3 统计学方法采用SPSS 19.0软件处理数据,正态分布计量资料采用均数±标准差表示,组间比较采用t检验;非正态分布计量资料,采用M(P25,P75)表示,组间比较采用非参检验。计数资料以例数/%表示,卡方检验(Pearson卡方或连续校正卡方)或Fisher精确概率法比较差异性,Spearman行相关性分析,多因素Logistic回归分析独立危险因素,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况轻症组189例,男81例,女108例,中位年龄45(33,62)岁;重症组29例,男19例,女10例,中位年龄61(55,68)岁,重症组年龄显著高于轻症组(Z=-4.308,P<0.05)。肝脏生化学异常患者共64例(基线46例,第1周39例,其中21例患者基线和第1周均有肝功能异常),肝功能正常者154例,两组年龄差异无统计学意义(Z=-1.702,P>0.05)。慢性肝病基础病共10例,乙肝表面抗原携带者8例,丙肝抗体阳性1例,酒精性肝病1例。
2.2 轻症和重症患者肝功能和凝血功能差异比较与轻症组比较,重症组基线时直接胆红素(DBIL)、ALT、AST、γ-谷氨酰转肽酶(GGT)、纤维蛋白原和DD显著升高,白蛋白(ALB)显著下降(P均<0.05),而TBIL、总胆汁酸、球蛋白、胆碱酯酶、碱性磷酸酶(ALP)、凝血酶原时间(PT)、凝血酶原活动度(PTA)、国际标准化比值(INR)、活化部分凝血活酶时间(APTT)差异无统计学意义(P均>0.05)(见表1)。
2.3 轻症和重症患者基线肝功能异常率比较重症患者基线总胆汁酸、球蛋白、AST、血浆纤维蛋白原、DD升高和ALB下降更常见(P均<0.05),TBIL、DBIL、ALT、胆碱酯酶、GGT、PT、PTA、INR和APTT异常率组间差异无统计学意义(P均>0.05),ALP无升高病例(见表2)。
2.4 1周内胆红素和转氨酶高峰值分层分析基线及入院1周时两次胆红素和转氨酶取高峰值分层分析。轻症和重症患者1周内TBIL、ALT和AST高峰值均以轻度升高为主,全部患者共1例TBIL>2×ULN,3例ALT>3×ULN,3例AST>3×ULN。轻症和重症患者胆红素和转氨酶高峰值分层比较显示,重症组TBIL升高(>21 μmol/L组)、ALT升高(50~99 U/L组和100~149 U/L组)、AST升高(40~79 U/L组和80~119 U/L)的比例均高于轻症组(P<0.05)(见表3)。
2.5 肝脏生化学异常组和肝功能正常组基线生化指标比较与肝功能正常组比较,肝脏生化异常组CRP、NEU、肌酸激酶(CK)和LDH较高,淋巴细胞(LYM)、嗜碱性粒细胞(B)、嗜酸性粒细胞(EOS)较低(P均<0.05),WBC、HGB、PLT、肌酸激酶同工酶(CK-MB)和肌酐(Cr)差异无统计学意义(P均>0.05)(见表4)。
2.6 ALT、AST和TBIL同时升高的比例及三者相关性分析基线时ALT和AST同时升高占32.6%(15/46),ALT、AST和TBIL三者同时升高占4.3%(2/46);第1周时ALT和AST同时升高占38.5%(15/39),ALT、AST和TBIL三者同时升高占5.1%(2/39)。
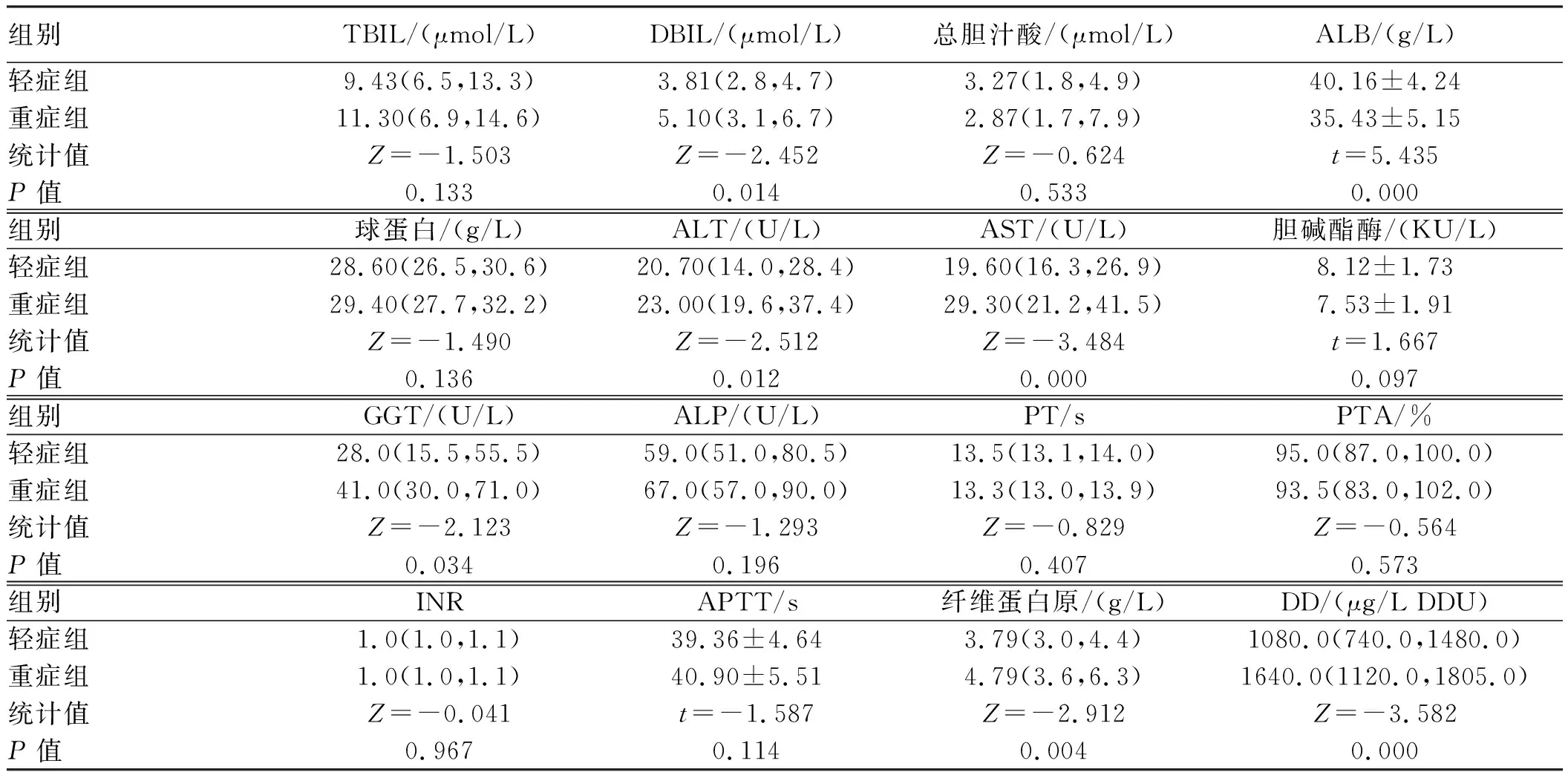
表1 轻症和重症COVID-19基线时肝功能和凝血功能比较 [M(P25, P75)]Tab 1 Comparison of liver function and coagulation function between mild and severe COVID-19 at baseline [M(P25, P75)]
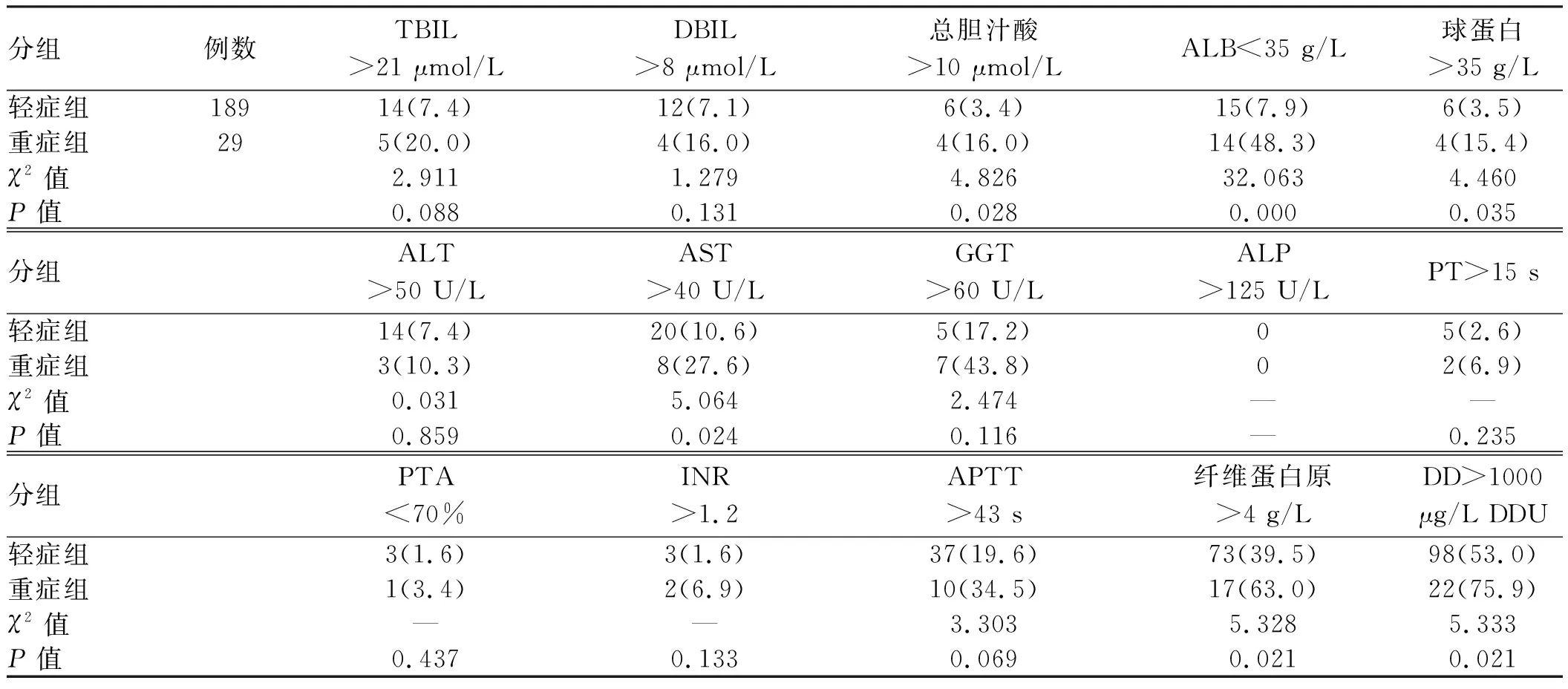
表2 两组基线肝脏相关生化指标异常率比较[n(%)]Tab 2 Comparison of abnormal rate of liver-related biochemical indexes at baseline between the two groups [n(%)]
注:轻症组:DBIL缺失19例;总胆汁酸缺失15例;球蛋白缺失16例;DD缺失4例;GGT缺失160例,ALP缺失160例,纤维蛋白原缺失4例。重症组:TBIL缺失4例;DBIL缺失4例;总胆汁酸缺失4例;球蛋白缺失3例; GGT缺失13例,ALP缺失13例;纤维蛋白原缺失2例。“—”采用Fisher精确概率法。
基线时ALT与AST相关(r=0.655,P=0.000),ALT与TBIL、AST与TBIL均无相关性(r分别为0.031、0.027,P均>0.05);第1周时ALT与AST、ALT与TBIL相关(r1=0.629,P1=0.000;r2=0.151,P2=0.026),AST与TBIL无相关性(r=0.089,P>0.05)。
2.7 肝脏生化学异常与临床分型、基础病、基线其他生化指标相关性分析肝脏生化学异常与重症、慢性肝病、基线CRP、LDH和CK呈正相关,相关系数分别为0.281、0.148、0.275、0.298和0.146,与LYM、EOS、B呈负相关,相关系数分别为-0.223、-0.227和-0.174(P均<0.05),但与性别、年龄、高血压病、糖尿病、WBC、HGB、血小板、Cr和CK-MB无相关性(P均>0.05)。
2.8 肝脏生化学异常患者危险因素分析将上述8个相关因素指标纳入多因素Logistic回归分析,结果显示重症COVID-19、慢性肝病基础病和基线LDH升高是肝脏生化学异常的独立危险因素,OR分别为2.676(95%CI:1.001~7.158)、4.482(95%CI:1.051~19.125)和2.585(95%CI:1.128~5.925)(P均<0.05)(见表5)。
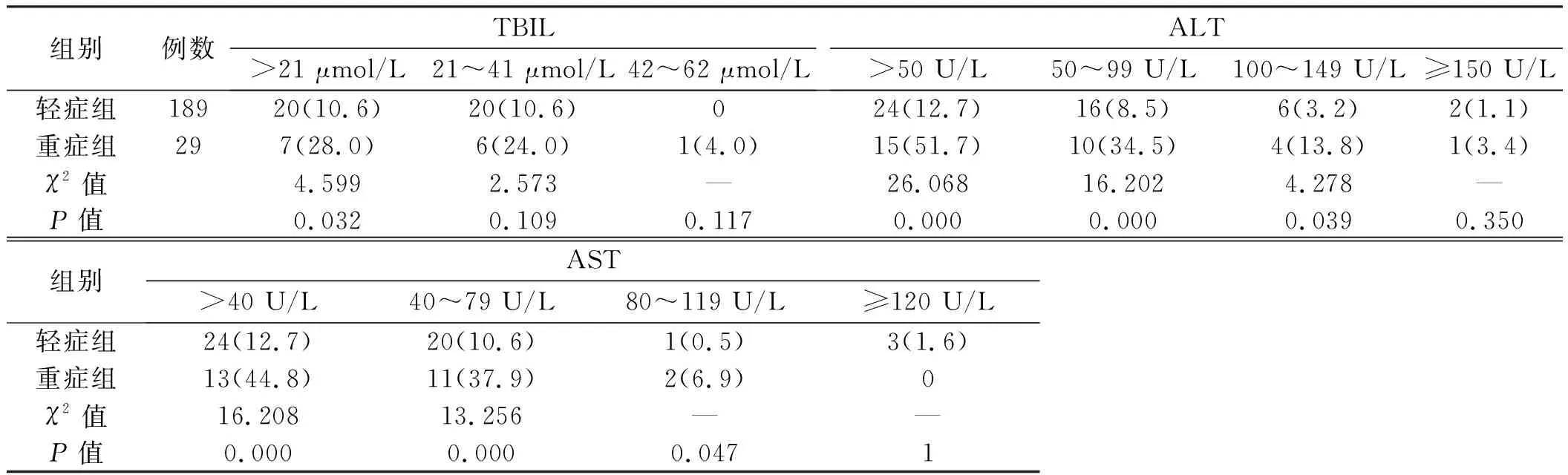
表3 COVID-19患者1周内总胆红素和转氨酶峰值分层比较 [n(%)]Tab 3 Comparison of peak stratification of total bilirubin and transaminase in patients with COVID-19 within one week [n(%)]
注:重症组TBIL缺失4例;“-”采用Fisher精确概率法。
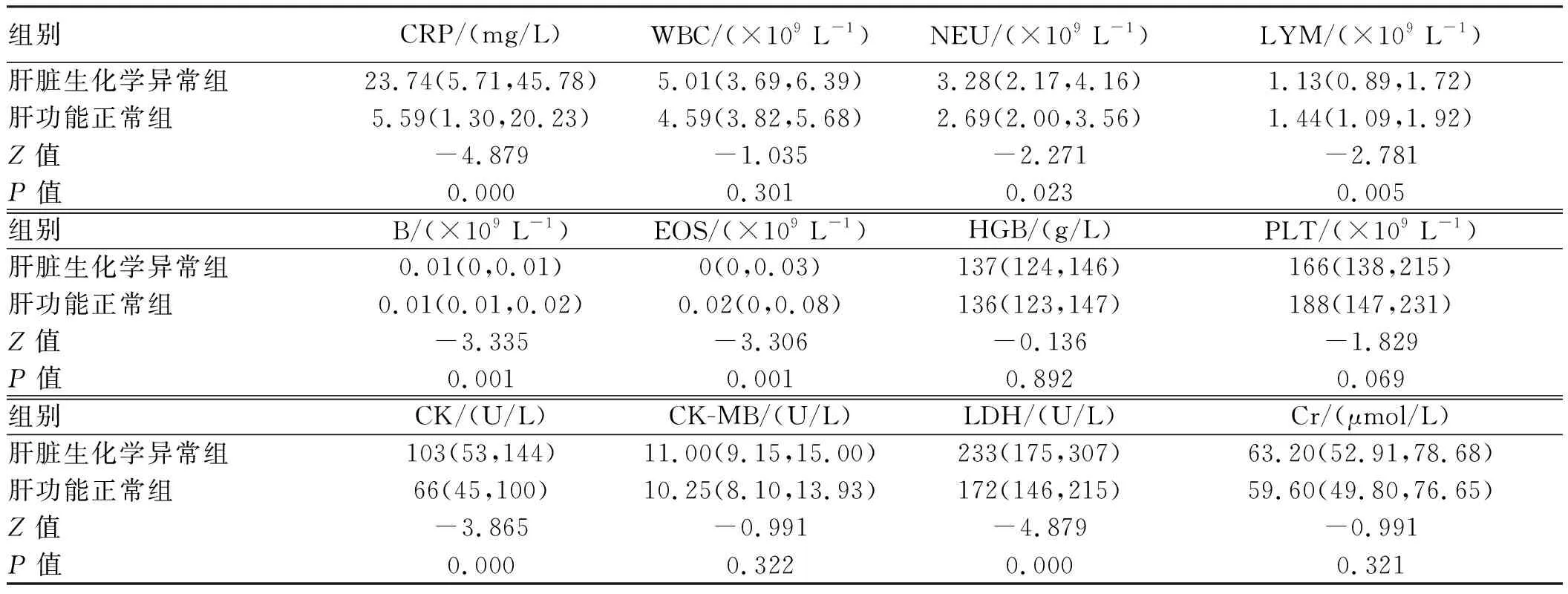
表4 肝脏生化学异常组和肝功能正常组基线生化指标 [M(P25,P75)]Tab 4 Baseline biochemical indexes in patients with abnormal liver biochemistry group and normal liver function group [M(P25,P75)]
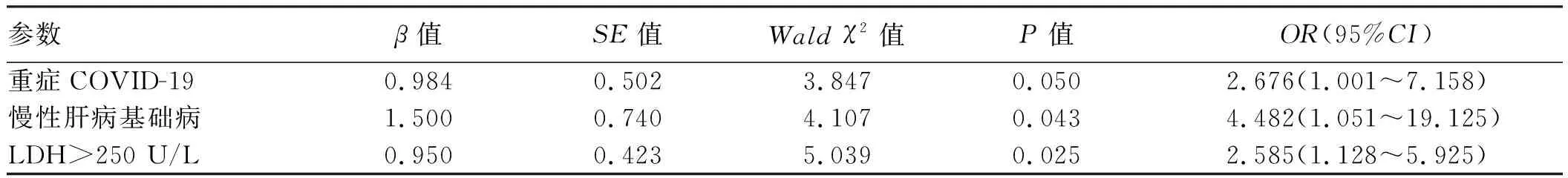
表5 肝脏生化学异常患者多因素Logistic回归分析结果Tab 5 Analysis of multiple factor Logistic regression in patients with abnormal liver biochemistry
3 讨论
SARS-CoV-2是新近发现的一种冠状病毒,其通过S-蛋白与ACE2受体及细胞蛋白酶TMPRSS2结合而侵入机体,主要靶点为肺部,同时肝脏、心脏、胃肠道也可能受累[4-5],首例活体组织病理学检查结果提示除肺部严重损伤,肝脏可见中度微血管脂肪变性和轻度肝小叶活动[6]。本研究分析我院收治的218例COVID-19患者早期肝功能、凝血功能等生化指标,探讨SARS-CoV-2感染早期肝脏生化异常的特点及危险因素。
本研究早期肝脏生化学异常的总发生率为29.4%,入院基线时为21.1%,第1周为17.9%;ALT升高总发生率为17.9%,AST升高总发生率为17.0%,重症患者早期ALT和AST升高总发生率高于轻症患者,最新专家组纳入多项最新研究分析[7-15],COVID-19患者中ALT和(或)AST升高的发生率为14%~53%,重型患者的转氨酶升高发生率高于轻型和普通型患者[3],这与本研究结果相近。本研究TBIL升高总发生率为12.4%,重症者TBIL升高更常见,钟南山团队[7]总结多中心1 099例COVID-19患者研究显示,TBIL升高的总发生率约为10%,ICU、机械通气或死亡患者TBIL升高发生率更高,这也与本研究结果相近。目前暂无对转氨酶增高分层及ALT、AST和TBIL同时升高的观察报道,我们观察到TBIL升高27例,仅1例>2×ULN,ALT和AST升高各39和37例,ALT和AST>3×ULN均只有3例,这说明SARS-CoV-2患者肝脏生化学异常主要表现为轻度升高,这与诊疗方案描述一致[3];ALT和AST同时升高者占肝脏生化学异常者均未达40%,ALT和AST相关性较好,但ALT、AST和TBIL三者同时升高仅4.3%~5.1%,表明肝脏生化学异常可表现为单一指标异常,而TBIL、ALT和AST三者同时升高的比例很低。
本研究多数患者未查ALP和GGT,轻症和重症GGT和ALP分别有29例和16例,初步提示重症组患者GGT更高,但GGT异常率差异无统计学意义;两组ALP比较差异无统计学意义,且无升高病例。临床研究[10-11]显示,反映胆管损伤的ALP及GGT无明显升高,本研究ALP结果相符,但GGT差异有统计学意义,这需要大样本研究论证。
本研究还提示早期肝脏生化学异常与重症、慢性肝病、基线CRP、LDH和CK呈正相关,与LYM、EOS和B呈负相关,多因素分析显示重症COVID-19、慢性肝病和基线LDH升高是肝脏生化学异常的独立危险因素。肝脏生化学异常发病机制尚不明确,可能与以下因素有关:SARS-CoV-2直接毒性作用、应激与全身炎症反应、继发肝脏缺血和低氧、原有基础肝病的激发或加重及药物性肝损伤[3]。本研究重症和慢性肝病患者更易出现肝脏生化学异常,这与上述发病机制一致,遗憾的是本研究慢性肝病患者无发病前后HBV DNA、HCV RNA和肝功能对照,不能判断SARS-CoV-2是否激发肝炎病毒。LDH是非特异性细胞损伤的敏感标志物,其是很多肺部疾病的炎症预测因子,如阻塞性疾病、微生物肺疾病、间质性肺疾病和急性呼吸窘迫综合征等[16-18]。ICU重症者、难治性COVID-19患者其LDH水平更高[7-8, 14, 19],LDH是重症患者良好的预测指标,也与肝脏生化异常密切相关。本研究数据来源于入院1周内,药物性因素较小,可能较好反映SARS-CoV-2感染后早期肝脏生化学特点。
总之,本研究初步结果提示,COVID-19患者早期肝脏生化学异常的总发生率近30%,主要表现为TBIL、ALT或AST轻度升高,可表现为一个指标异常,三个指标同时升高少见。重症患者早期ALT、AST和TBIL升高更常见,慢性肝病基础病、重症COVID-19、基线LDH升高是早期肝脏生化学异常的独立危险因素。本研究存在一些缺陷,如重症患者少,尤其是ALP和GGT数据甚少,未获得住院前后肝炎病毒动态变化值等,期待多中心、大规模的临床研究报道肝脏生化学异常特点,为评估SARS-CoV-2导致的靶器官损伤提供临床数据。
