环状RNA在胃癌中的功能研究及潜在应用价值
2020-06-13汪志兵张振玉
汪志兵,张振玉
南京医科大学附属南京医院(南京市第一医院)消化科,江苏 南京 210006
胃癌是全球范围内最常见的恶性肿瘤之一,具有高发病率和高死亡率的特征。环状RNA(circRNA)是一类非编码RNA,具有共价链接的环形结构。近年来,研究发现大量circRNA参与许多生物过程,包括肿瘤的发生和发展。越来越多的证据表明circRNA具有重要的生物功能。circRNA可被作为疾病诊断和预后的新型生物标志物和药物靶点。circRNA在癌症中的表达异常被视为癌症诊断和预后的潜在生物标志物。大量研究表明,circRNA有望成为治疗癌症的新型分子靶点。因此,本文聚焦在circRNA在胃癌中的分子功能及潜在临床应用价值分析。随着我们对circRNA与癌症关系认知的加深,将发现更多的癌症进展的分子机制,并采用新的治疗策略进行癌症的预防和治疗。
1 胃癌的流行病学调查与发病机制分析
胃癌是一种高发病率的恶性肿瘤,是全球癌症相关死亡的第三大原因,仅次于肺癌和肝癌[1-2]。数据显示,亚洲国家胃癌的发病率和死亡率逐年上升,尤其是东亚国家,如中国、日本和韩国[3]。在过去的几十年里,胃癌治疗取得了巨大进展。然而,胃癌的发病率和死亡率仍居高不下。胃癌是一个多阶段、缓慢渐进和多因素的病理过程。幽门螺杆菌感染、肥胖、过量摄入盐和硝酸盐及血型已被证明与胃癌的风险增加有关[1]。此外,基因突变、表观遗传变化和异常分子信号通路也涉及胃癌发生、传播和转移过程。因此,确定胃癌的分子模式及其特定的生物标志物,以开发针对特定肿瘤行为的治疗药物至关重要。大量报道证实,许多非编码RNA(ncRNA),如微RNA(miRNA)和长链非编码RNA(lncRNA),均与胃癌的致癌过程相关,并可应用于癌症的早期风险评估、临床的生物标志物治疗和生存评估[4]。
2 circRNA
circRNA由基因序列和功能结构域的不同组合形成。根据起源的不同,circRNA可分为三类:外显子来源的circRNA,内含子来源的circRNA,和由外显子和内含子共同组成的circRNA。circRNA被认为是RNA可变剪接过程中外显子跳跃的结果。circRNA的产生受多种因素的调节,包括RNA序列、酶的催化和蛋白的调节。腺苷脱糖酶(ADAR1)是一种RNA修饰酶。据报道,ADAR1可以抑制circRNA的表达,而敲降ADAR1则会导致circRNA表达量升高。根据最近的报道,RNA结合蛋白(RBPs)是调节circRNA生成的活化剂或抑制剂。夸克(QKI)是一种可变剪接因子,在上皮-间充质转换(EMT)期间,受到显著调节。据报道,circRNA的形成取决于QKI蛋白的结合样式。QKI的过度表达有利于促使circRNA的形成[5]。Ashwal-Fluss等[6]证明,MBL/MBNL1可以结合第二个外显子,并确定其循环,从而竞争与规范拼接,促进循环MBL的形成,同时降低线性MBL水平。综上所述,circRNA的生物发生和涉及监管因素仍不清楚,需大量的研究来探究这些过程。
3 circRNA与胃癌
近年来,circRNA在科学界已被重新重视。越来越多的证据表明,circRNA参与各种疾病的发生和发展,如心血管疾病、神经功能障碍[7]和癌症[8-9]。此外,由于circRNA的稳定性和组织特异性,它们作为潜在的生物标志物,用于评估果蝇的衰老和检测人体中的疾病。除此之外,circRNA在癌症开始和进展过程中的作用尤为突出;在肝细胞癌[10]、乳腺癌[11]、结直肠癌[12]等癌症中已鉴定出circRNA的异常表达。circRNA可被视为癌症的可靠诊断和治疗分子生物标志物[13]。
随着高通量测序、生物芯片技术和生物信息学的发展,越来越多的circRNA在胃癌中被非传统地表达,并可能具有潜在的功能。Chen等[14]通过RNA-seq分析区分了180种不同表达的circRNA,其中82种在胃癌组织中与正常组织相比向上调节,98种向下调节。约80%的circRNA来自蛋白质编码基因。Shao等[15]报道共有308个circRNA,其中34.7%(107个)在胃癌组织中向上调节,65.3%(201个)向下调节。Dang等[16]进行了微阵列筛查分析,确认胃癌组织与非胃癌组织之间713种不同表达的circRNA,包括191个向上调节[16]和522个向下调节circRNA。Lai等[17]在5个配对胃癌组织和相邻的正常组织中揭示了204种不同表达的环热核子;其中71种circRNA向上调节,133个在胃癌组织中被降低调控。Zhang等[18]在胃癌组织中发现95个circRNA表达量上调约4倍,94个circRNA表达量降低约4倍。Fang等[19]从地球同步轨道数据库获取了胃癌组中250种不同表达的circRNA。Rong等[20]在淋巴结转移组和无淋巴结转移组胃癌样本中检测出3 443例显著改变的circRNA;GO分析表明,这些circRNA与关键的分子功能和几个生理过程有关。
与相关正常组织相比,Chen等[14]从5 500种不同表达的circRNA中发现其具有“循环PVT1”的特征。进一步调查发现,circPVT1在胃癌组织和细胞系中受到调节,由于miR-125家族的海绵作用,它是细胞增殖的促进者。circPVT1可作为胃癌中的扩散和进展因子。Zhang等[18]研究了circRNA_100269及其下游目标miRNA的相互作用和功能。他们发现,circRNA_100269和线性mRNA LPHA2在胃癌组织中降低调节,并进一步抑制细胞生长。通过生物信息学预测和实验验证,确认miR-630为circRNA_100269的直接靶点。miR-630模仿抑制circRNA_100269的功能,从而促进胃癌细胞的增殖和进展。Zhang等[21]研究表明,从LARP4的外显子9和10中产生的circRNA,在胃癌组织和细胞中降低调节;循环的过度表达导致细胞生长的抑制和侵袭。此外,circRNA LARP4可以充当miR-424的分子海绵;在胃癌细胞系Yap依赖的信号通路中,circRNA的高表达削弱了miR-424在Yap依赖信号通路的效应。此外,Zhang等[22]研究证明,从NRIP基因中衍生出的circNRIP1与胃癌侵袭淋巴及胃癌肿瘤大小相关。进一步研究证实,circNPIP1可直接与miR-149-5p发生相互作用,从而调节胃癌组织和细胞中的AKT1/mTOR通路。Ding等[23]发现,在胃癌细胞中,circRNA DONSON表达异常,敲降DONSON能够显著抑制胃癌细胞的增殖、侵袭和转移,同时促进细胞凋亡。
circRNA 0047905是促癌因子,可直接与miR-4516和miR-1227-5p结合,从而削弱miR-4516和miR-1227-5p对下游靶点MMP11和SERPINB5的抑制效应,促进肿瘤发生[24]。敲降circRNA DST可抑制胃癌细胞的增殖活力、侵袭和转移能力。在Zhang等[25-26]新研究中,他们发现circ_0067997在胃癌中充当miR-515-5p分子海绵,从而调节下游基因XIAP,促进细胞增殖和侵袭。Zhang等[27]指出,circRNA对胃癌细胞侵袭、迁移及EMT均有促进作用。在机制上,circRNA CACTIN通过充当miR-331-3p海绵和调节转化生长因子-β受体类型1表达影响胃癌进展。这些研究表明,circRNA可以吸附特定的miRNA,从而调节与胃癌细胞增殖、分化、转移相关的靶基因和信号通路。
4 circRNA的潜在临床价值
尽管多数早期胃癌患者可以通过手术治愈,但大多数患者在癌症晚期被诊断,由于缺乏可靠和有效的早期诊断技术,失去了手术治疗的最佳机会。目前内窥镜是胃癌诊断的黄金标准,但这种有创性技术对患者来说是极其痛苦的,其结果取决于医师的技能和经验。随着测序技术和生物技术的不断发展,在人类唾液、胃汁、血浆和其他人体成分中发现了与疾病有关的circRNA,有些已被用作诊断标志物[24, 28]。这些发现表明,circRNA作为一种新的生物标志物具有巨大的潜力,并为早期诊断提供了新的思路。此外,预后评价对不良预后因素的早期干预和延长患者寿命也至关重要。最近的研究表明,circRNA是胃癌诊断和预后的生物标志物,可作为诊断和预后生物标志物的circRNA如表1所示。
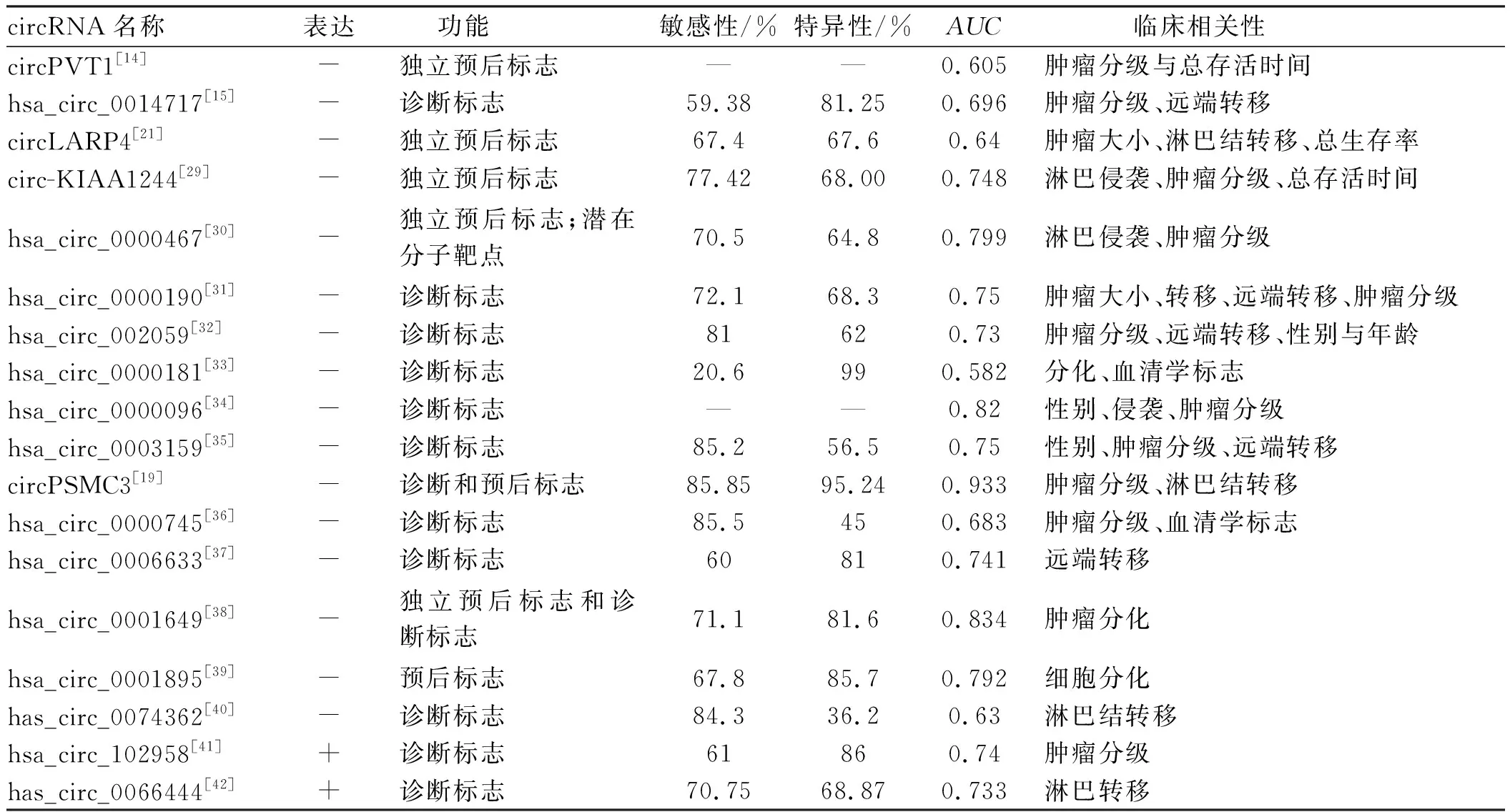
表1 circRNA作为胃癌诊断和预后的生物标志物 Tab 1 circRNA as diagnostic and prognostic markers for gastric cancer
circRNAs作为新的肿瘤标志物,是目前研究的热点。通过高能量分析技术发掘的新型肿瘤标志物的生物学功能及临床应用价值还有待于更多更大样本量的研究证实。circRNAs作为标志物受到表达丰度、组织特异性、肿瘤所处的阶段等诸多因素的影响,在探明其生物学功能的基础上,探讨其标志物应用的价值,是目前研究的主要策略。其从发现、基础研究到临床应用还需要很多研究探明。
