胃腺癌中免疫基因组表达及临床意义
2020-06-13王文生朱建儒慕之勇刘碧颖陈东风文良志
王文生,朱建儒,慕之勇,刘碧颖,王 斌,陈东风,文良志
陆军军医大学大坪医院消化科,重庆 400042
胃癌是最常见的恶性肿瘤之一,其中最常见(约95%)组织病理类型为胃腺癌(gastric adenocarcinoma,GAC)[1]。仅在2014年,我国就有超过40万新发胃癌患者,其中死亡近30万[2]。特别是在我国65岁以上老年人群中,胃癌发病率跃升至第二位,仅次于肺癌,严重威胁着人民生命健康,给社会经济造成极大的负担[3]。尽管早期胃癌的5年生存率超过90%,但大多患者发现时已处于进展期,其5年生存率不足30%[4]。目前化疗仍是晚期胃癌的主要治疗方法,近年兴起的免疫疗法呈现出较好的治疗前景[5]。尽管肿瘤细胞可以通过多种机制逃避机体免疫系统的杀伤效应[6],但目前一些研究发现,针对PD-1/PD-L1轴及腺苷信号传导通路开发的免疫靶向药物可打破肿瘤免疫逃逸,为GAC治疗带来了新希望[7-8]。
肿瘤微环境与肿瘤的生物学行为密切相关,如肿瘤浸润淋巴细胞与肿瘤预后密切相关[9]。免疫检查点抑制剂和单克隆抗体等免疫疗法可通过改变肿瘤微环境调节机体免疫功能,产生抗肿瘤免疫应答[10]。因此,肿瘤免疫状态可能对患者预后产生重要影响。然而目前肿瘤免疫在基因表达谱上异常改变及分子机制仍不明确。
本研究旨在评估GAC免疫相关基因组学异常表达在患者预后中的价值,探讨可能的调控机制及对肿瘤微环境中免疫细胞浸润的影响,为未来免疫治疗提供新的思路。
1 材料与方法
1.1 转录组数据及临床信息获取于2019年9月7日从TCGA(https://portal.gdc.cancer.gov/)下载GAC患者的全基因组转录(RNA-seq)数据,同时获取患者相应的临床信息[11]。该数据集包含了343个癌组织和30个癌旁组织的测序信息。同时,从ImmPort数据库[12]中输出了2 498个免疫相关基因。为探讨免疫基因发挥的潜在调控作用,我们从Cistrome Cancer数据库[13]提取了目前报道的在肿瘤生物学转录调控中发挥重要作用的318个转录因子(transcription factors,TFs),Cytoscape(版本3.7.2)预测转录调控网络[14]。从TIMER数据库中获取GAC患者肿瘤中免疫细胞(B细胞、CD4/CD8 T细胞、中性粒细胞、巨噬细胞和树突状细胞)的浸润情况[15]。
1.2 统计学方法通过R(version 3.5.2,https://www.r-project.org)软件进行统计分析。用R中“limma”包筛选癌与癌旁组织的差异表达基因(Wilcoxon秩和检验,FDR<0.05,log2|fold change|>1)。然后将差异表达的基因与2 498个免疫相关基因取交集即为差异表达的免疫基因。进一步采用R中“survival”包进行Cox回归分析与患者总生存期(overall survival,OS)相关的免疫基因。通过多因素Cox回归(基于赤池信息准则的逐步筛选法)构建预测预后的风险评分(risk score)模型,并绘制ROC曲线评价模型预测能力[16]。对预后模型贡献最大的四个基因进一步在Kaplan-Meier网站(https://kmplot.com/analysis/)验证[17]。t检验分析患者模型风险评分在不同临床特征之间差异,Pearson相关性检验分析患者模型风险评分与肿瘤中免疫细胞浸润丰度关系。P<0.05为差异有统计学意义。
2 结果
2.1 差异表达的免疫相关基因通过“limma”包筛选出了6 685个基因在GAC癌与癌旁组织之间存在差异表达(见图1A),其中在癌组织中表达上调和下调的基因数分别为5 479、1 206(见图1B)。既往报道的与免疫相关的2 498个基因中[12],有366个存在着差异表达(见图1C),与癌旁组织相比,170个免疫基因在癌组织中表达下调,而表达上调有196个(见图1D)。
2.2 预后相关的免疫基因为了筛选出真正影响患者预后的免疫基因,生存分析时,我们将OS<3个月患者予以剔除。首先,通过“survival”包进行单因素Cox回归筛选出了33个影响患者预后的免疫基因(见图2A)。将多因素结果进一步纳入多因素Cox回归构建风险评分模型,共纳入了12个免疫基因(见图2B),其中9个免疫基因与预后独立相关(即P<0.05)。
为进一步验证TCGA-GAC队列中生存相关的免疫基因,我们对排名靠前的2个危险因素(GLP2R、RETN;HR>1)和2个保护因素(TAP1、CTSG;HR<1)进行了外部验证。如图3所示,外部验证结果和本研究一致,即GLP2R、RETN基因为不良预后基因(见图3A~3B),其高表达提示患者OS较差;而TAP1、CTSG高表达提示患者OS较好(见图3C~3D)。
2.3 转录调控网络将从Cistrome Cancer下载的318个TFs与图1A中差异基因取交集,得到71个差异表达TFs(见图4A),其中17个表达下调,54个表达上调(见图4B)。我们进一步对预后相关的免疫基因和差异表达的TFs之间相关性进行了Pearson相关分析,筛选出相关系数>0.4,P<0.01的信息,应用Cytoscape绘制潜在的调控网络(见图5)。如图5所示,基因和TFs之间大多为正向调控关系,仅NCAPG与GLP2R、GHR,以及GHR与CENPA、EZH2之间为负向调控关系。
2.4 免疫基因预后风险模型本研究队列中每个患者的风险评分是根据表达数据乘以多变量Cox回归系数计算出来的。基于中位值将患者为高危组(High risk)和低危组(Low risk)(见图6),采用Log-rank检验对两组进行Kaplan-Meier分析,高危组OS预后明显更差(见图7A,P<0.05)。该风险模型预测患者1年生存率的ROC曲线下面积为0.703(见图7B),预测效能一般。
为进一步验证构建风险模型是否能独立预测GAC的预后,我们结合临床参数进行Cox回归分析。在本队列人群中,患者风险评分、年龄和TNM分期均是OS预后的独立危险因素(见图8,P<0.05)。
此外,我们还探讨了模型包含基因的临床意义。结果如表1所示,纳入的预后免疫基因与患者性别、TNM分期无关(P>0.05)。其中TAP1、CTSG、RETN、GLP2R在不同肿瘤分化程度中表达明显不同(P<0.05)。而患者模型风险评分仅与淋巴结转移有关(P<0.05),而与年龄、性别、分化程度、TNM分期无关(P>0.05)。

注:热图(A)和火山图(B)代表在胃癌组织和癌旁组织中差异表达基因,其中与免疫相关的基因如热图(C)和火山图(D),红点代表GAC中高表达基因,绿点代表低表达基因。


图2 单因素Cox分析显示33个免疫基因与预后相关(A),多因素Cox回归纳入12个免疫基因(B)Fig 2 Univariate Cox analysis revealed 33 immune genes associated with prognosis (A), and multivariate Cox regression was incorporated into 12 immune genes (B)

图3 Kaplan-Meier网站验证GLP2R(A)、RETN(B)、TAP1(C)、CTSG(D)的不同表达水平与预后关系Fig 3 Relationship of different expression levels with prognosis of GLP2R(A),RETN(B), TAP1(C), CTSG(D) by Kaplan-Meier
2.5 预后风险评分与肿瘤微环境免疫细胞浸润由于肿瘤微环境与患者预后及免疫状态存在明显关系[9-10],最后,我们评估了患者风险评分与肿瘤微环境中免疫细胞浸润的关系(见图9)。从图9中可以看出,患者风险评分与树突状细胞、巨噬细胞、中性粒细胞的浸润水平相关(P<0.05),但相关性差(r<0.4),而与B细胞、CD4、CD8 T细胞无相关性(P>0.05)。
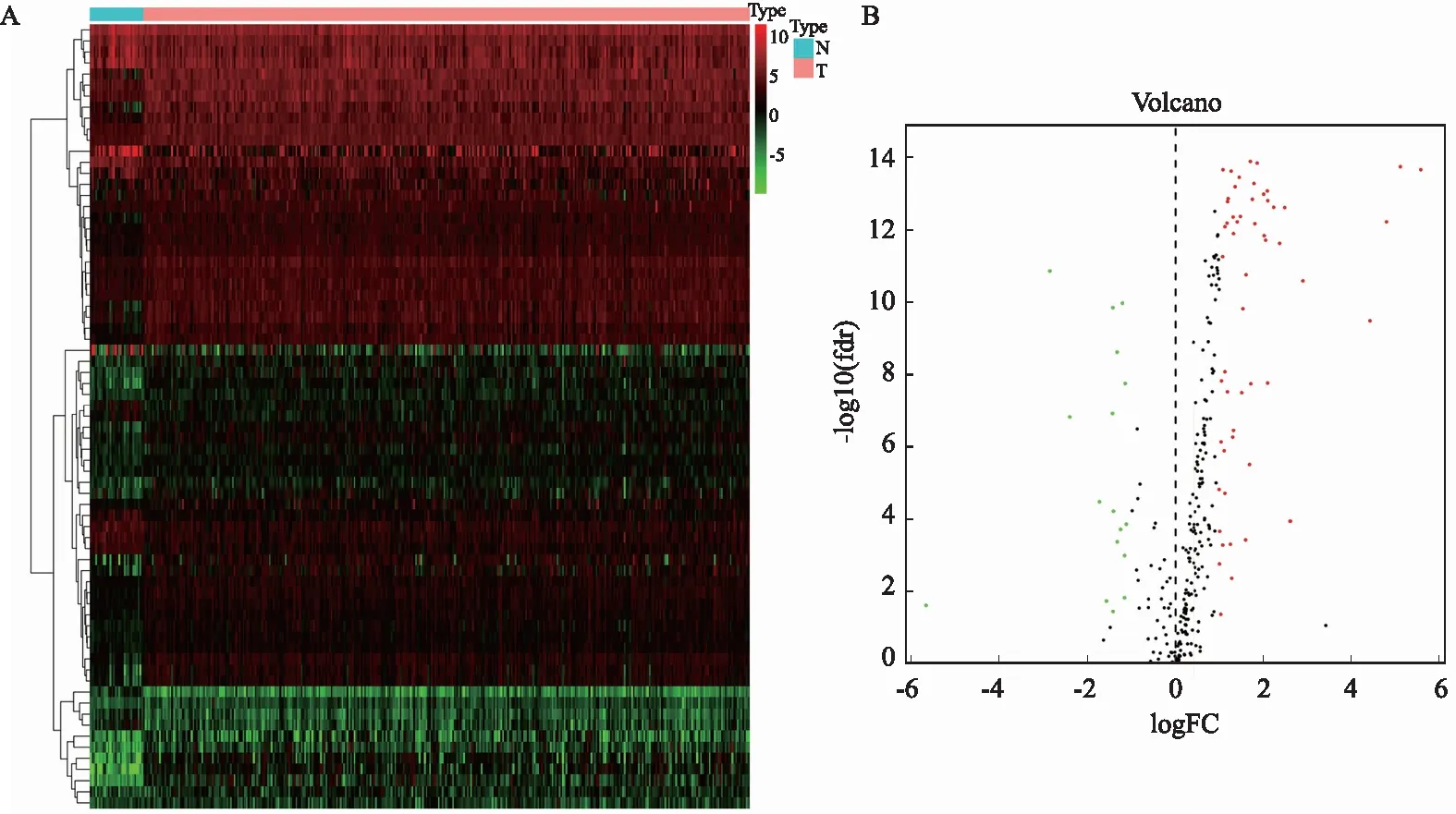
图4 差异表达的转录因子(TFs)Fig 4 Differential expression of transcription factors (TFs)

注:圆圈代表免疫基因,三角表示TFs,红线和绿线分别为正向和负向调控。
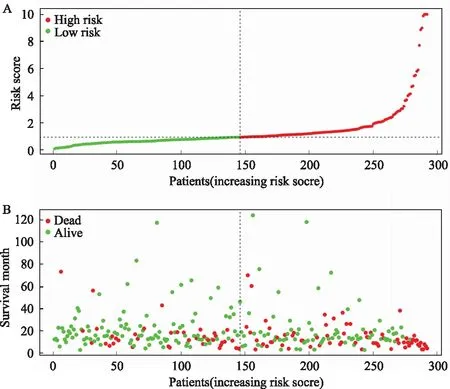
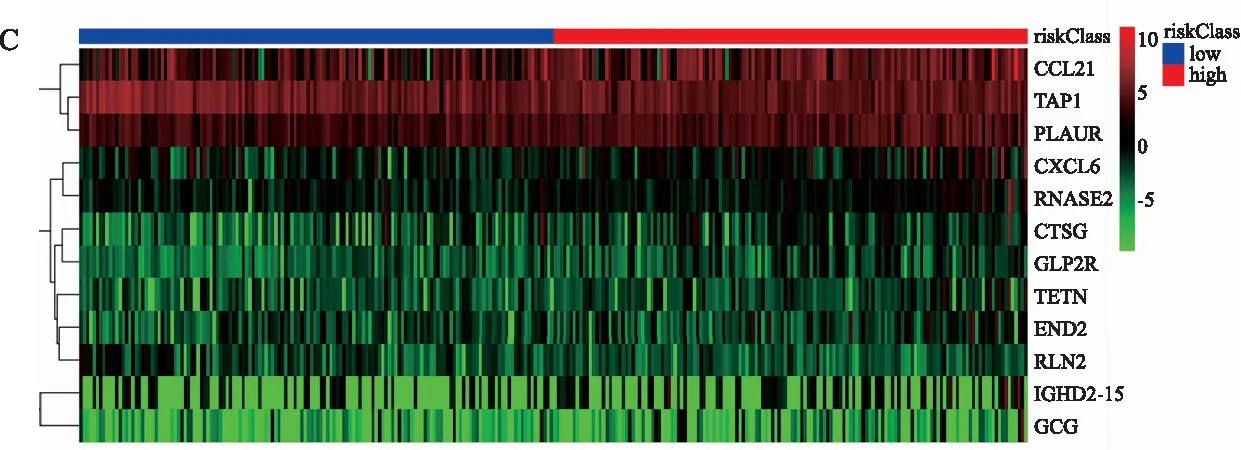
注:A:患者风险评分;B:患者随访时间及生存状态;C:患者的免疫预后基因表达情况。
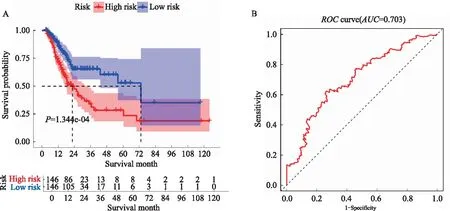
图7 不同预后风险的生存曲线(A)和预测ROC曲线(B)

注:age:年龄,gender:性别,grade:组织分化,stage:TNM分期。
表1 预后相关免疫基因及风险评分与临床特征关系
Tab 1 Relationship of prognosis-related immune genes and risk scores with clinical characteristics
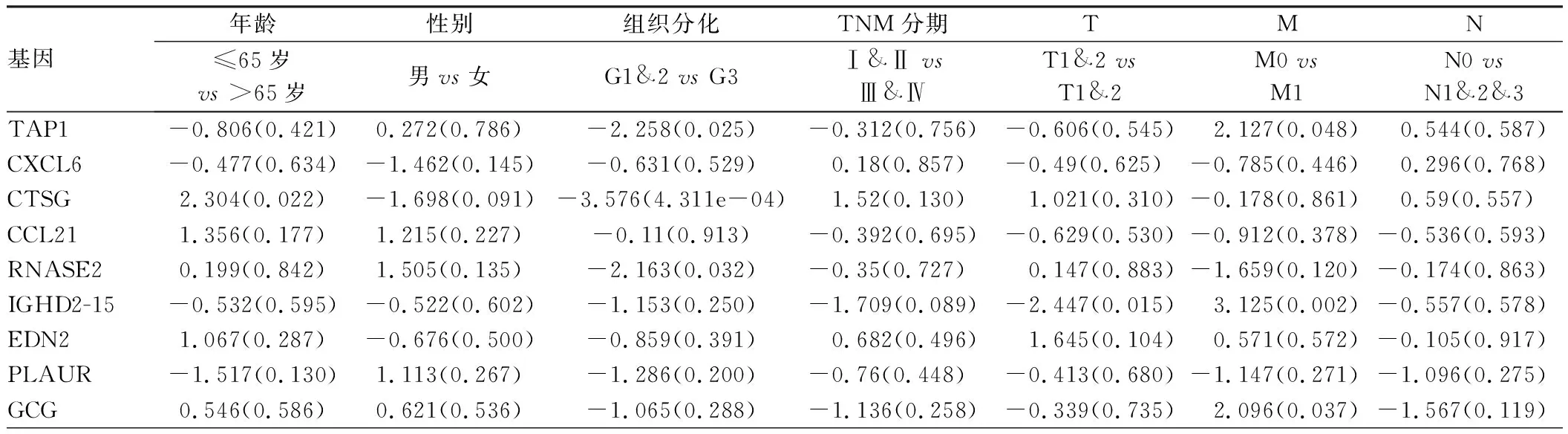
基因年龄性别组织分化TNM分期TMN≤65岁 vs >65岁男vs女G1&2 vs G3Ⅰ&Ⅱ vs Ⅲ&ⅣT1&2 vs T1&2M0 vs M1N0 vs N1&2&3TAP1-0.806(0.421)0.272(0.786)-2.258(0.025)-0.312(0.756)-0.606(0.545)2.127(0.048)0.544(0.587)CXCL6-0.477(0.634)-1.462(0.145)-0.631(0.529)0.18(0.857)-0.49(0.625)-0.785(0.446)0.296(0.768)CTSG2.304(0.022)-1.698(0.091)-3.576(4.311e-04)1.52(0.130)1.021(0.310)-0.178(0.861)0.59(0.557)CCL211.356(0.177)1.215(0.227)-0.11(0.913)-0.392(0.695)-0.629(0.530)-0.912(0.378)-0.536(0.593)RNASE20.199(0.842)1.505(0.135)-2.163(0.032)-0.35(0.727)0.147(0.883)-1.659(0.120)-0.174(0.863)IGHD2-15-0.532(0.595)-0.522(0.602)-1.153(0.250)-1.709(0.089)-2.447(0.015)3.125(0.002)-0.557(0.578)EDN21.067(0.287)-0.676(0.500)-0.859(0.391)0.682(0.496)1.645(0.104)0.571(0.572)-0.105(0.917)PLAUR-1.517(0.130)1.113(0.267)-1.286(0.200)-0.76(0.448)-0.413(0.680)-1.147(0.271)-1.096(0.275)GCG0.546(0.586)0.621(0.536)-1.065(0.288)-1.136(0.258)-0.339(0.735)2.096(0.037)-1.567(0.119)
续表1
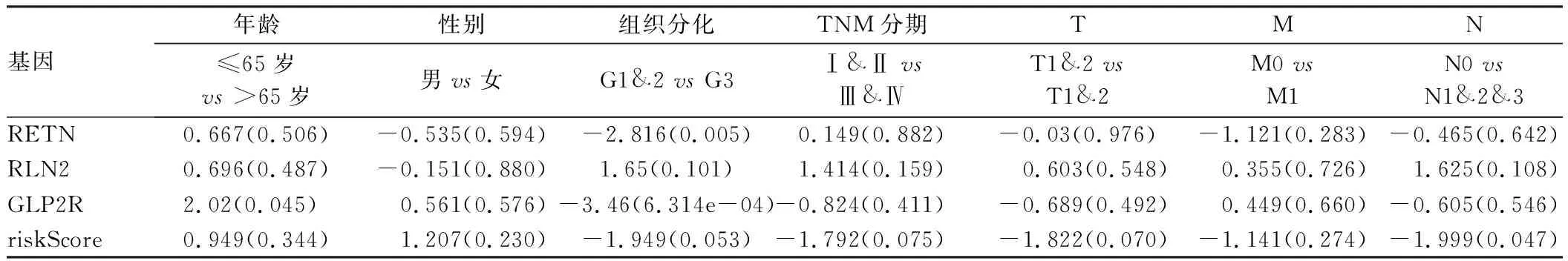
基因年龄性别组织分化TNM分期TMN≤65岁 vs >65岁男vs女G1&2 vs G3Ⅰ&Ⅱ vsⅢ&ⅣT1&2 vs T1&2M0 vs M1N0 vs N1&2&3RETN0.667(0.506)-0.535(0.594)-2.816(0.005)0.149(0.882)-0.03(0.976)-1.121(0.283)-0.465(0.642)RLN20.696(0.487)-0.151(0.880)1.65(0.101)1.414(0.159)0.603(0.548)0.355(0.726)1.625(0.108)GLP2R2.02(0.045)0.561(0.576)-3.46(6.314e-04)-0.824(0.411)-0.689(0.492)0.449(0.660)-0.605(0.546)riskScore0.949(0.344)1.207(0.230)-1.949(0.053)-1.792(0.075)-1.822(0.070)-1.141(0.274)-1.999(0.047)

图9 患者预后风险评分与肿瘤微环境免疫细胞浸润的关系Fig 9 Relationship between prognostic risk score and infiltration of tumor microenvironment immune cells
3 讨论
目前TNM分期是临床应用最广泛治疗决策和预后判断的参考依据[18]。但即使相同TNM分期的患者经过相似的治疗,其预后仍有较大的异质性,可能与复杂的分子调控网络有关[19]。免疫系统功能障碍是癌细胞逃避免疫监视的重要机制。因此,“免疫正常化”已成为免疫治疗的基本指导原则[20]。免疫疗法涉及基因、代谢、炎症和肿瘤微环境的改变,且机制复杂[21]。同时,考虑到细胞的异型化甚至癌变往往发生在炎性细胞密集浸润的微环境中[22],因此,研究肿瘤的基因组学和组织微环境变化是当前面临的新挑战[23]。
本研究利用差异表达的免疫基因构建了一个衡量肿瘤微环境免疫细胞浸润和评估可能的临床结局的风险模型。预后相关的33个免疫基因中,GLP2R、GREM1、CCL14、SLC22A17、GHR、FAM19A4在转录调控网络中处于节点位置,提示可能发挥的调控作用更为关键。GLP2R是风险模型中纳入的9个与预后独立相关的免疫基因之一。近期,有研究对大规模人群的全基因组关联分析指出GLP2R是与结直肠癌风险相关的位点之一[24]。结合本研究结果,GLP2R可能通过影响肿瘤分化程度进而使GAC进展。
另一个与GAC预后独立相关的免疫基因RETN,既往被认为是一种与炎症有关的脂肪因子,参与巨噬细胞合成和分泌促炎细胞因子TNF-α和IL-6。RETN还参与了对胃癌细胞端粒酶基因表达及加速肿瘤生长的作用,同时还是脑胶质瘤的重要预后因子[25]。我们推测RETN的表达上调,通过促进炎症、诱导端粒酶基因表达等复杂机制导致了GAC的进展及不良预后。
Ling等[26]进行的一项研究证实了TAP1下调可导致结直肠癌的免疫逃逸和不良预后。我们同样发现了TAP1的下调预示着GAC患者较差的OS,当然其中涉及到的免疫机制有待进一步深入研究。作为丝氨酸蛋白酶家族中的一员,CTSG可通过增加血管内皮细胞的通透性增强炎细胞的趋化性和浸润,与皮肌炎疾病活动度呈正相关[27]。同时,还发现CTSG与补体C4含量呈负相关,而补体C4下降与恶性肿瘤的发生密切相关,因此,研究者认为CTSG具有潜在的抗肿瘤效应[27]。既往未见CTSG与肿瘤的相关报道,而本研究基于生物信息学首次发现了CTSG是GAC预后的一个保护因子,其抗肿瘤作用机制需要深入研究论证。
基于发现的预后相关的免疫基因,我们构建了一个预测GAC预后的风险模型,尽管预测效能一般(AUC=0.703),但其能在一定程度上反映肿瘤微环境中树突状细胞、巨噬细胞、中性粒细胞的浸润情况。当然,至于这些基因影响GAC患者预后的具体机制有待更多的体内及体外试验深入论证,以期提供新的免疫治疗靶点。
