胃癌组织中FOXP1和PKD2的表达及临床意义
2020-06-13陈和萍俞力军乐湘华窦红佳
陈和萍, 俞力军, 乐湘华, 窦红佳
中国人民解放军联勤保障部队第九二八医院消化内科,海南 海口 570206
胃癌是世界上最常见的病死率较高的恶性肿瘤之一,严重威胁人类生命。我国胃癌发病率较高,随着医学手段进步,胃癌治疗水平有所提升,但整体效果仍不明显。胃癌的发病机制是胃组织正常黏膜慢性炎症、逐步萎缩、异型增生致癌变[1]。在胃癌治疗中,控制癌变细胞转移和侵袭也非常重要。因此,在研究胃癌发生、发展过程中,需重点关注可参与调控肿瘤转移、侵袭等过程的靶点。转录因子叉头盒p1(forkhead box p1,FOXP1)属于FOXP家族,是一种具有调节功能的转录因子[2]。有研究发现,FOXP1参与B淋巴细胞、肺、食管、心肌细胞等的发育,FOXP1表达异常与肿瘤发生有关[2-3]。蛋白激酶D2(protein kinase D2,PKD2)属于蛋白激酶D,在细胞增殖、迁移过程中起调控作用[4]。然而FOXP1、PKD2在胃癌中作用尚不清楚,因此本研究通过检测FOXP1和PKD2在胃癌组织中的表达,探究FOXP1、PKD2与胃癌发生、发展的关系,并分析其临床意义。
1 资料与方法
1.1 一般资料选取2013年1月至2015年12月我院收治的胃癌患者80例,男50例,女30例,年龄(52.06±16.35)岁(23~80岁)。纳入标准:(1)年龄、性别、病理类型、分化程度、淋巴结转移、侵袭深度等临床资料完整者。(2)临床诊断为胃癌者。(3)对研究内容表示知情,已签署知情同意书者。排除标准:(1)接受过胃部手术者。(2)心、肝、肾功能严重不全,严重精神疾病者。(3)不能配合本研究者。按照国际抗癌联盟与美国肿瘤联合会TNM分期系统(第8版)[5],将患者按照临床分期分类,其中Ⅰ~Ⅱ期36例,Ⅲ~Ⅳ期44例;将患者按病理分类,其中高、中分化60例,低分化20例。
1.2 主要仪器和试剂荧光定量PCR仪(CFX96 TouchTMReal-Time PCR Detection System,美国Bio-Rad公司),免疫组织化学染色试剂盒(Click-iTTMEdU Colorimetric IHC Detection Kit,货号:C10644),反转录试剂盒(Transcriptor First Strand cDNA Synthesis Kit,货号:04379012001,美国Roche公司),荧光定量PCR试剂盒(Fast Start Universal SYBR Green Master,货号:04913914001,美国Roche公司)。
1.3 实验方法
1.3.1 样本采集:免疫组化所使用的胃癌和癌旁组织均来自我院病理科的胃切除或胃活检标本。一部分提取总RNA,反转录后-20 ℃保存,用于qRT-PCR(quantitative real-time PCR),另一部分经10%甲醛溶液固定后,常规石蜡包埋,制成切片用于免疫组化染色。
1.3.2 qRT-PCR:采用Trizol法提取总RNA,取适量RNA溶液,使用反转录试剂盒得到cDNA样本,使用qRT-PCR试剂盒配制20 μl反应体系进行实验,反应程序如下:95 ℃,7 min;95 ℃,20 s;63 ℃,36 s;70 ℃,20 s;以上40个循环,一个样品重复3次。采用2-ΔΔCT法计算目的基因相对表达量。qRT-PCR引物在NCBI网站(https://www.ncbi.nlm.nih.gov/)上进行设计,内参基因GADPH及FOXP1、PKD2引物序列如表1所示。

表1 qRT-PCR引物序列Tab 1 qRT-PCR primer sequence
1.3.3 免疫组化染色:采用免疫组织化学染色法检测FOXP1、PKD2蛋白表达水平。FOXP1、PKD2抗体稀释比为1∶100,按照免疫组化染色试剂盒说明书进行操作。将标本置于4%中性甲醛溶液中,常规石蜡包埋,制作4 μm的切片,采用免疫组化染色,经过微波修复抗原,再分别加入FOXP1、PKD2抗体,4 ℃孵育过夜。复温90 min,PBS清洗后加生物素标记的二抗38 ℃环境下孵育30 min,取出后用PBS清洗3次,每次5 min。用DAB显色剂显色,10 min后冲洗进行苏木素复染1 min,进行冲洗、脱水后二甲苯固定,风干后封片。显微镜下观察,并采集图像资料。
染色结果评分标准:FOXP1、PKD2蛋白在细胞核、细胞质中呈棕黄色或棕褐色为阳性表达。按照阳性细胞百分比和染色强度给予评分。(1)阳性细胞百分比:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。(2)阳性着色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两者记分相乘为染色指数,根据染色指数分级:0分为阴性(-);1~4分为弱阳性(+);5~8分为阳性(++);9~12分为强阳性(+++)。阴性、弱阳性为低表达;阳性、强阳性为高表达。对所有胃癌患者采用复查或电话进行3年随访,随访截至2018年12月或患者死亡,观察记录此期间患者生存情况。
2 结果
2.1 胃癌组织中FOXP1、 PKD2 mRNA表达水平如表2所示,胃癌组织中FOXP1与PKD2 mRNA表达量均显著高于癌旁组织,差异有统计学意义(P<0.05)。

表2 FOXP1、PKD2 mRNA在胃癌和癌旁组织表达量
2.2 胃癌组织中FOXP1、PKD2蛋白表达水平如表3和图1所示,胃癌组织中FOXP1、PKD2蛋白高表达率显著高于癌旁组织,差异有统计学意义(P<0.05)。

表3 FOXP1、PKD2蛋白在胃癌和癌旁组织中的表达 [n(%)]Tab 3 Expressions of FOXP1, PKD2 proteins in gastric cancer and adjacent tissues [n(%)]

图1 胃癌和癌旁组织中FOXP1蛋白、PKD2蛋白的表达(放大200倍)Fig 1 Expressions of FOXP1 and PKD2 proteins in gastric cancer and adjacent tissues
2.3 胃癌组织中FOXP1、 PKD2蛋白表达与胃癌患者临床病理特征的关系如表4所示,胃癌组织中FOXP1表达与患者性别、年龄、肿瘤大小、肿瘤部位无关(P>0.05),与分化程度、浸润程度、TNM分期、淋巴结转移有关(P<0.05)。胃癌组织中PKD2表达与患者性别、年龄、肿瘤部位无关(P>0.05),与肿瘤大小、分化程度、浸润程度、TNM分期、淋巴结转移有关(P<0.05)。
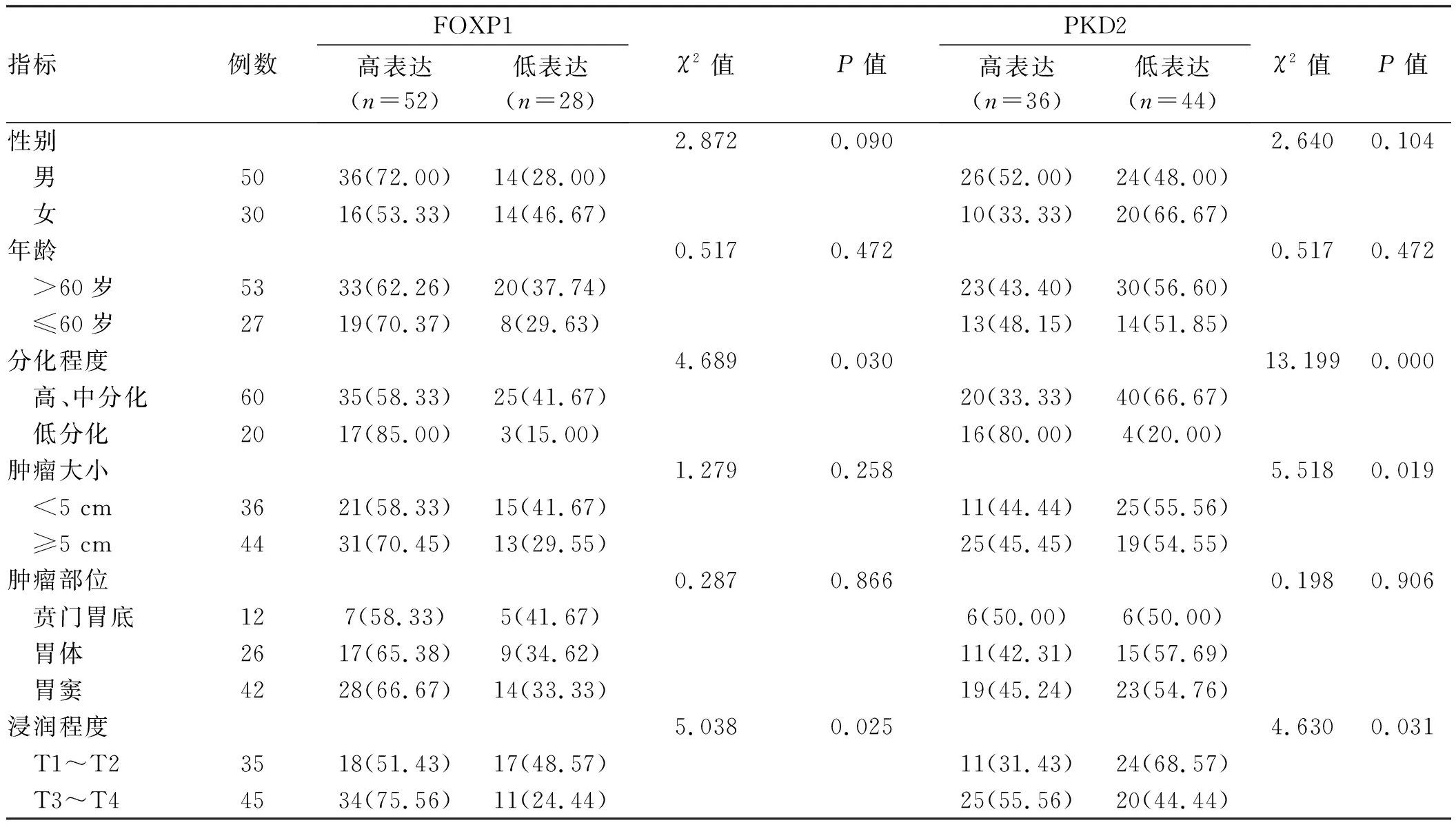
表4 FOXP1、PKD2蛋白表达与胃癌患者临床病理特征的关系 [n(%)]Tab 4 The relationship of expressions of FOXP1 and PKD2 proteins with clinicopathological characteristics of gastric cancer patients [n(%)]
续表4
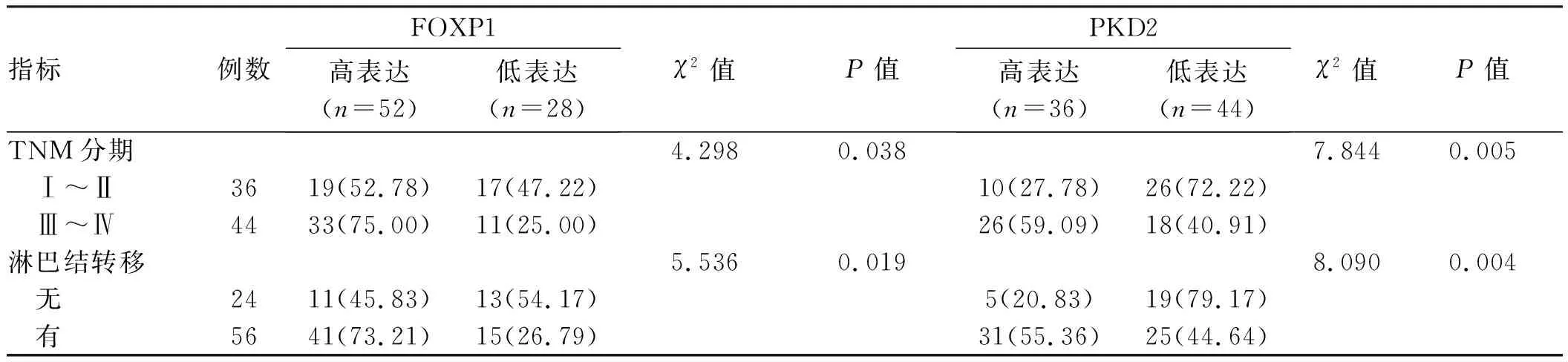
指标例数FOXP1高表达(n=52)低表达(n=28)χ2值P值PKD2高表达(n=36)低表达(n=44)χ2值P值TNM分期4.2980.0387.8440.005 Ⅰ~Ⅱ3619(52.78)17(47.22)10(27.78)26(72.22) Ⅲ~Ⅳ4433(75.00)11(25.00)26(59.09)18(40.91)淋巴结转移5.5360.0198.0900.004 无2411(45.83)13(54.17)5(20.83)19(79.17) 有5641(73.21)15(26.79)31(55.36)25(44.64)
2.4 胃癌组织中FOXP1与PKD2 mRNA表达的相关性如图2所示,FOXP1与PKD2 mRNA表达量呈正相关(r=0.563,P<0.005)。
2.5 FOXP1和PKD2表达与患者预后关系经Kaplan-Meier生存分析可知,FOXP1高表达患者3年累积生存14例,3年总生存率为26.92%;FOXP1低表达患者3年累积生存18例,3年总生存率为64.29%,两者比较,差异有统计学意义(P<0.05)。PKD2高表达患者3年累积生存9例,3年总生存率为25.00%;PKD2低表达患者3年累计生存23例,3年总生存率为52.27%,两者比较,差异有统计学意义(P<0.05)。FOXP1、PKD2高表达患者的生存率均显著低于低表达患者(P<0.05)(见图3~图4)。
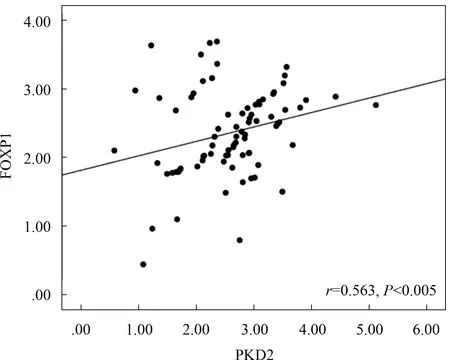
图2 FOXP1与PKD2相关性

图3 FOXP1表达与胃癌患者预后关系;图4 PKD2表达与胃癌患者预后关系
3 讨论
我国的胃癌发病率及病死率极高,另由于腹痛、胀痛等临床病症不具有特殊性,导致胃癌发现一般较晚,预后较差。胃癌发生、发展包括细胞恶性转化、克隆性增殖及局部浸润、远处转移等步骤[6]。环境中化肥、农药、食品添加剂、致癌食物、细菌等致癌因子可引发胃黏膜炎症反应,导致萎缩性胃炎发生,进一步发展为异型增生、肠上皮化生等,最终导致胃癌发生。基因层面上研究表明,致癌因子可通过诱发原癌基因和抑癌基因表达异常,驱动细胞病理性增殖、调节细胞周期、调控信号通路等,引发胃癌[7]。其中,转录因子可通过多种途径参与调控胃癌发生、发展。
转录因子是一类具有调控作用的蛋白质分子,多项研究证实,转录因子可参与癌症发生、发展调控。人T细胞转录因子4与肝癌侵袭转移有关,转录因子SOX12参与肺癌发生、发展。本研究中FOXP1是FOX家族P亚族转录因子,具有调控细胞周期、免疫反应、糖脂代谢等功能。已有大量研究表明,FOXP1表达异常与癌症发生、发展有关,参与癌症组织细胞增殖、分化。Hu等研究发现,FOXP1与雌激素受体在卵巢癌发展中起重要调控作用,上调FOXP1表达水平可抑制肿瘤扩散[8]。Cui等研究证明,miR-504通过下调FOXP1表达参与调控胶质瘤发生[9]。Song等通过相关实验发现,抑制FOXP1诱导肿瘤相关巨噬细胞分化,能抑制鼻咽癌和胃癌细胞生长[10]。本研究发现,胃癌组织中FOXP1 mRNA水平显著高于癌旁组织,且通过免疫组化染色实验发现,FOXP1蛋白在胃癌组织中高表达率显著高于癌旁组织,提示胃癌组织中FOXP1蛋白表达上调,可能与胃癌发生、发展有关。进一步研究发现,分化程度低、浸润程度深的胃癌患者FOXP1蛋白高表达率显著高于分化程度高、浸润程度浅的患者;TNM分期Ⅲ~Ⅳ期胃癌患者FOXP1蛋白高表达率显著高于Ⅰ~Ⅱ期患者;淋巴结转移胃癌患者FOXP1高表达率显著高于淋巴结未转移患者。以上结果提示FOXP1蛋白可能与胃癌的疾病进展程度有关。
PKD2是蛋白激酶D家族中一员,能够调控蛋白转运、免疫反应、细胞代谢、血管生成等。蛋白激酶D家族与肿瘤发生、发展关系密切,有大量研究已证实PKD2参与多种肿瘤发生、发展[11]。Li等研究证实,PKD2抑制剂CRT0066101可抑制膀胱癌生长[12]。Zhu等研究发现,PKD2在肝癌细胞中表达上调,并与肝癌细胞转移有关[13]。Zhou等研究表明,PKD2通过调节高尔基磷酸蛋白3(Golgi phosphphoprotein 3,GOLPH3)激活AKT促进胶质瘤细胞增殖[14]。本研究发现,胃癌组织中PKD2 mRNA水平显著高于癌旁组织,且PKD2在胃癌组织中高表达率显著高于癌旁组织,提示PKD2可能参与胃癌发生过程。进一步研究发现,肿瘤直径越大、分化程度越低、浸润程度越深、TNM分期越高的胃癌患者PKD2高表达率越高,提示PKD2蛋白表达与胃癌发生、发展及转移密切相关。
本研究进一步对FOXP1、PKD2表达与预后关系进行分析发现,FOXP1、PKD2高表达患者的生存率均显著低于低表达患者,提示FOXP1和PKD2高表达可能与胃癌患者预后不良有关。另外,胃癌组织中FOXP1与PKD2 mRNA表达量呈正相关,提示FOXP1与PKD2可能协同参与胃癌发生、发展,但两者具体作用机制尚需进一步深入研究。
综上所述,转录因子FOXP1和PKD2在胃癌患者肿瘤组织中表达量高于癌旁组织,与肿瘤大小、分化程度等病理特征参数及预后密切相关,二者可能共同参与胃癌进展,影响患者预后。但由于本研究样本量较少,且仅在表达量上分析其相关性,对二者具体相互作用机制有待进一步研究。
