人血清白蛋白的生物制备工艺优化
2020-06-12蔡燕飞
蔡燕飞, 陈 蕴, 金 坚
(江南大学 药学院, 无锡 214122)
人血清白蛋白(Human serum albumin,HSA)是人血浆中的蛋白质,其在血浆中的浓度为42 g/L,约占血浆总蛋白的60%。在体液中HSA可运输脂肪酸、胆色素、氨基酸、类固醇激素、金属离子和许多治疗分子等,同时维持血液正常的渗透压。在临床上人血清白蛋白可用于治疗休克与烧伤,用于补充因手术、意外事故或大出血所致的血液丢失,也可以作为血浆增容剂[1]。HSA具有半衰期长、生物相容性好、低免疫原性等优点,是理想的药物载体,各种基于HSA的长效蛋白质药物也到了广泛的研究和应用[2]。
国内外对于蛋白质药物分子与HSA的融合蛋白的研究已较为成熟,目前该类蛋白的主要表达系统仍然是毕赤酵母表达系统,其产物易降解的缺陷也已十分明了,其原因主要归纳为:1)甲醇对细胞活力产生影响;2)过表达外源蛋白导致分泌途径的过载;3)分泌途径中的信号肽加工酶等其他宿主蛋白酶对HSA融合蛋白的“错误加工”[3-7]。因此,解析HSA及其融合蛋白在哺乳动物细胞表达系统中的优劣意义重大。中国仓鼠卵巢细胞(Chinese hamster ovary, CHO)具有完善的翻译后修饰功能,所产生的蛋白质具有低免疫原性的优势,已成为真核表达系统中最常用的哺乳动物表达系统。据统计,目前通过CHO系统表达的与治疗有关的重组蛋白药物占生物药总量的比例已达到60%~70%,包括胰岛素、EPO、人体生长激素、抗体等等[8-11]。近年来,本研究室开展了蛋白质药物分子与HSA的融合蛋白在CHO系统中的制备及药效学评价的研究,部分研究成果显示融合蛋白在药物半衰期和稳定性方面存在很大优势,其结构解析和评价指标还有待进一步细化和研究[12-13]。同时,研究CHO系统制备的HSA单体的结构和功能,对于HSA融合蛋白的制备和应用也具有重大意义。本实验尝试通过CHO表达系统制备HSA蛋白,并与实验室前期制备的酵母表达产物进行比较,为HSA融合蛋白质药物制备及功能研究提供依据。
1 材料与方法
1.1 材料
CHO-S 细胞和pMH3 质粒由杭州安瑞普生物技术有限公司馈赠;含HSA基因的模板质粒由本实验室保存;DMEM/F12培养基和胎牛血清购自invitrogen公司;G418购自sigma公司;无血清基础培养基B001,无血清流加培养基F001,AP20激流式生物反应器均购自杭州安瑞普生物技术有限公司;酵母来源的HSA样品由本研究室前期制备[14];鼠抗人HSA(HRP)抗体购自abcam公司;尿微量白蛋白检测试剂盒购自上海名典生物科技有限公司。
1.2 方法
1.2.1 重组表达质粒pMH3-HSA的分子构建
通过引物设计,在HSA基因的N端引入Igκ信号肽,将目的基因HSA插入表达载体pMH3的多克隆位点中,重组表达质粒图谱如图1所示。
1.2.2 稳定转染CHO-S细胞
收集3×106个生长状态良好的CHO-S细胞,PBS洗涤1次,离心后用200 μL PBS重悬。配置电转反应体系:200 μL细胞悬液、20 μg质粒、10 μg鲑鱼精DNA,混匀后加入2 mm电极杯中,冰浴1 min后160 V,15 ms电击1次,冰浴1 min后再电击1次,随后冰浴1 min。在细胞培养皿中提前加入10 mL培养基(DMEM/F12,含10% FBS),将电极杯中的悬液加入培养皿中,置于培养箱中培养。
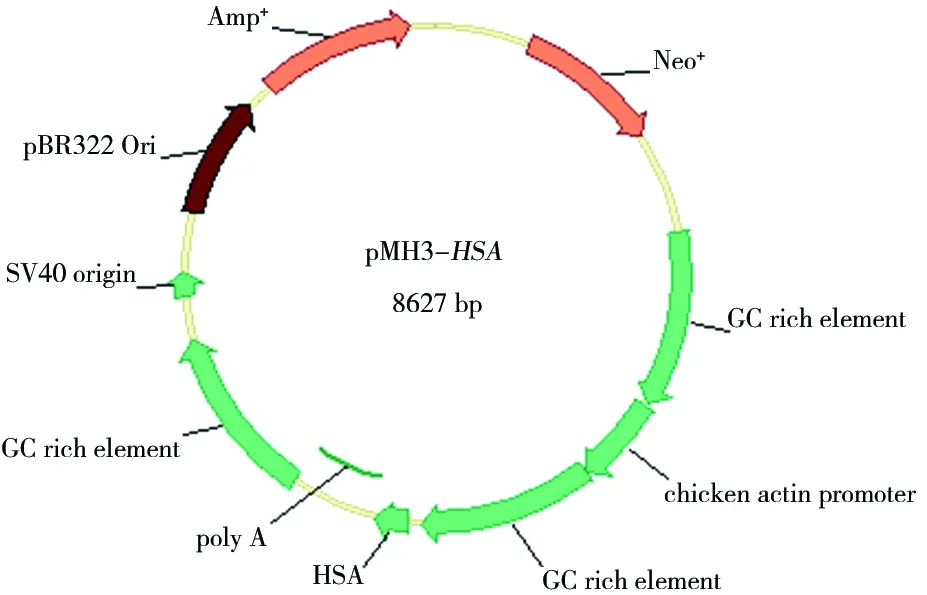
图1 重组表达质粒pMH3-HSA图谱
1.2.3 阳性单克隆筛选
电转24 h后换液,加入2.0 mg/L G418进行压力筛选,2~3 d后细胞出现大量死亡,将剩下的活细胞通过有限稀释法进行铺板,按照0.5个细胞/孔铺96孔板,共10块板,培养5~7 d,通过显微镜观察单克隆的生长情况。挑选单克隆并用胰酶消化后,接至96孔板中,隔天后孔板的细胞汇集度约70%~80%,将有血清培养基换成无血清培养基,每孔100 μL。24 h后取上清做Dot Blot检测。
Dot Blot检测方法:取上述上清液,按照每点5 μL点NC膜,37 ℃烘干,5%脱脂奶粉室温封闭1 h,TBST洗涤1次,鼠抗人HSA (HRP) 抗体室温孵育1 h,TBST洗涤3次后ECL显影。
1.2.4 悬浮驯化
根据Dot Blot结果筛选6~8个高表达阳性克隆,扩大培养至细胞培养瓶中,待细胞长满后,通过逐级降血清的方式,将有血清培养基逐步替换成无血清培养基,待替换成100%无血清培养基后,将细胞转移至摇瓶中进行悬浮培养,每天观察细胞生长状态,直至细胞大小均一,无成团现象,密度每天翻倍,活率在98%以上视为悬浮驯化成功。
1.2.5 高密度发酵
运用无血清基础培养基B001和无血清流加培养基F001,在5 L一次性细胞培养袋上,通过机械震荡传氧的方式进行高密度发酵培养(图2)。
按照以下步骤进行高密度发酵:1)电极校准,装罐。2)接种:种子培养基为无血清基础培养基B001,接种后细胞初始密度为1.0×106个/mL,总体积4 L。3)参数设定,振荡器转速:55 r/min;Do 20%~40%;pH 6.8~7.4;Tm:37 ℃。4)流加:正常情况下,至第3天细胞密度可达(6.0~8.0)×106个/mL,此时可开始流加并降温,每天流加无血清流加培养基F001,流加体积按照使糖浓度保持在3.0 g/L左右计算。温度降至34 ℃。5)取样:接种后4 h作为第0天取样样品,之后每天取样,部分样品用于细胞计数及葡萄糖浓度测定,部分样品离心取上清后冷冻备用。6)下罐:待细胞活率下降至90%时停止发酵。

a:设备图像;b:安装图片;c:参数设置系统
图2AP20激流式生物反应器
Figure 2 The torrent bioreactor of AP20
1.2.6 细胞生长曲线测定
将上罐过程中的取样样品进行细胞计数,并通过台盼蓝染色计算细胞活率,绘制细胞生长曲线。
1.2.7 目的蛋白表达情况测定
1)SDS-PAGE 检测目的蛋白表达情况。将上罐过程中的上清液样品进行SDS-PAGE,并设置酵母表达系统制备的HSA样品作为对照组,分离胶浓度为10%。
2)尿微量白蛋白检测试剂盒检测目的蛋白表达情况。尿微量白蛋白检测试剂盒原本主要用于人尿液中微量白蛋白浓度的体外定量分析,也可用于发酵样本中白蛋白的含量检测。其具体使用方法详见说明书。
3)蛋白质免疫印迹Western Blot实验检测目的蛋白表达情况。首先进行SDS-PAGE,每孔加入等体积样品,设置毕赤酵母系统表达的HSA对照。电泳结束后进行转膜,样品转至NC膜后使用5%脱脂牛奶37 ℃封闭2 h,用HSA一抗杂交,TBST漂洗3次,每次15 min,ECL显色成像。
2 结果与分析
2.1 阳性单克隆筛选
将1.2.3筛选的单克隆细胞进行表达情况检测,图3显示部分实验结果。结果显示,大部分单克隆均表达了目的蛋白HSA,挑选其中显色较深的8个克隆用于进一步筛选和表达。

图3 Dot Blot筛选阳性单克隆
2.2 发酵过程中的细胞生长情况测定
在5 L一次性培养袋的高密度发酵过程中,每天取样,计算细胞密度及活率,结果如图4所示。图4-a显示,随着发酵过程的进展,前3 d细胞处于对数生长期,也称为扩种期,第3天开始补料并降低温度后,细胞密度不再持续增长,处于相对平稳期。图4-b也表明,在10 d的发酵过程中,前9 d细胞活率均大于90%,到第10天,细胞活率下降至90%停止发酵。
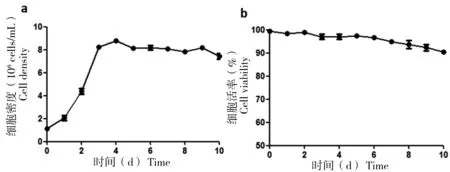
a:随着发酵过程的进展,细胞密度随时间的变化曲线;b:随着发酵过程的进展,细胞活率随时间的变化曲线
图4发酵过程中的细胞生长曲线
Figure 4 The cell growth curve during fermentation
2.3 发酵过程中目标蛋白的表达情况
2.3.1 SDS-PAGE及Elisa法检测HSA蛋白的表达情况
发酵结束后,通过SDS-PAGE检测发酵液上清样品中HSA蛋白的表达情况,并设置酵母表达系统制备的HSA样品作为对照组。与此同时,运用尿微量白蛋白检测试剂盒对表达液上清中HSA蛋白进行定量,结果如图5所示。CHO表达系统与酵母表达系统表达的HSA蛋白的蛋白质分子量保持一致,均在66 ku左右,随着CHO发酵过程的进展,目的蛋白表达量在逐渐升高,当细胞密度处于稳定期时,蛋白积累量显著升高,但进入第8天后,蛋白积累量并无显著提升,此时细胞的活率也已开始下降,表明细胞已开始逐步进入衰亡期,其产蛋白能力也开始下降。Elisa结果显示,最高表达量约为180 μg/mL。
2.3.2 Western Blot检测HSA蛋白的表达情况
为进一步检测目标蛋白的表达情况,运用Western Blot法对发酵液上清进行检测,设置酵母表达系统制备的HSA样品为对照组。实验结果(图6)显示,酵母表达系统制备的HSA有明显的降解显现,蛋白浓度为200 μg/mL的样品的降解现象最为明显。而在CHO表达系统中,目标蛋白HSA的降解问题就不太明显,Western Blot并没有检测到明显的降解条带,进一步验证了CHO 表达系统更适合表达该类生物蛋白。
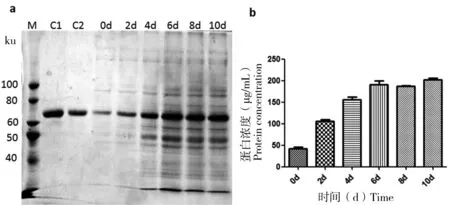
a为SDS-PAGE检测发酵液上清样品中HSA蛋白的表达情况(M:marker;C1:酵母表达的HSA对照品 200 μg/mL;C2:酵母表达的HSA对照品 100 μg/mL;0 d~10 d:第0~10天的发酵液上清样品)。b为尿微量白蛋白检测试剂盒检测发酵液上清样品中HSA蛋白的表达情况
图5发酵过程中HSA的表达情况
Figure 5 The expression level of HSA during fermentation
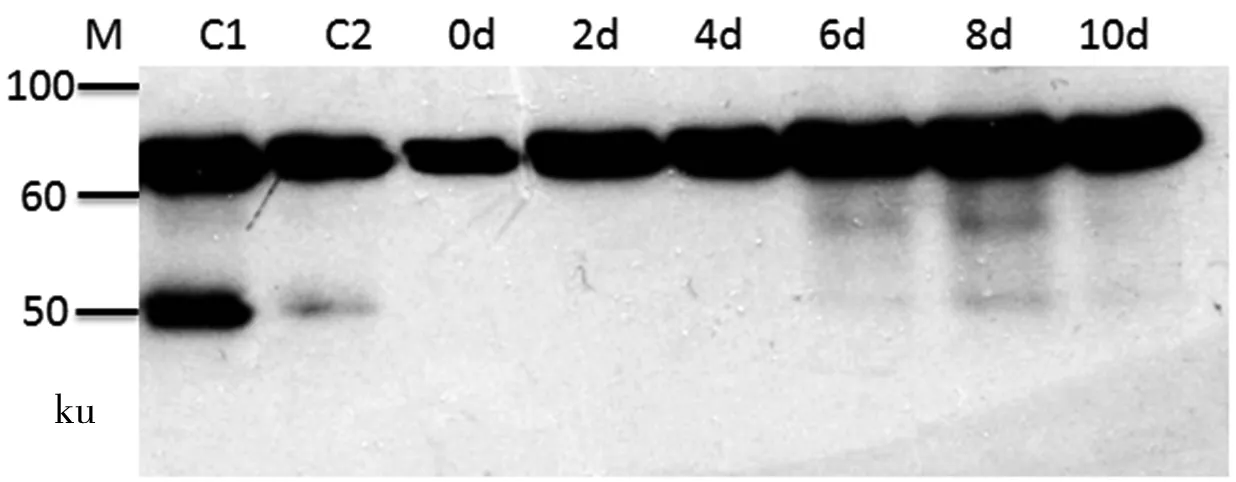
M: Marker; C1:酵母表达的HSA对照品200 μg/mL; C2: 酵母表达的HSA对照品100 μg/mL; 0 d~10 d:第0~10天的发酵液上清样品
图6WesternBlot检测发酵过程中目标蛋白的表达情况
Figure 6 The expression level of HSA during fermentation detected by Western Blot
3 讨论与结论
本研究实现了人血清白蛋白HSA在CHO系统中的表达,将CHO表达系统和毕赤酵母表达系统表达的HSA蛋白进行对比,结果表明HSA蛋白更适合在CHO系统中进行表达,其蛋白完整性优势在该系统中表现得尤为明显。因为CHO表达系统具有准确的翻译后修饰能力,其表达的糖基化蛋白质在分子结构、理化特性及生物学活性方面更接近于天然蛋白质。该实验也为后期功能性HSA融合蛋白的表达和研究提供了依据。当然,CHO表达系统也存在成本高、产量低的缺点,针对这些问题目前普遍实行的策略包括[9,15 ]:1)改造表达载体。主要包括通过定点整合的基因靶向技术和顺式作用元件增加基因的表达。2)以组学为基础的方法应用于细胞系开发的全过程。以组学为基础的方法包括转录组学、蛋白质组学和代谢组学,其应用范围包括上游的克隆筛选、细胞工程、培养条件到下游的蛋白质纯化。3)利用细胞工程技术对CHO细胞进行改造。即通过对宿主细胞的一系列改造来减少细胞的死亡率,并提高最终的蛋白产量,包括细胞凋亡抵抗、细胞自噬抵抗、细胞周期调控及翻译后修饰等。
