三氧化二砷抑制秀丽线虫生殖细胞肿瘤样增殖
2020-06-12刘天骄王顺昌
于 敏, 刘天骄, 游 牧, 王顺昌
(1. 安徽大学 学报(自然科学版)编辑部, 合肥 230039; 2. 淮南师范学院 生物工程学院, 淮南 232038; 3. 淮南师范学院 资源与环境生物技术安徽普通高校重点实验室, 淮南232038)
无机砷是公认的环境致癌剂、致畸剂和致突变剂,急性砷暴露导致恶心、呕吐、腹泻、背部疼痛甚至死亡,长期低剂量砷暴露与皮肤癌、肺癌和肝癌等癌症高发相关联[1]。但三氧化二砷(arsenic trioxide, ATO)等无机砷化合物又被长期用来治疗梅毒、牛皮癣等多种疾病;ATO已成为治疗急性早幼粒白血病(acute promyelocytic leukemia,APL)的一线临床用药[2]。无机砷化合物还具有治疗肺癌、胰腺癌、乳腺癌和肝癌等实体瘤的潜力[3]。ATO治疗APL的主要机制是下调PML-RARα融合蛋白活性,从而诱导细胞周期停滞和细胞凋亡[4]。
肿瘤抑制基因p53具有调控机体DNA损伤修复、细胞周期、细胞分化和细胞凋亡等功能,是重要的肿瘤监控基因。p53是否在ATO治疗肿瘤中发挥作用,目前还存在一定的争议。如ATO诱导的SH-SY5Y神经母细胞瘤细胞凋亡依赖于p53的作用[5];而ATO诱导的骨髓瘤细胞凋亡与p53的状态相关。产生这一现象的部分原因是约有50%的肿瘤细胞存在p53功能异常;由于细胞内同时存在p53的旁系同源(paralog)基因p63和p73,它们在p53突变的细胞仍具有促进凋亡的功能,从而干扰了对p53作用机制的评价[6]。因此,p53基因在ATO诱导的细胞凋亡中的作用尚需进一步探讨。
基于上述原因,以具有单一p53基因的模式生物为对象,可以更好地研究p53是否与ATO肿瘤治疗相关。秀丽线虫(Caenorhabditiselegans) 因结构简单、遗传可操作性强等特点,被广泛用于遗传学、发育生物学等领域的研究。近十余年来,秀丽线虫也被用来进行抗癌药物的筛选[7]。尽管秀丽线虫成体体细胞不再增殖分化,但其生殖细胞终身保持分裂分化能力,并受到保守的信号传导途径的调控。秀丽线虫cep-1是其唯一的p53基因,该基因在辐射诱导的生殖细胞凋亡中发挥重要作用[8]。秀丽线虫gld-1基因在卵子发生中发挥重要作用,秀丽线虫gld-1(q485)突变导致生殖细胞不受调控地增殖,从而导致虫体提前死亡[9]。因此,携带gld-1(q485)突变的秀丽线虫生殖腺具有肿瘤样增殖,成为研究肿瘤细胞增殖和调控的可替代模型。本文以具有单一p53样基因的秀丽线虫为对象,研究CEP-1/p53基因在ATO抑制生殖细胞肿瘤样增殖中的作用。
1 材料与方法
1.1 秀丽线虫品系与试剂
实验所使用的秀丽线虫品系包括N2 野生型、突变体gld-1(q485)、cep-1(gk138)、cep-1(lg12501) 和cep-1(w40)等;其中gld-1(q485)突变体生殖腺呈现肿瘤样增殖。所有线虫品系均来自美国明尼苏达大学国际线虫种质中心(Caenorhabditis Genetics Center, CGC)。实验所用的RNAi 菌株购自Source BioScience公司(Nottingham, UK)。对照菌L4440购自Addgene 公司(Cambridge, USA)。As2O3和IPTG为Sigma公司产品(St Louis, USA),吖啶橙(AO)和DAPI购自Molecular Probes公司(Eugene, USA)。
1.2 秀丽线虫处理
线虫的培养按照标准方法进行[10],所有品系的秀丽线虫均在20 ℃下培养,以大肠杆菌OP50为食物。为使虫体达到同步化生长,将成虫以次氯酸钠和氢氧化钠裂解,离心收集受精卵并在M9缓冲液内孵化,在不供给食物情况下,线虫停滞在L1期,当接种到含有OP50培养基上后,可以达到同步化生长[10]。将ATO以含有OP50的K-medium稀释后,加至12孔板内,每孔1 mL,并加入待处理线虫20条。
1.3 寿命测定
将同步化的早期成虫转移至含有不同剂量ATO的12孔板内,每孔20条。在体视显微镜下,每日检查死亡个体数目并转板一次。对于N2线虫,对铂金针触碰无反应者视为死亡,对于gld-1(q485)突变体,咽泵不再跳动或虫体崩解便视为死亡。
1.4 生殖细胞增殖
生殖腺增殖测定采取DAPI染色法,将处理后的线虫置于含有一滴K-medium载玻片中央,以7号注射器针头从咽部切开虫体,待生殖腺释放出来后,卡诺氏液固定,空气干燥,加入1滴2 μg/mL的DAPI溶液和1滴5%丙基没食子酸甘油溶液,指甲油封片,在荧光显微镜下进行观察统计。N2线虫只统计有丝分裂区细胞数目,而gld-1(q485)则统计自生殖腺远端开始50 μm长度的生殖细胞数目。
1.5 细胞凋亡测定
凋亡细胞测定采用AO活体染色法[11],将处理后的线虫转移至12孔板内,在含有少量OP50的M9中,以25 μg/mL的AO染色60 min,再转移至3.5 cm的NGM板上恢复60 min,以排出肠管内的染料,最后将线虫转移至含有1滴10 mmol/L NaN3的载玻片中央,在Zeiss Imager A2荧光显微镜下,凋亡细胞呈现橙黄色。
1.6 RNAi
采用喂饲携带目标基因的E.coliHT115(DE3)方式进行RNA干扰(RNA interference, RNAi)实验[12]。将携带cep-1基因的HT115菌株在含有50 μg/mL羧苄西林和1.25 μg/mL四环素的LB培养基上划线培养16 h,挑取单菌落接种于含有50 μg/mL羧苄西林的LB内,振荡培养16 h,吸取培养液200 μL铺于6 cm含有50 μg/mL羧苄西林和1 mmol/L IPTG的NGM上,室温放置诱导24 h,即为RNAi喂饲培养板,将约200条L1期线虫接种于该板内,待发育为早期成虫后,目标基因即被敲除,实验使用L4440质粒作为空白对照。
1.7 数据统计
平均寿命分析采用Mantel-Cox log rank 检验,不同剂量之间的差异采用ANOVA的Tukey多重比较或Student′st-检验。
2 结果与分析
2.1 ATO延长具致死性生殖腺肿瘤线虫的寿命
ATO暴露导致N2线虫寿命缩短,并具有显著的剂量效应(图1-A),表明ATO对N2线虫具有毒性效应。gld-1(q485)突变导致生殖腺不受控制地分裂,呈现肿瘤样增殖,导致平均寿命远短于野生型[9]。在不同剂量ATO的作用下,gld-1(q485)线虫平均寿命不仅没有缩短,反而呈现延长的趋势(图1-B)。平均寿命从对照组的(13.0±0.70) d增加至25 μmol/L时的(16.58±0.66) d,而N2的平均寿命则从(19.67±0.42) d降低至(16±0.68) d, 见图1-C,表明ATO延长了罹患生殖腺肿瘤的秀丽线虫寿命。
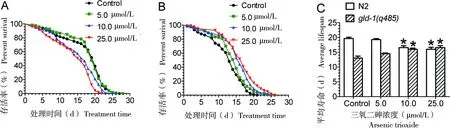
A:不同剂量ATO处理对N2线虫寿命的影响;B:不同剂量ATO处理对gld-1(q485)致死性生殖腺肿瘤线虫寿命的影响;C:N2和gld-1(q485)平均寿命的比较
图1ATO延长致死性生殖腺肿瘤的线虫寿命
Figure 1 ATO extends lifespan of worms with lethal gonad tumors
2.2 ATO抑制gld-1(q485)线虫生殖腺肿瘤样增长
携带gld-1(q485)突变的线虫生殖腺具有与肿瘤组织相似的特点,即细胞增殖不受机体的调控,gld-1(q485)线虫在正常培养条件下,由于生殖细胞过度增殖,使得虫体体腔甚至头部均充满了生殖细胞,从而导致虫体死亡,因而携带gld-1(q485)的线虫品系可以视作肿瘤模型[13]。为了研究ATO延长gld-1(q485)线虫寿命的作用机制,对ATO处理后第1天和第4天的生殖腺进行了分析。以25 μmol/L ATO处理第1天,对照组和ATO处理组具有相似比例的生殖腺过度增殖比例;伴随着处理时间的延长,对照组生殖腺过度增殖并发生破裂的比例显著增加,一些生殖细胞因过度增殖而游离出来,使得咽部受挤压而严重变形(图2-B),ATO处理降低了生殖腺过度增殖的线虫比例(P<0.05,图2-C)。这一结果显示,ATO抑制gld-1(q485)线虫生殖细胞过度增殖,延长其平均寿命。
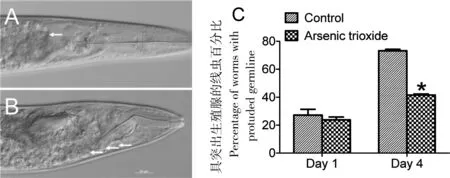
A:25 μmol/L ATO处理,DIC显微镜照片,箭头所指处生殖腺边界清晰;B:对照组,所示生殖腺边界不清晰,箭头所示游离生殖细胞挤压咽部;C:ATO处理第1天和第4天具有生殖腺肿瘤样增长的个体比例。
图2ATO抑制gld-1(q485)线虫生殖腺肿瘤样增长
Figure 2 ATO inhibited tumor-like growth of the gonad in worms ofgld-1(q485)
2.3 ATO抑制秀丽线虫生殖细胞增殖
ATO诱导细胞周期停滞,从而抑制肿瘤的生长[14]。对照组第4天N2有丝分裂区的生殖细胞数目显著降低,但gld-1(q485) 生殖细胞数目显著增加,呈现持续增长趋势;当ATO剂量达到10.0 μmol/L时,不仅N2的生殖细胞增殖受到显著抑制(图3-A),gld-1(q485)的生殖细胞增殖也受到显著抑制。与第1天相比,在10.0 μmol/L或25.0 μmol/L剂量下,第4天gld-1(q485)的生殖细胞数目并未显著增加(图3-B、C、D),这表明ATO诱导gld-1(q485)生殖细胞周期停滞,抑制其生殖腺肿瘤样增殖。为研究p53基因是否与细胞周期停滞有关,利用RNAi敲除gld-1(q485)的p53同源基因cep-1。如图3-E所示,ATO 抑制效应并不因cep-1的敲除而改变,表明CEP-1/p53途径与ATO诱导的细胞周期停滞无关。
2.4 ATO诱导gld-1(q485)生殖细胞凋亡
通常认为,gld-1(q485)突变因生殖细胞无法进行减数分裂,因而不能进入细胞凋亡程序,导致生殖细胞数量持续不受调控地增加[9]。为进一步研究ATO对gld-1(q485)生殖细胞肿瘤样增殖的抑制机制,对ATO处理后生殖细胞凋亡进行了检测。ATO不仅诱导N2细胞凋亡,同样也促进了gld-1(q485)生殖细胞凋亡,并具有显著的剂量效应(图4-A)。由于gld-1(q485)呈现运动麻痹表型,因而摄入AO染料的能力较弱。本实验针对gld-1(q485)的特点改进了染色的方法,提高了检测的灵敏度,AO阳性细胞分布于生殖腺多个区域(图4-B、C)。这一结果表明,ATO诱导的细胞凋亡抑制了gld-1(q485)生殖细胞肿瘤样增殖,延长了平均寿命。
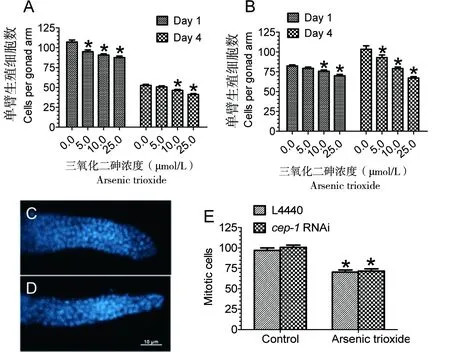
A:N2线虫生殖细胞增殖; B:gld-1(q485);C:对照组gld-1(q485)在第4天时生殖腺远端;D:25 μmol/L ATO处理第4天时gld-1(q485)的生殖腺远端;E:敲除gld-1(q485)线虫cep-1不影响ATO对生殖细胞增殖的抑制作用。
图3ATO处理对秀丽线虫有丝分裂生殖细胞增殖的影响
Figure 3 Effects of ATO treatment on the germ cell proliferation inC.elegans
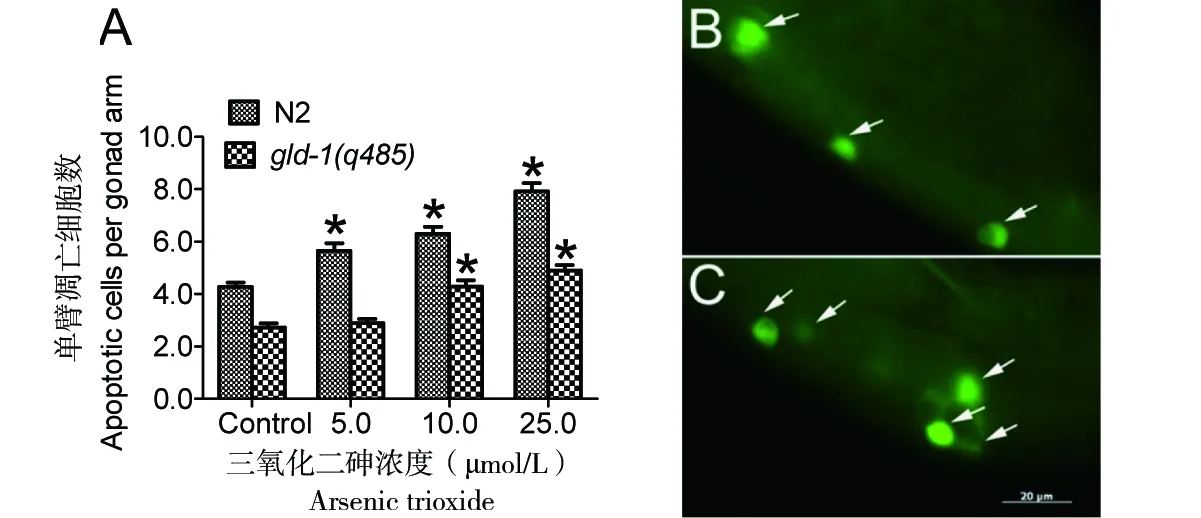
A:ATO诱导的N2和gld-1(q485)生殖细胞凋亡;B:对照状态下的gld-1(q485)凋亡细胞;C:ATO为25.0 μmol/L时gld-1(q485)的凋亡细胞。箭头所指为凋亡细胞
图4ATO诱导秀丽线虫生殖细胞凋亡
Figure 4 ATO treatment induces germline apoptosisinC.elegans
2.5 CEP-1/p53在ATO诱导的细胞凋亡中的作用
作为众所周知的肿瘤抑制基因,p53在调控细胞凋亡中发挥重要作用[8]。为研究CEP-1/p53是否与ATO诱导的细胞凋亡相关,实验测定了携带不同CEP-1/p53等位基因的线虫生殖细胞凋亡,结果发现,除cep-1(w40)品系外,cep-1(lg12501)和cep-1(gk138)在5.0和10.0 μmol/L ATO剂量下,凋亡细胞数量与对照均无显著差异,但当ATO升至25.0 μmol/L时,凋亡细胞数目较对照组显著增加,但显著低于N2;虽然cep-1(w40)具有残存的p53活性,但ATO诱导的凋亡细胞数目也显著低于N2(图5-A)。为进一步分析ATO诱导的gld-1(q485) 细胞凋亡是否依赖于CEP-1/p53,利用RNAi敲除gld-1(q485)的cep-1基因,结果表明ATO诱导的细胞凋亡数目显著降低(图5-B)。CEP-1/p53在介导ATO诱导的细胞凋亡中发挥双重效应,即在低剂量ATO暴露时诱导依赖于CEP-1/p53的细胞凋亡,而在高剂量暴露时诱发不依赖于CEP-1/p53的细胞凋亡。
对gld-1(q485)线虫进行cep-1 RNAi,并在成虫后测定ATO对生殖腺肿瘤样增殖的影响,在处理后第4天,敲除cep-1导致生殖腺肿瘤样增殖比例显著增加(图5-C)。这一结果并不能证明ATO诱导依赖于CEP-1/p53的细胞周期停滞,与对照组相比,ATO仍然可以抑制gld-1(q485);cep-1 RNAi生殖腺肿瘤样增殖(图5-C),敲除cep-1导致凋亡细胞数目减少,但gld-1(q485);cep-1 RNAi生殖细胞数目依然增加,呈现出肿瘤样增殖。
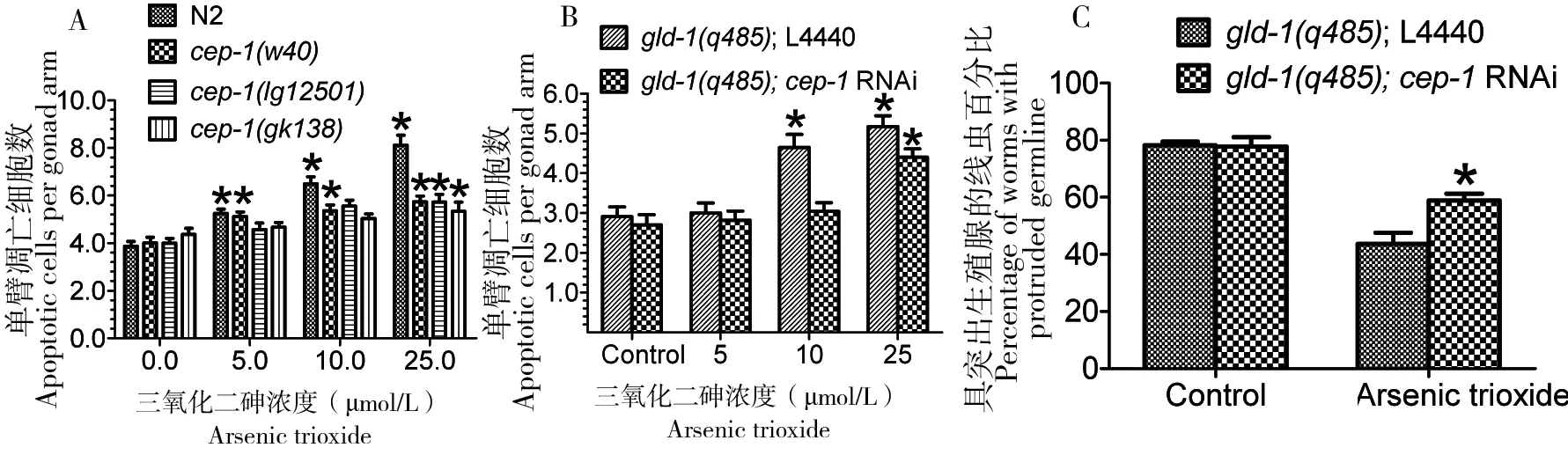
A:CEP-1/p53突变抑制ATO诱导的生殖细胞凋亡; B:敲除gld-1(q485)的cep-1基因抑制ATO诱导的细胞凋亡; C:敲除gld-1(q485)的cep-1基因增加了生殖腺肿瘤样增殖比例
图5ATO诱导的秀丽线虫生殖细胞凋亡依赖于CEP-1/p53途径
Figure 5 ATO-induced germline apoptosis is dependent on CEP-1/p53 pathway
3 讨论
秀丽线虫gld-1基因编码的蛋白与人类RNA结合蛋白QKI同源,在转录水平上调控多种机体活动[15]。gld-1突变具有多个等位基因,其中gld-1(q485)和gld-1(op236) 调节线虫生殖细胞增殖。gld-1(q485)突变因生殖细胞不受调控地增殖,只存在低水平生理性细胞凋亡,因而导致生殖腺肿瘤样增长。以该品系作为模型,人们发现胰岛素样生长因子突变可以逆转生殖细胞的肿瘤样增长,其中CEP-1/p53蛋白也发挥了重要作用[16],但化学治疗药物是否可以抑制gld-1(q485)肿瘤样增殖,目前尚不清楚。本实验结果表明,ATO延长了gld-1(q485)品系的平均寿命,抑制了生殖细胞肿瘤样增殖,其作用剂量用于哺乳动物细胞的剂量具有可比性[17]。本实验结果显示,ATO诱导生殖细胞停滞和细胞凋亡是延长gld-1(q485)突变寿命的关键。由于正常情况下,约有一半的生殖细胞以细胞凋亡的形式清除[18],因此,细胞凋亡是维持生殖腺稳态的重要机制,对gld-1(q485)突变而言,ATO诱导的生殖细胞凋亡是抑制生殖细胞肿瘤样增殖的关键原因。
秀丽线虫的细胞凋亡受到多条信号传导途径的调控,如DNA损伤细胞检查点基因HUS-1、CEP-1/p53、Caspase-3等[8,18]。由于秀丽线虫只拥有单个的p53基因,结合RNAi技术,为分析CEP-1/p53基因在ATO抑制生殖腺肿瘤样增殖机制提供了有效手段。已有的报道显示,三价砷诱导的秀丽线虫生殖细胞凋亡多发生于减数分裂区,并且受到p53、MAPK等途径调控[19]。而对于gld-1(q485)而言,ATO诱导的细胞凋亡见于生殖腺臂所有区域。由于RNAi敲除cep-1抑制了ATO诱导的生殖细胞凋亡。因此,本实验结果认为,ATO诱导的gld-1(q485) 生殖细胞凋亡依赖于CEP-1/p53,其他与DNA损伤反应有关的基因,如hus-1、ced-3、ced-4、ced-9等是否介入这一过程,尚需要进一步研究。
4 结论
本文以具有单一p53基因的秀丽线虫为对象,利用携带gld-1(q485)突变生殖腺具有肿瘤样增殖的特点,研究CEP-1/p53是否与ATO抑制的生殖细胞肿瘤样增殖有关。本研究结果表明,ATO处理延长了gld-1(q485)品系秀丽线虫平均寿命,发挥了类似于ATO治疗肿瘤的效应,其作用机制与ATO诱导的不依赖于CEP-1/p53细胞周期停滞和依赖于CEP-1/p53途径的细胞凋亡密切相关。
