类弹性蛋白展示NT-proBNP双抗原表位重组蛋白的制备和纯化
2020-06-12龚福梅杨春光胡学军
付 鑫, 龚福梅, 丁 宁, 朱 静, 杨春光, 胡学军
(大连大学医学研究中心,辽宁 大连 116622)
人体血浆中N端脑钠肽前体(N-terminal pro-brain natriuretic peptide, NT-proBNP)是检测无症状心衰和早期心衰的高灵敏性重要指标,对早期发现和治疗心衰患者、有效降低心衰患者的发病率及病死率具有重大意义[1- 2]。另外,NT-proBNP还可作为诊断无症状晚期慢性肾脏疾病[3]和慢性阻塞性肺病[4]的独立检测指标,具有广泛的临床应用和研究价值[5]。目前市场上已经有多家商品化的NT-proBNP免疫检测试剂[6-7],其校准品来源广泛,包括人工合成、大肠杆菌(Escherichiacoli,E.coli)、酵母和哺乳动物细胞表达的重组蛋白。上述几种来源的重组蛋白各有优势,但纯化重组蛋白大多数采用层析方法,且部分重组蛋白还不能直接用于检测,需增加去除融合标签这一步骤,生产方法繁琐且成本较高,成本可达0.1 mg/1 000 美元,因此成为制约其发展的主要因素。
类弹性蛋白(elastic-like polypeptide, ELP)是近十几年开发的一种融合标签,可通过可逆相变循环(inverse transition cycling, ITC)方法更简单、更经济地纯化蛋白[8]。ELP主要由五肽重复序列单元(VPGXG)n串联组成,其中客座残基X可以是除脯氨酸以外的任一种氨基酸,n代表ELP链中五肽重复次数[9-10]。外源蛋白和ELP融合后可同样保留ELP可逆相变的性质,利用温度诱导的多次ITC达到分离纯化蛋白的目的[11-12]。该方法操作简单、成本低且回收率高,适用于工业规模生产,纯化蛋白效率明显优于色谱等传统蛋白纯化方法,与层析法效果相近[13]。
本研究采用本实验室自行设计的客座残基为异亮氨酸的低相变温度(transition temperature,Tt)ELP蛋白[14]首次进行展示NT-proBNP双表位研究,在E.coli中高效表达ELP展示NT-proBNP的第13~20位和第63~71位氨基酸残基表位的重组蛋白,并通过温度诱导ITC方法,快速分离纯化具有NT-proBNP双表位抗原性的ELP重组蛋白,为低成本、高效快速地制备出NT-proBNP检测校准品奠定基础。
1 材料与方法
1.1 菌株和主要试剂E.coliBL21(DE3) 和E.coliJM109购自美国Novagen公司。基因合成全部由南京金斯瑞生物科技有限公司完成。HRP标记小鼠来源抗人NT-proBNP的第13~20位氨基酸表位的单克隆抗体(13G1213-20)、小鼠来源抗人NT-proBNP的第63~71位氨基酸表位的单克隆抗体(15C463-71)购自美国HyTest公司,硫酸卡那霉素(终浓度为50 mg·L-1)、DNase(终浓度50 mg·L-1)及HRP标记的羊抗小鼠IgG抗体购自南京生工生物工程有限公司,ECL发光试剂盒购自美国Tanon公司,TMB显色液购自美国Sigma公司。
1.2 ELP展示NT-proBNP抗原表位基因设计、合成和克隆为了获得具有抗原抗体结合能力的NT-proBNP双抗原表位融合蛋白,首先进行ELP展示单抗原表位研究,评估特异抗体与展示表位的结合能力,在此基础上进一步进行展示双表位研究。为此,分别设计了2个ELP展示NT-proBNP单个表位及1个展示双表位的融合基因。选取编码30~40个VPGIG串联碱基序列,通过编码柔链的氨基酸残基序列与编码NT-proBNP特异表位氨基酸残基序列相连,形成融合基因;为减小2个表位的相互影响,2个表位之间也通过编码柔链序列相连,基因结构和表达框见图1。所选取NT-proBNP表位分别为编码NT-proBNP的第13~20位氨基酸残基ETSGLQEQ碱基序列和编码第63~71位氨基酸残基GHRKMVLYT碱基序列。ELP与NT-proBNP表位之间的柔链氨基酸残基序列为NNNNNNNNNN,2个表位之间的柔链氨基酸残基序列为NNNNNGGGGS(其中N代表天冬氨酸残基、G代表甘氨酸残基、S代表丝氨酸残基)。根据E.coli密码子偏好性,委托南京金斯瑞生物科技有限公司合成上述3个基因,并将融合基因克隆至pET-28a(+)的NcoⅠ和XhoⅠ酶切位点上构建表达载体。3个基因分别命名为ELP-E13-20、ELP-E63-71和ELP-E(13-20)-(63-71)。
1.3 ELP展示NT-proBNP抗原表位重组蛋白表达分别将携带ELP-E13-20、ELP-E63-71和ELP-E(13-20)-(63-71)基因的表达载体转入E.coliBL21(DE3)中,37 ℃过夜培养。挑取单克隆菌株接种到含有卡那霉素(终浓度50 mg·L-1)的LB培养基中振荡培养。次日以1∶100接种到自动诱导培养基中大量培养,经28℃诱导表达24 h后留取600 nm处吸光度(A)值为1的菌量,以诱导前菌液为阴性对照进行Western blotting鉴定。自动诱导培养基配方:5%的20×NPS 20 mL,2%的50×5052 8 mL和0.1% 的1 mol·L-1MgSO20.4 mL加入ZY配置成400 mL体系培养基。其中ZY由10 g·L-1胰蛋白胨和5 g·L-1酵母提取物加入ddH2O配制而成,pH=7.2;20×NPS由0.1 mol·L-1PO42-、0.025 mol·L-1SO42-、0.05 mol·L-1NH4+、0.1 mol·L-1Na+和0.05 mol·L-1K+加入ddH2O配制而成,pH=7.4;50×5052由0.5%甘油、0.05%葡萄糖和0.2% α-乳糖加入ddH2O配制而成。
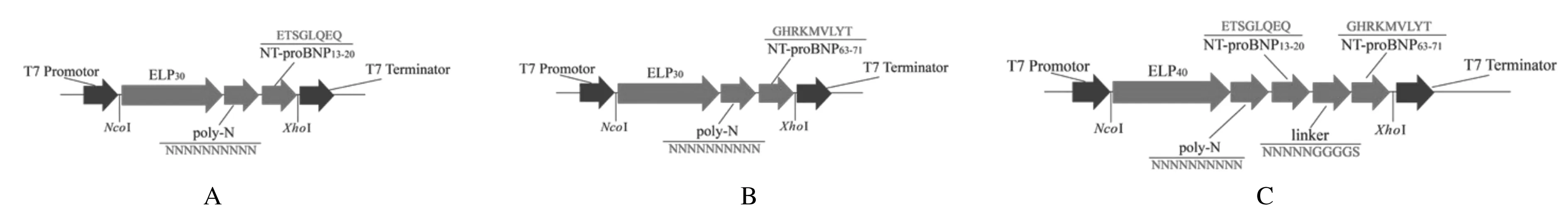
A: Diagram of ELP-E13-20 fusion gene; B: Diagram of ELP-E63-71 fusion gene; C: Diagram of ELP-E(13-20)-(63-71) fusion gene.
1.4 ELP展示NT-proBNP抗原表位重组蛋白的纯化将大量培养后的菌液低温离心收集菌体,沉淀用约25 mL无盐PBS(0.02 mol·L-1)重悬,保存于-80℃冰箱。菌液经反复冻融2次后置于冰浴中超声破碎(条件:80 W,破碎时间2 s,破碎间隔3 s,总时间20 min),10 000 r·min-1、4 ℃离心10 min,弃除沉淀,将上清移入新管中并加入DNase(终浓度50 mg·L-1),冰浴20 min,10 000 r·min-1离心10 min,弃除沉淀,上清移入新管。处理后的上清进行ITC蛋白纯化,向上清液中添加NaCl固体至终浓度为2 mol·L-1,37℃水浴20 min溶解,10 000 r·min-1于30 ℃离心10 min后弃上清;沉淀加入20 mL预冷无盐PBS重悬,冰浴20 min,10 000 r·min-1于4 ℃离心10 min后弃沉淀,再将上清移入新管。此即为一轮ITC。经过4轮ITC纯化处理后,得到纯化的NT-proBNP特异抗原表位重组蛋白。
1.5 ELP展示NT-proBNP抗原表位重组蛋白的纯度鉴定和Tt测定取80 μL纯化后蛋白样品加入20 μL 5×Loading Buffer混匀,99 ℃裂解制样并进行SDS-PAGE冰上电泳,通过凝胶显示单一蛋白条带鉴定重组蛋白纯度。采用BCA定量法测定蛋白浓度,并采用PBS(0.02 mol·L-1)将蛋白稀释至终浓度为10 μmol·L-1,取100 μL加入酶标版中,以1 ℃为梯度测定从23 ℃到40 ℃重组蛋白溶液于波长为350 nm处A值,每个温度设置3个平行结果,当A(350)值为最大A值1/2时,该温度即为ELP重组蛋白的Tt。
1.6 ELP展示NT-proBNP抗原表位重组蛋白特异性分析采用ELISA法测试重组蛋白在pH 值为7.4时与相应抗体的结合特异性,以0.02 mol·L-1无盐PBS作为空白对照孔。将纯化蛋白在PBS缓冲液中以10 μmol·L-1浓度梯度稀释,每孔设置3个平行孔,4 ℃包被于96孔板上过夜孵育。其中ELP展示单抗原表位ELP-E13-20和ELP-E63-71重组蛋白采用直接ELISA方法检测,分别对应抗NT-proBNP的13~20及63~71表位的鼠源单克隆抗体13G1213-20和15C463-71。TMB显色,终止反应后测定各孔A(450)值,以蛋白浓度为横坐标,各浓度点测定A(350)值为纵坐标,应用GraphPad Prism绘制四参数逻辑拟合曲线。
ELP展示双抗原表位ELP-E(13-20)-(63-71)重组蛋白采用2种方法检测,方法一同上述方法,分别与13G1213-20和15C463-71单克隆抗体孵育行直接ELISA检测并做拟合曲线;方法二采用双抗体夹心ELISA方法,以单克隆抗体15C463-71(抗体1∶1 000稀释,终浓度为7.0 mg·L-1)捕获抗原蛋白,单克隆抗体13G1213-20(1∶1 000稀释,终浓度为0.7 mg·L-1)为检测抗体,TMB显色,终止反应后测定各孔A(450)值,以蛋白浓度为横坐标,各浓度点测定A(450)值为纵坐标,应用GraphPad Prism绘制15C463-71和13G1213-20检测系统的log-log双对数校准曲线。
2 结 果
2.1 ELP展示NT-proBNP抗原表位重组蛋白表达将重组质粒转入E.coliBL21(DE3)宿主后,自动诱导表达24 h,以诱导前收集菌液为阴性对照,分别采用13G1213-20和15C463-712个单克隆抗体对蛋白表达情况进行Western blotting法检测的结果表明:重组蛋白ELP-E13-20、ELP-E63-71和ELP-E(13-20)-(63-71)在自动诱导条件下均获得高效表达(图2),同时证明ELP所展示的表位均能与相应抗体特异结合。3种重组蛋白的相对分子质量与理论相对分子质量相符,分别为157 00、160 00和252 00。

A: 13G1213-20antibody; B: 15C463-71antibody.M: Protein marker; Lane 1: ELP-E13-20without induction; Lane 2: ELP-E13-20with induction; Lane 3: ELP-E63-71without induction; Lane 4: ELP-E63-71with induction; Lane 5: ELP-E(13-20)-(63-71)without induction; Lane 6: ELP-E(13-20)-(63-71)with induction.
图2 Western blotting法检测NT-proBNP重组蛋白表达电泳图
Fig.2 Electrophoregram of expressions of recombinant proteins of NT-proBNP detected by Western blotting method
2.2 ELP展示NT-proBNP抗原表位重组蛋白纯化采用ITC方法将自动诱导24 h后的ELP-E13-20、ELP-E63-71和ELP-E(13-20)-(63-71)重组蛋白从菌体中分离出来。通过4次ITC纯化,SDS-PAGE电泳检测显示上述3种重组蛋白均获得纯化(图3),经BCA法检测,每升自动诱导表达培养基中可纯化2.0~2.5 mg重组蛋白。纯化条带相对于理论值的位置较低,可能是盐离子浓度对蛋白的影响导致,这也是ELP在SDS-PAGE蛋白电泳检测时的常见现象[8,15]。测定蛋白浓度为10 μmol·L-1时ELP-E13-20、ELP-E63-71和ELP-E(13-20)-(63-71)重组蛋白Tt分别为(29.7±0.5)℃、(28.5±0.25)℃和(30.8±0.2)℃。
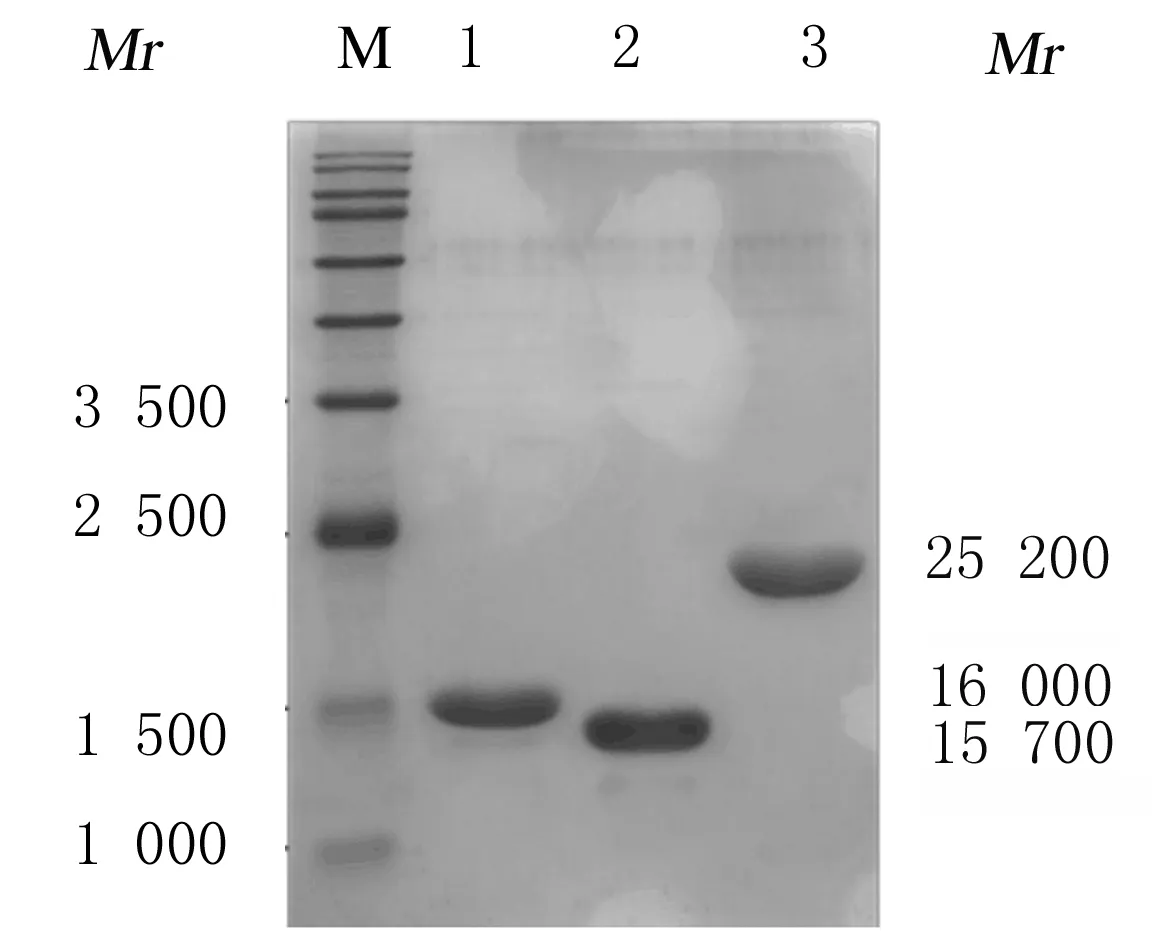
M: Protein marker; Lane 1: ELP-E13-20; Lane 2: ELP-E63-71; Lane 3: ELP-E(13-20)-(63-71).
图3 SDS-PAGE法检测纯化的NT-proBNP重组蛋白电泳图
Fig.3 Electrophoregram of purified recombinant proteins of NT-proBNP detected by SDS-PAGE method
2.3 ELP展示NT-proBNP抗原表位重组蛋白的结合能力采用直接ELISA方法分别检测13G1213-20和15C463-71抗体与ELP展示抗原表位重组蛋白的结合能力见图4。3种蛋白的参数逻辑拟合曲线显示:重组蛋白浓度与A值呈现良好的S形曲线,相关系数(R2)均在0.99以上,拟合优度高。13G1213-20和15C463-71单克隆抗体可以分别与ELP展示NT-proBNP双抗原表位重组蛋白上的表位结合,说明双抗原表位间柔链设计合理。采用夹心ELISA方法分别将15C463-71和13G1213-20单克隆抗体作为捕获抗体和检测抗体,定量检测ELP-E(13-20)-(63-71)重组蛋白样品标准曲线,见图5。双对数线性回归分析显示:ELP-E(13-20)-(63-71)与A(450)值呈双对数线性剂量依赖关系,其中相关系数(r)=0.919 7 (P<0.01),其绝对值为0.8~1.0,说明两者之间存在极强的相关关系,可信度高;R2=0.999 8,说明回归直线对观测值的拟合程度非常好。
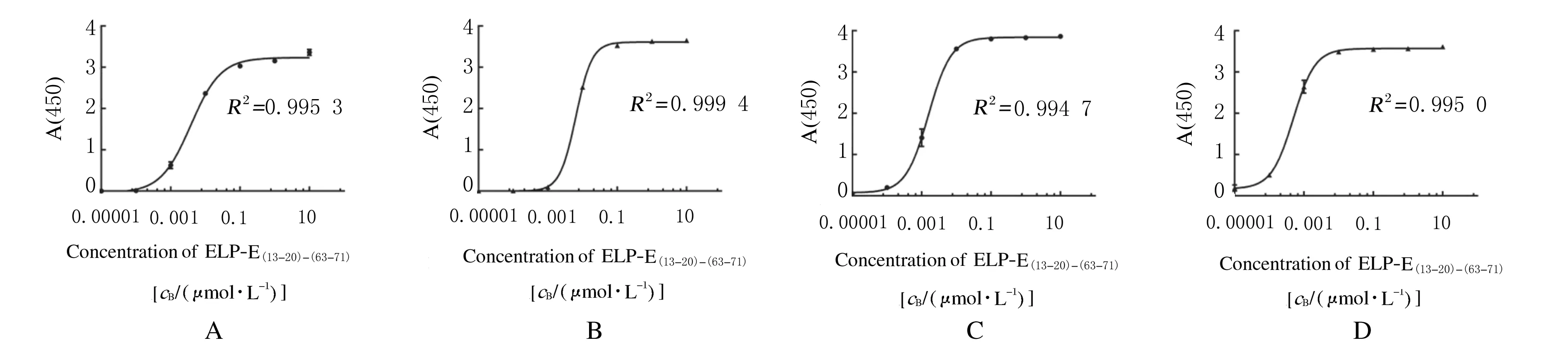
A: Immunoassay for ELP-E13-20using 13G1213-20antibody; B: Immunoassay for ELP-E63-71using 15C463-71antibody; C: Immunoassay for ELP-E(13-20)-(63-71)using 13G2213-20antibody; D: Immunoassay for ELP-E(13-20)-(63-71)using 15C463-71antibody.
图4 直接ELISA法检测13G1213-20和15C463-71抗体与ELP展示抗原表位重组蛋白的结合能力
Fig.4 Binding abilities of 13G1213-20and 15C463-71antibodies and recombinant proteins of ELP for displaying epitopes detected by direct ELISA method
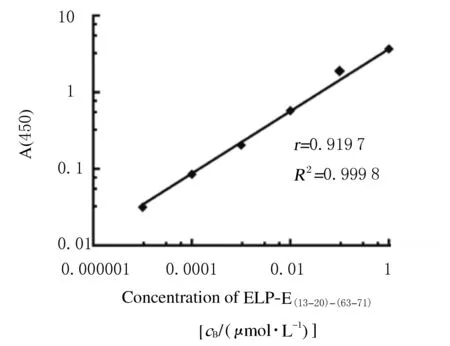
15C463-71was a capture antibody and 13G213-20was a detection antibody;r=0.919 7,P<0.01.
图5 夹心ELISA法测定ELP-E(13-20)-(63-71)重组蛋白标准曲线
Fig.5 Standard curve of recombinant protein of ELP-E(13-20)-(63-71)detected by Sandwich ELISA method
3 讨 论
本研究采用ELP展示NT-proBNP线性表位,探索了低成本、高效地制备NT-proBNP检测校准品的方法。NT-proBNP相对分子质量为8 600,属于低相对分子质量多肽,目前生产NT-proBNP的普遍策略是利用基因工程与其他蛋白融合并在E.coli中表达[16-19]。与脑钠肽融合的常用蛋白:硫氧还蛋白(Trx)、谷胱甘肽-S-转移酶(GST)[18]、Ssp dnaB微型蛋白内含子[19]和人血清白蛋白(human serum albumin,HSA)[20]等。KIM等[21]采用来自肝片吸虫的Fh8多肽作为融合标签高效生产NT-proBNP,可纯化出大量NT-proBNP重组蛋白,但是需使用蛋白酶将NT-proBNP从融合蛋白上切割下来才能进一步用作检测校准品。上述方法中大多数需利用层析法纯化蛋白,而且重组蛋白不能直接用于检测,增加了获取大量目的蛋白的生产步骤和生产成本。
本研究采用的ELP融合标签是一种通过可逆相变直接纯化的重组蛋白,其与靶蛋白融合后可以在E.coli中高效、可溶地表达,该技术是更简单、更经济的纯化蛋白方法。目前临床对NT-ProBNP的检测通常运用免疫学夹心法[22]来测定样本浓度,本课题组选择2个抗原表位与ELP融合用于夹心ELISA法检测。研究[23]表明:心衰患者血浆中NT-proBNP是O-糖基化蛋白,其中心区域第28~56位氨基酸残基部位被糖基化,所以该区域表位的抗体很难被识别。为了确保人血浆中NT-proBNP检测的准确性,HyTest公司推荐其筛选出的15C463-71-13G1213-20抗体组合作为捕获抗体-检测抗体[24],其可分别与NT-proBNP多肽的第63~71位和第13~20位氨基酸残基表位高效结合,所以本课题组最终选用以上2段多肽作为展示双表位,不受糖基化影响,适用于NT-proBNP精确检测系统。
本课题组首先对ELP展示NT-proBNP单表位的研究显示:在无需去除ELP融合标签的情况下,展示NT-proBNP部分线性表位的重组蛋白仍具有抗原性,且无论在变性条件下还是非变性条件下均能与相应特异抗体结合,进而设计ELP通过10个天冬氨酸残基(N)的柔链展示NT-proBNP双特异抗原表位,并采用NNNNNGGGGS柔链序列将双表位隔开,以减小表位之间空间位阻,充分将2个表位展示出来。夹心ELISA法测定ELP-E(13-20)-(63-71)双对数曲线显示:本课题组设计的NT-proBNP重组蛋白无需将ELP融合标签切割下来就能够同时与相应的捕获抗体和检测抗体结合,该设计也不需要融合表达全部NT-proBNP多肽序列,只选取2个表位进行表征即可作为检测校准品。
综上所述,选取ELP标签作为融合蛋白展示NT-proBNP特异抗原表位提供了一种低成本、纯化携带多个特异抗原表位的方法,为生产其他多肽抗原检测校准品提供了思路。
