双硫仑联合顺铂对三阴性乳腺癌MDA-MB-231细胞的增殖抑制作用及其机制
2020-06-12文庆一焦苗苗彭敬予董凤歌
文庆一,焦苗苗,谢 潇,彭敬予,董凤歌,魏 雪,杨 明
(吉林大学第一医院乳腺外科,吉林 长春 130021)
2005年由BRENTON等[1]首次提出三阴性乳腺癌(triple-negative breast cancer,TNBC)的概念,TNBC是指一组不表达雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和表皮生长因子受体(human epidermal growth factor,HER2)的复杂乳腺癌亚型,TNBC患者发病年龄较轻,且恶性程度高,侵袭性强,病情进展比较迅速,容易出现局部复发和远处转移,患者总体生存期短。TNBC患者常伴发乳腺癌易感基因1(breast cancer susceptibility gene-1, BRCA-1)突变,当BRCA-1基因发生突变时失去了断裂DNA双链的修复功能[2-4]。在疾病的早期和晚期,化疗是TNBC患者的主要全身治疗方法。目前临床TNBC的药物治疗主要以紫衫类和蒽环类联合化疗为主,铂类是除紫衫及蒽环类外的重要选择[5]。顺铂(cis- diamineichloroplain,CDDP)等铂类药物可与DNA双链发生交联,致使DNA双链断裂,无法完成DNA复制和转录,最终导致细胞死亡[6]。临床研究[7]的初步结果也证实:CDDP单药新辅助治疗TNBC有效,可明显提高病理完全缓解(pathological complete response,PCR)率。但是,CDDP靶向肿瘤细胞的能力差、体内代谢时间短,虽能杀死肿瘤细胞,但同样对正常细胞的功能也造成了严重损害。TNBC患者缺乏靶向疗法,这促使科研工作者努力探索可治疗的分子靶标以治疗TNBC患者[8]。双硫仑(disulfiram, DSF)能通过抑制乙醛脱氢酶阻断酒精氧化代谢,在临床上应用于戒酒治疗达60年。近些年,DSF被证实具有抗肿瘤潜能[9-13],说明DSF可作为治疗TNBC的潜力药物,可单独或与其他一线或二线化疗药物联合应用。然而,目前尚无研究表明同时使用CDDP和DSF具有抗肿瘤作用。
本研究旨在通过体外实验评估CDDP与DSF联合应用对MDA-MB-231细胞增殖的作用,并分析其可能的分子机制,为未来临床转化应用提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器TNBC MDA-MB-231细胞购于上海博古生物科技有限公司。CDDP购于中国科学院长春应用化学研究所,DSF、四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)噻唑蓝和二甲基亚砜(dimethyl sulphoxide,DMSO)购于美国Sigma公司,DMEM干粉、青霉素、链霉素、0.25%胰蛋白酶消化液和0.25%EDTA-胰蛋白酶购于美国Gibco公司,胎牛血清(fetal bovine serum,FBS)购于美国Clark公司,AnnexinⅤ-FITC/PI试剂盒和DCFH-DA购于美国KeyGEN公司。Matrigel基质胶和流式细胞仪购于美国BD公司,CO2培养箱和高速离心机购于美国Thermo公司,倒置显微镜购于日本Nikon公司,酶标仪购于美国 BioYek公司。
1.2 MDA-MB-231细胞培养将MDA-MB-231细胞培养于含有10%FBS、100 U·mL-1青霉素和100 U·mL-1链霉素的DMEM培养液中。置于37℃、5%CO2培养箱中常规培养,传代3代以上并取呈对数生长期的细胞用于后续实验。
1.3 MTT法检测各组MDA-MB-231细胞存活率取呈对数期生长的MDA-MB-231细胞并调整细胞密度,细胞密度调至8 000个/孔后快速铺板,每孔200 μL接种于96孔板。设定CDDP终浓度为200 μmol·L-1,同时将60 μmol·L-1CDDP分别与1、2和4 μmol·L-1DSF联合应用,细胞分为60 μmol·L-1CDDP组、联合1组(60 μmol·L-1CDDP+1 μmol·L-1DSF)、联合2组(60 μmol·L-1CDDP+2 μmol·L-1DSF)和联合3组(60 μmol·L-1CDDP+4 μmol·L-1DSF)。置于5% CO2、37℃条件下孵育24 h,3倍稀释至6个浓度,每组设置4个复孔,分别培养72 h,倒置显微镜下观察。72 h后,每孔加入20 μL MTT(5 g·L-1,即质量分数为0.5% MTT)溶液,继续置于培养箱中培养4 h。终止培养,小心吸干净含MTT的孔内培养液。每孔加入150 μL DMSO,置入酶标仪中振荡5 min,使结晶物充分溶解。采用酶联免疫检测仪测量各孔在波长为490 nm处的吸光度(A)值,计算MDA-MB-231细胞存活率。细胞存活率 =(样品A值/对照品A值)× 100%。实验重复3次。以药物浓度的对数作为横坐标,细胞存活率作为纵轴应用 Orgin 9.2 软件绘制细胞生长抑制效应曲线。
1.4 流式细胞术检测各组MDA-MB-231细胞凋亡率采用0.25% EDTA-胰蛋白酶消化呈对数生长的贴壁细胞,制成均匀细胞悬液,显微镜下计数,以2.5×105个/孔接种于6孔板。24 h 培养后,分别加入浓度为160 μmol·L-1CDDP后继续于5% CO2、37℃条件下培养24、48和72 h。吸弃孔内培养液,采用2 mL 磷酸盐缓冲液(phosphate buffer solution,PBS)清洗1次。采用0.5 mL 0.5% 胰蛋白酶消化细胞,将MDA-MB-231细胞分为空白对照组、2 μmol·L-1DSF组、60 μmol·L-1CDDP组和联合组(60 μmol·L-1CDDP+2 μmol·L-1DSF)。以0.5 mL DMEM 培养液中和,移入1.5 mL EP管中,2 000 r·min-1离心5 min,吸弃上清液,再用 PBS洗涤细胞2次(2 000 r·min-1离心5 min)收集细胞。加入500 μL Binding Buffer悬浮细胞,加入5 μL Annexin Ⅴ-FITC混匀后,加入5 μL PI,混匀,室温避光反应15 min。1 h内进行流式细胞术检测。结果判定标准:AnnexinⅤ-FITC(-)PI(-)为活细胞,AnnexinⅤ-FITC(+)PI(-)为早期凋亡细胞,AnnexinⅤ-FITC(+)PI(+)为中晚期凋亡细胞,AnnexinⅤ-FITC(-)PI(+)为死亡细胞,计算各组MDA-MB-231细胞凋亡率。细胞凋亡率 =(早期凋亡细胞数+中晚期凋亡细胞和死亡细胞数)/细胞总数×100%。
1.5 流式细胞术检测各组MDA-MB-231细胞中活性氧(reactive oxygen species,ROS)水平采用0.25% EDTA-胰蛋白酶消化呈对数生长的贴壁细胞,制成均匀细胞悬液,显微镜下细胞板计数,以5×104个/孔接种于12孔板,培养24 h。分为空白对照组、2 μmol·L-1DSF组、60 μmol·L-1CDDP组、联合组(60 μmol·L-1CDDP+2 μmol·L-1DSF),置于5% CO2、37℃条件下培养3 h。3 h后,吸弃培养液,采用PBS清洗3次,以1 mL PBS定容。配制10 mmol·L-1DCFH-DA储备液(4.87 g·L-1,以DMSO溶解),调至终浓度为5 μmol·L-1,每孔加入 2 μL DCFH-DA,充分摇匀。37℃培养20 min,弃去孔内液体,以PBS洗涤3次。每孔加入1 mL PBS后置于荧光显微镜下迅速观察并拍照,吸弃PBS,采用0.25%EDTA-胰蛋白酶消化液处理细胞后收集,采用流式细胞术检测各组MDA-MB-231细胞中ROS水平。采用Origin 9.2软件绘图并分析ROS水平变化。
1.6 电感耦合等离子体质谱仪(inductively coupled plasma-mass spectrometry,ICP-MS)检测各组MDA-MB-231细胞中铂(Pt)水平采用0.25% EDTA-胰蛋白酶消化呈对数生长的贴壁细胞,制成均匀细胞悬液,显微镜下细胞板计数,以每个培养皿4.0×105个细胞接种于50 mm培养皿,培养24 h。实验分为空白对照组、20 μmol·L-1CDDP组、联合组(20 μmol·L-1CDDP+0.625 μmol·L-1DSF),每组设置3个平行样,加入各组药物后置于5% CO2、37℃条件下作用4和24 h ,吸弃皿内液体,采用PBS洗涤3次。采用0.6 mL 0.25% EDTA-胰蛋白酶消化液消化细胞,1 000 r·min-1离心5 min,以2 mL PBS重悬细胞后制成细胞悬液,移入5 mL EP管中,倒置显微镜下进行细胞计数。5 mL EP管中加入硝酸(体积分数为68%),在70℃条件下煮12 h。采用ICP-MS检测各组MDA-MB-231细胞中Pt水平。
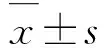
2 结 果
2.1 各组MDA-MB-231细胞存活率以不同浓度DSF联合CDDP作用于MDA-MB-231细胞72 h后可见:CDDP浓度一定的情况下,DSF浓度越大,细胞存活率越低。与60 μmol·L-1CDDP组比较,联合1组、联合2组和联合3组MDA-MB-231细胞存活率降低(P<0.05)。在72 h时,小分子药物CDDP以及按60∶1、60∶2、60∶4配比与DSF联合应用的最小抑制浓度(IC50)分别为32.012、29.107、26.258 和16.901 μmol·L-1。加入DSF后,IC50随着DSF浓度的增加而减小。在达到细胞相同抑制效果时,CDDP浓度随着DSF浓度的增加而降低。72 h后各组MDA-MB-231细胞的生长抑制效应曲线见图1。

图1 作用72 h后各组MDA-MB-231细胞生长抑制效应曲线
Fig.1 Growth inhibition effect curves of MDA-MB-231 cells in various groups after treated for 72 h
2.2 各组MDA-MB-231细胞凋亡率相同浓度CDDP(当量)作用于MDA-MB-231细胞后,时间越长,凋亡细胞数越多。CDDP 作用于细胞24 h后,发生明显的细胞凋亡,作用72 h后MDA-MB-231细胞凋亡率为92.4%。CDDP对MDA-MB-231细胞的抑制作用呈剂量和时间依赖性。见图2。
作用24 h后,各组MDA-MB-231细胞均有凋亡发生。与60 μmol·L-1CDDP组和2 μmol·L-1DSF组比较,联合组(60 μmol·L-1CDDP+2 μmol·L-1DSF)MDA-MB-231细胞凋亡率升高(P<0.05)。见图3。

1:Blank control group;2-4: 60 μmol·L-1CDDP group(24,48,and 72 h).*P<0.05,**P<0.01vsblank control group.
图2 60 μmol·L-1CDDP作用MDA-MB-231细胞24、48 和72 h后细胞凋亡率
Fig.2 Apoptotic rates of MDA-MB-231 cells after treated with 60 μmol·L-1CDDP for 24, 48 and 72 h

1:Control group;2: 60 μmol·L-1CDDP group; 3: 2 μmol·L-1DSF group;4:Combination group (60 μmol·L-1CDDP+2 μmol·L-1DSF).*P<0.05vscontrol group.
图3 作用24 h后各组MDA-MB-231细胞凋亡率
Fig.3 Apoptotic rates of MDA-MB-231 cells in various groups after treated for 24 h
2.3 各组MDA-MB-231细胞中ROS水平DCFH-DA荧光染色后,与空白对照组比较,其他各组MDA-MB-231细胞中均可见DCF绿色荧光,即DSF、CDDP单独及联合应用均可明显引起MDA-MB-231细胞中ROS水平升高。作用3 h后联合组(60 μmol·L-1CDDP+2 μmol·L-1DSF)MDA-MB-231细胞中ROS水平高于2 μmol·L-1DSF组和60 μmol·L-1CDDP组,约为空白对照组MDA-MB-231细胞中ROS水平的10倍(P<0.05或P<0.01)。见图4。
2.4 各组MDA-MB-231细胞中Pt水平作用4 h后,20 μmol·L-1CDDP组MDA-MB-231细胞中Pt水平为(9.760±0.875) ng/106个细胞,联合组(20 μmol·L-1CDDP+0.625 μmol·L-1DSF)MDA-MB-231细胞中Pt水平为(9.374±1.125) ng/106细胞,二者比较差异无统计学意义(P>0.05)。作用24 h后,20 μmol·L-1CDDP组MDA-MB-231细胞中Pt水平为(22.062±1.229)ng/106个细胞,联合组(20 μmol·L-1CDDP+0.625 μmol·L-1DSF)MDA-MB-231细胞中Pt水平为(28.607±1.380)ng/106个细胞,二者比较差异有统计学意义(P<0.01)。

1:Blank control group;2:2 μmol·L-1DSF group;3:60 μmol·L-1CDDP group;4:Combination group(60 μmol·L-1CDDP+2 μmol·L-1DSF).*P<0.05,**P<0.01vsblank control group.
图4 流式细胞术检测各组MDA-MB-231细胞中ROS水平
Fig.4 Levels of ROS in MDA-MB-231 cells in various groups detected by flow cytometry
3 讨 论
作为一种特殊的乳腺癌亚型,TNBC具有特殊的生物学行为和临床病理特征。TNBC患者的全身治疗仍以化疗为主。目前,美国食品药品监督管理局(Food and Drug Administration, FDA)尚未批准任何专门针对TNBC的药物。多年以来,研究主要集中在化疗药物的选择上,如蒽环类药、紫衫类药和铂类药物等。近些年的临床前研究和临床研究[14-16]已经证实:乳腺癌易感基因(BRCA)相关性乳腺癌对紫衫醇和多西他赛存在耐药现象,而对CDDP比较敏感,尤其是对于BRCA-1突变的TNBC患者,PCR率可高达72%~90%[17-18],但仍需要大样本随机对照研究进一步评估CDDP单药及其与铂类联合化疗新辅助治疗TNBC的疗效。关于CDDP治疗TNBC尚存在大量问题,首先是其严重的不良反应,恶心、呕吐和累积性及剂量相关性肾损伤是CDDP的主要限制性毒性。研究[18-19]证实:CDDP只对存在BRCA-1突变的TNBC有效,而存在BRCA-1突变的患者只约占TNBC患者20%[20],因此CDDP尚未被批准用于TNBC的一线治疗。
寻找能增强TNBC细胞对传统化疗药物的化疗敏感性、降低化疗药物的用药剂量、减轻正常机体遭受损害的安全无毒药物是研究人员探索的新方向。DSF作为经FDA批准的安全戒酒药物,应用于临床已有60余年。研究者[21]发现:该药物还具有抗白内障和抗肿瘤的作用,临床试验已证实DSF安全无毒。DSF不仅能有效杀伤包括乳腺癌在内的多种肿瘤细胞,而且对TNBC细胞有极强的杀伤作用且对传统化疗药物具有增敏作用。ROBINSON等[22]发现:DSF能有效抑制包括MDA-MB-231在内的多种TNBC细胞系的生长,半数抑制浓度(IC50)为300 nmol·L-1。ROBINSON等[22]研究显示:DSF能与阿霉素、紫杉醇和吉西他滨等产生协同效应。
LIU等[23]对具有乳腺癌干细胞特性的耐药TNBC细胞系MDA-MB-231PAC10进行了细胞毒性实验及相关耐药性研究发现:MDA-MB-231PAC10对DSF非常敏感,暴露于DSF仅4 h便完全失去了成球囊能力,作用24 h后可检测到大量凋亡细胞,而对紫杉醇、多西他赛、阿霉素和CDDP均表现出极强的抗药性。
本研究结果显示:不同浓度DSF辅助CDDP作用于MDA-MB-231细胞72 h后,在达到细胞相同抑制效果时,CDDP浓度会随DSF浓度的增加而降低。与其他研究不同点:本研究所采用的DSF浓度相对较低,以DSF∶CDDP摩尔比为4∶60的比例即可产生明显的抑制效应。微量DSF能有效地辅助CDDP抑制MDA-MB-231细胞的增殖,在达到相同抑制效果的情况下,DSF的添加大大降低了CDDP的应用浓度,从而降低了CDDP对机体产生的毒性。
目前虽证实DSF能增强传统化疗药物的敏感性,但是其具体机制尚不清楚。很多研究[24-26]已经证实:高水平ROS能够破坏细胞的DNA和磷脂等结构,并诱导细胞凋亡及坏死。与正常细胞比较,癌细胞本身便存在较高水平ROS[27-28]。诱导癌细胞产生更多的ROS,使肿瘤细胞比正常细胞提早达到并超过ROS耐受阈值,最终导致癌细胞的选择性凋亡,也是肿瘤治疗方向之一。以往有研究[29]显示:DSF-Cu可能是通过刺激ROS的产生诱导凋亡效应。本研究结果显示:荧光显微镜下,DSF和CDDP以摩尔比2∶60联合应用作用于MDA-MB-231细胞3 h后产生的ROS荧光强度大于CDDP单独应用,流式细胞术检测结果也验证了该结论,由此证明:与单独应用CDDP比较,相对微量DSF与CDDP联合应用能明显增加细胞中ROS水平,并诱导细胞凋亡。
综上所述,小分子CDDP利用其扩散作用可以快速进入细胞,当添加DSF作为辅助药物后,细胞内Pt水平明显增加,说明DSF能促进CDDP更多地进入细胞,增加细胞中CDDP浓度,从而增强CDDP对细胞的毒性作用。
