超临界二氧化碳技术用于医疗器械灭菌的探讨
2020-06-12胡凯杨辉晁园谢昕俞卉耿红甄辉
胡凯,杨辉,晁园,谢昕,俞卉,耿红,甄辉
浙江省医疗器械审评中心,杭州市,311121
0 引言
医疗器械产品适用的灭菌技术,是基于多种因素的权衡。在选择最合适的灭菌方法时,应考虑到典型的微生物污染和材料对热、化学和辐射处理的稳定性以及产品状态(液体、半固体或固体)。但无论使用何种技术,都必须满足各国对无菌保障水平的法律法规和强制性标准要求(如《中国药典》,灭菌处理应在使用前确保SAL-6水平)。
根据作者单位牵头承担的《无菌医疗器械灭菌工艺注册技术审查指导原则(征求意见稿)》工作,常用的医疗器械灭菌工艺主要有湿热、干热、环氧乙烷(下文简称EtO)、辐射。征求稿中对这几种灭菌方法的特点进行了论述。
湿热灭菌通常需要在121oC下运行15~30 min才能杀死抗药性细菌,因此不能将其应用于对温度和湿度敏感的产品。干热灭菌排除了湿度因素,但其温度相比湿热灭菌更高。辐射灭菌中γ射线会引起聚合物链断裂或形成不需要的化学键,对产品的临床使用和性能产生重大影响(如生物相容性),而电子束辐射则无法穿透足够的深度。EtO则是一种有毒、易燃易爆的气体,其致癌性问题以及灭菌后存在的有毒残留物影响了其应用于生物材料等植入物灭菌。可见,以上几种常见的灭菌方法有着显著的局限性。
2019年2月美国当局暂停了伊利诺伊州、佐治亚州等地的EtO灭菌机构,因环保署(EPA)认为工厂周围空气的EtO含量超过可接受限度。这导致了医疗器械生产企业和使用机构的诸多不便,如小儿呼吸管的短缺[1]。
作为常规技术的替代方法,有研究者还探索了其他灭菌技术用于生物材料,例如过氧化氢气体等离子体、过氧乙酸或臭氧,它们都有自己的局限性,并已被证实会改变不同有机聚合物的形态结构和表面特性[2]。
因此,探索一种适用于新型材料医疗器械的安全、绿色灭菌技术意义重大。笔者通过国内外相关文献的综合分析,讨论医疗器械领域使用超临界二氧化碳(下文简称scCO2)作为新灭菌技术的可能性。
1 超临界二氧化碳理化特性和灭菌机制学说
scCO2是一种超临界流体,即介于液体和气体之间的中间性质的物质相态(如图1所示),兼具液体的密度和气体的粘度及扩散性,当温度和压强超过临界点(Pc,Tc)时流体为超临界状态。CO2在压力(Pc=7.39 MPa)和温度(Tc=31.1oC)下达到超临界条件,相关文献报道,scCO2还具有以下的特性。
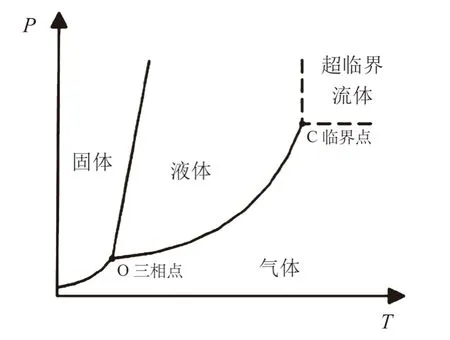
图1 物质相态与温度和压强的关系Fig.1 Relationship between the phase state of matter and temperature/pressure
(1)对多孔或复杂结构的材料具有极好的渗透性[3];
(2)低分子量和低极性分子的良好溶剂;
(3)低反应性,不会产生自由基和反应产物而破坏材料的结构和机械性能[4]。
可见,上述特性提供scCO2具有杀菌作用可行性。此外CO2本身无毒,其低反应性亦不残留有毒物质,且可通过气相、液相的转换等建立循环复用,是一种绿色技术。
scCO2的灭菌机理被广泛讨论。细胞外部和内部CO2浓度的增加可能触发几种与细胞活力相关程度的不同机制,其中多个国外研究支持“酸化是主要机制”的学说[5-6]。
细胞质和细胞外介质的酸化,是将CO2溶解在含有微生物的水性培养基中并转化为碳酸,并进一步电离成碳酸氢根和氢离子。这将降低细胞外的pH值并破坏细胞膜的结构,导致细胞膜通透性增加,从而促进了CO2的进一步渗透。因此,灭菌的动力学通常由两个阶段来表征,且两个阶段与CO2扩散速率高度相关:①慢速期,最初缓慢的失活速率和低CO2渗透率;②快速期,在细胞膜和细胞质中存在较高的CO2[7]。该过程中其他机制有:化学修饰、脂质提取、干扰细胞代谢和细胞裂解。
国内学者在scCO2对大肠杆菌钝化作用的研究中得出,高压CO2对细胞膜造成一定程度的损伤导致细胞内物质的外泄是细胞灭活的重要原因;细胞内部pH降低,一些关键性的蛋白和酶失活,导致细胞内一系列生理代谢活动无法正常进行,是另一个重要原因[8]。
2 超临界二氧化碳对微生物的灭活能力
由上文可知,scCO2的灭菌机制可作用于革兰氏阴性菌、革兰氏阳性菌(营养态和休眠态)、真菌与病毒。外文文献已针对scCO2在不同条件下对不同微生物灭活能力进行了收集和展开。ZHANG等[9]研究了在给定的操作条件下,scCO2对12种革兰氏阳性菌、10种革兰氏阴性菌、8种细菌孢子和8种真菌的灭菌效果,温度范围大多为20oC至60oC,压力为50至100 bar,保持时间从5 min到5 h。
scCO2在不同的初始条件和灭菌参数下,能够实现多种菌属的灭菌(Log R>6);营养形态革兰氏阳性菌种的细胞壁较革兰氏阴性菌种厚,但在更严格的操作条件下仍易实现高水平灭菌。
孢子形态的细菌对热和化学物质的渗透具有更高的抵抗力,比营养形态对灭菌的抵抗力更高,因此孢子可用于测试某些实验条件下灭菌效果。孢子对超临界处理具有高度抗性,如枯草芽孢杆菌,与相应的营养形态相比,可采用更长的灭菌时间、更高的操作温度或使用添加剂来增加灭活能力。
对于真菌,SAL-6通常条件是中等工作压力(85~150 bar),温度(38~50oC)和适度的处理时间(少于1 h)下,在某些情况下也需要添加添加剂。scCO2灭菌对不同菌种的条件和效果如表1所示。
病毒的结构对所用灭菌技术的抵抗力有决定性影响。非包膜病毒无包膜结构,对传统的灭菌技术更具抵抗力,完全失活所需的条件可能对产品有害。为了克服这些缺点,有研究者利用scCO2技术对一些病毒族的灭活进行了测试,结果表明scCO2技术可与其他技术(如PAA灭菌剂)结合进行病毒灭活[10]。
3 超临界二氧化碳灭菌技术对材料影响的研究案例
国外诸多文献报道scCO2技术可在多种应用场景中达到最终灭菌,例如再生医学、食品、医疗废物、药品或水处理,涉及多类材料物质。可靠的灭菌处理应在不改变材料成分和特性的情况下达到效果。因此,需要评价scCO2对材料的影响,包括物理性能、结构、生物相容性等等。
3.1 同种异体及异种移植生物材料
传统的几种灭菌技术因渗透能力低、生物材料热不稳定性、有害灭活以及辐射或氧化环境下材料的降解方面存在局限性,导致灭菌效率低、生物活性丧失以及组织特性的变化。据报道,对于同种异体及异种生物材料(软组织和硬组织),scCO2灭菌技术对移植物的结构和生物学性能影响很小[11-13]。
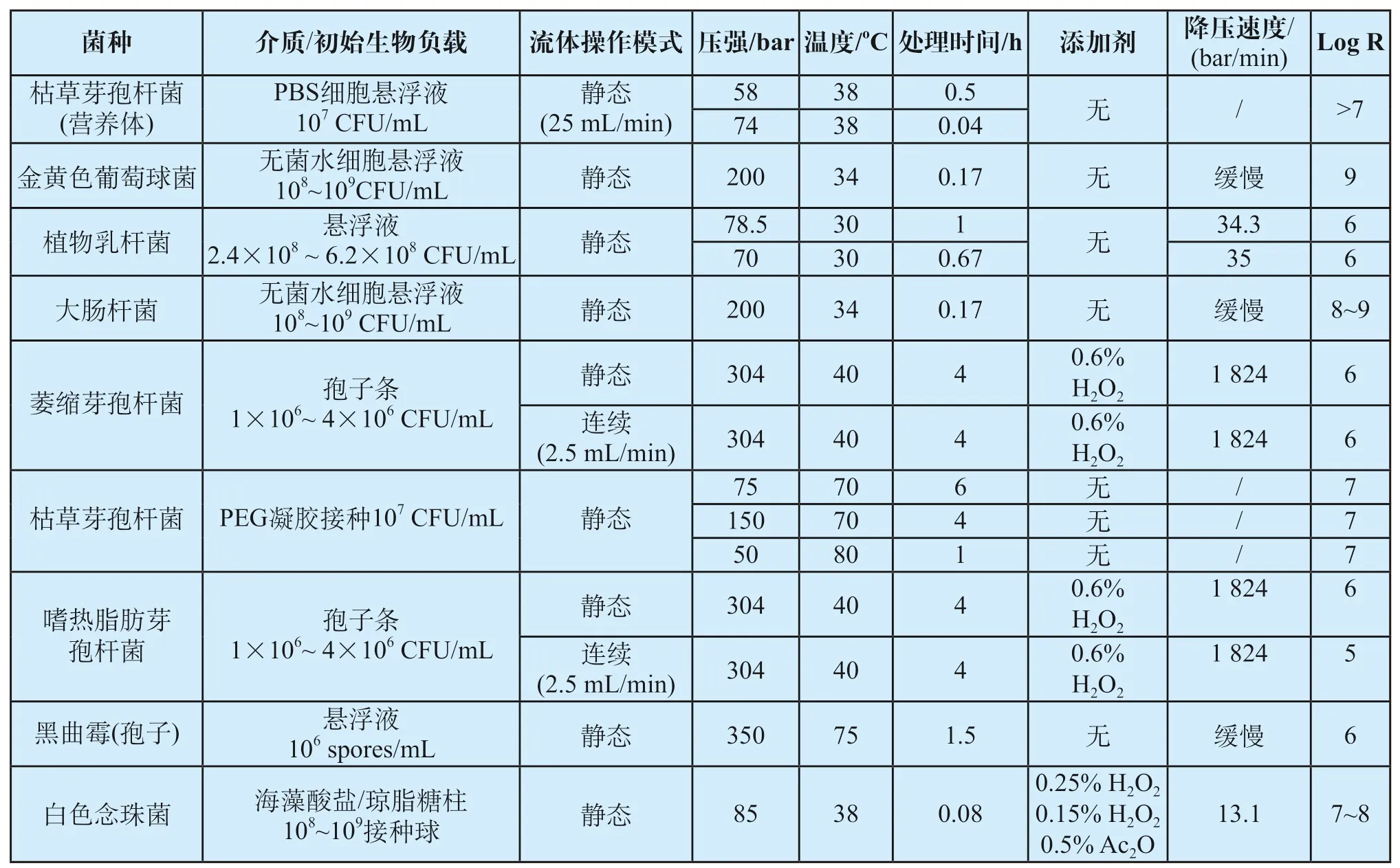
表1 scCO2灭菌对不同菌种的条件和效果Tab.1 Conditions and effects of scCO2 sterilization on different bacteria and fungi
对于软组织,异种移植物进行脱细胞和去除蛋白质以获得不会触发免疫原性和其他术后异物反应的细胞外基质,是组织工程中的重要方法。为防止移植过程污染,需对移植物进行灭菌。在用于脱细胞心脏瓣膜的灭菌测试中,scCO2灭菌(使用过氧乙酸和过氧化氢作为添加剂)被证明是获得SAL-6无菌保障水平而不引起显著结构变化的唯一方法[14]。而γ射线辐射灭菌损坏了瓣膜尖端,电解水/过氧化氢灭菌由于微生物残留不达标不适合进行最终灭菌。在对经过scCO2灭菌处理的心脏瓣膜进行了绵羊体内测试,显示至少5个月的再生反应及正常的血液动力学功能[13]。用过氧乙酸作为添加剂的scCO2灭菌技术也被证明与细胞真皮基质相容[10],并且成功应用于骨腱骨组织、肌腱和羊膜的同种异体移植以及脱细胞肺组织的异种移植[11,15-17]。
对于硬组织,如用于骨移植物的灭菌方法应确保微生物灭活,同时保留骨移植物固有的机械和生物力学特性,多项研究强调了在低温和中等压力条件下,scCO2灭菌在微生物灭活以及同种异体不同部位(肱骨、半月板、股骨和胫骨)和异种来源移植物(羊、兔和牛)的最终灭菌中的效果[12,18]。体外和体内研究表明,经scCO2灭菌移植物的生物力学性能比经γ射线辐照灭菌的移植物更接近原始移植物,并且使用某些添加剂(过氧化氢和过氧乙酸)不会显著改变骨骼的静态和动态机械性能[12,16]。此外,RUSSEL等[18]通过多项体内研究证实,超临界灭菌的移植物具有骨传导性,和未处理的同种异体移植物没有组织学差异[12,18]。
3.2 天然材料
关于其他天然材料,如多糖,scCO2技术通过减弱对材料化学结构和性能相关的有害作用,开辟新机制。在对藻酸盐水凝胶进行scCO2灭菌的实验中[4,19],结果达到SAL-6,并通过调节灭菌条件(灭菌剂含量,处理时间)以减轻藻酸盐的降解,保留了基于天然聚合物的膜的机械性能。同时猪体外试验证明该材料具有生物相容性,scCO2灭菌还能够保留淀粉气凝胶材料的复杂纳米结构[20]。
胶原蛋白是一种对热敏感的天然蛋白,已在35oC用scCO2成功灭菌[21]。该技术还成功地对通过冻干获得的高度多孔的3D海绵形式的胶原和矿化胶原进行了灭菌,并且没有显示出明显的机械或形态损伤[19,21]。超临界灭菌后,藻酸盐水凝胶和胶原蛋白支架与人间充质干细胞显示细胞相容性[19]。
3.3 人工合成材料与纺织物
关于合成材料,scCO2灭菌主要集中在用于人体植入物等。用超临界CO2对热固性材料进行灭菌不会引起材料的热和机械性能变化,但是可以通过去除未反应的单体来纯化材料[22]。
有实验证实了scCO2灭菌对被污染的导管进行灭菌的有效性,并且经过多次处理后未观察到表面发生明显变化[23]。量热法和电子显微镜分析证明了用scCO2处理聚乳酸材料不会改变支架的生物相容性和结构[7]。在其他研究中,scCO2灭菌处理不会影响凝胶的流变性质、pH和结构,并且使用雪貂进行的体内试验显示皮下注射无菌水凝胶的生物相容性[24]。对于纺织物,scCO2是需低温处理和不适用刺激性化学消毒剂的纺织品的灭菌替代方法。对由真丝和50%棉—50%聚酯制成的纺织品实验显示,通过单独添加水或与氢氧化钙组合使用,超临界处理的消毒功效会提高,而不会对经处理的纺织品的物理性能造成不利影响[25]。
4 超临界二氧化碳灭菌设备用于医疗器械的实践
scCO2设备在多个临床医学场景下得到了应用,但大多为实验室搭建,如ZHANG等[9]的灭菌效果验证实验。欧洲HCM-Medical公司提供专业scCO2服务,可清洁自体组织以准备重新植入患者体内。美国NovaSterilis公司的scCO2工艺移植了70 000多个同种异体移植组织,为这种绿色灭菌工艺增加了现实生活的支持。
WHITE等[26]在研究中介绍了NovaSterilis 公司的一种灭菌设备(US7108832 B2)。该设备如图2所示,包括一个与二氧化碳的标准压缩气瓶(2)和CO2增压器(6)结合使用的标准空气压缩机(4),止回阀(8),压力表(10),泄压装置(12),以及回收过滤器(30)。该系统的控制组件由带有触摸屏界面和数据记录的控制板监控和操作(32)。国内临床医学领域已见该设备用于同种异体骨组织材料的处理工艺[27]。

图2 Nova Sterilis设备的示意图Fig.2 Schematic diagram of the Nova Sterilis equipment
也有国外研究者利用超流体处理设备配合其他组件,搭建了实验室处理系统,如ISCO SFX 2-10[28]。国内暂未见单纯使用scCO2技术的医疗器械灭菌装置。
5 超临界二氧化碳灭菌用于医疗器械工业领域的考虑
在医疗器械工业领域,scCO2灭菌技术的考虑与实验室应用环境有很大的不同。首先,工业化生产量要远远大于实验室的生产量。其次,产品在生产灭菌中需要包装作为无菌屏障,因此要考虑灭菌方法对包装的影响等。再者,应考虑产品的综合效益。未见报道描述有工业大批量产品scCO2灭菌系统。
对于符合ISO 13485:2016(国内等同转化为YY/T 0287—2017)的制造商,ISO 14937:2009(国内等同转化为GB/T 19974—2018)定义了用于医疗器械灭菌方法的开发、验证和常规控制等相关的要求。
根据ISO 14937:2009,应评估scCO2灭菌过程对材料和包装的影响。在scCO2灭菌前后测试产品的微生物,包括建立控制产品污染物的系统以避免影响灭菌过程的有效性。根据前文所述,温度和压力作为两大影响CO2形态的根本条件,使用最大操作条件来表示对材料和包装的最严苛挑战,排除可能存在的副反应等不利因素。同时应关注灭菌过程中,工艺变量的系列参数对产品和包装材料的影响,以及达到无菌要求的工艺参数。应验证和确认包装、装载结构、质量、密度和物理状态对灭菌过程的有效性的影响,且该研究须在最难灭菌的材料位置进行。在验证的最后阶段,证明建立的灭菌过程是有效且可重复的,从安装鉴定、操作鉴定和性能鉴定三个阶段论述。
另外,根据前文以及相关研究者如HERDEGEN等[21]在医疗产品灭菌中的研究,scCO2灭菌过程中若用到特殊因素,如灭菌辅助剂(如H2O2)用量、压力循环次数等,也应考虑充分验证。
一次性医疗器械的再处理(SUD)因在多个国家和地区未得到合规性的确认,且目前尚无关于SUD以及患者从这些潜在成本节省中受益的明确证据,笔者不讨论此种情形的应用。此外,scCO2灭菌技术对产品的货架有效期影响,也需要产业界和研究学者的共同探索。
从前文可知,已有较多的证据证明scCO2灭菌具有克服传统灭菌方法局限性的潜力。在该技术受到合理监管下,可增加医疗器械生产灭菌的产品范围,具有明显的经济效益。
