抗体相关脑炎的免疫致病机制
2020-06-12俞昊君管阳太
俞昊君,郝 勇,王 侃,管阳太
上海交通大学医学院附属仁济医院神经内科,上海 200127
抗体相关脑炎疾病的认识得益于中枢神经自身抗体的发现。自1968年起,在脑炎患者中发现了许多与疾病相关的自身抗体,表现为2种不同的类型。其一是以抗Hu抗体为代表的细胞内抗原抗体,常伴发恶性肿瘤,对免疫治疗不敏感,因此与该类抗体相关的神经系统异常被称为副肿瘤综合征(paraneoplastic syndrome,PS);其二是以抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)抗体为代表的细胞表面抗原抗体,常见于年轻人,对免疫治疗敏感,因此与该类抗体相关的疾病被称为自身免疫性脑炎(autoimmune encephalitis,AE)。尽管这2类疾病的临床表现相似,但是其致病机制、治疗方法以及预后均存在较大差异。在PS中,抗体的出现是由于T淋巴细胞介导的细胞毒作用对神经元细胞进行破坏后导致大量的细胞内抗原释放的结果。然而,65%的肿瘤患者的神经系统症状早于肿瘤本身引发的临床症状,因此检测该类抗体有助于早期诊断肿瘤,改善预后。在AE中,大部分抗体的致病作用明确,因此早期检出抗体以及早期实施免疫治疗可以逆转神经系统的损害。
美国梅奥诊所的流行病学调查结果显示,2014年全美国的AE年发病率为13.7/100 000,与感染性脑炎的年发病率(11.6/100 000)相当;1995—2015年全美国的AE年死亡率为0.8/100 000,而感染性脑炎为1/100 000;AE患者的复发住院率高于感染性脑炎[1]。由此可见,AE已显示出与感染性脑炎相当的发病率和社会危害性。然而,目前还未形成针对AE的循证的规范化治疗方案,因此亟待开展相关的临床研究。
本文聚焦于抗体相关脑炎的免疫致病机制,探讨起病的诱因、免疫耐受失败、致病抗体的产生及其破坏作用以及血脑屏障的损害等,旨在促进对AE与PS致病机制及治疗原则差异的认识,为AE治疗方案的优化提供参考依据。
1 抗体相关脑炎发病的诱因
1.1 肿瘤
随着PS相关抗体的发现,也发现了抗体相关脑炎。随着抗体谱的更新以及致病性抗体的发现,目前已认识到抗体相关脑炎并非与肿瘤相关。不同类型的抗体介导的抗体相关脑炎合并肿瘤的概率以及肿瘤的类型均呈现较大差异。据统计,抗α-氨基-3-羟基-5-甲基-4-异噁唑丙酸(alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid,AMPA)抗体脑炎并发肿瘤的概率为60%~70%,肿瘤类型主要为小细胞肺癌、乳腺癌和胸腺瘤[2];抗NMDAR抗体脑炎并发肿瘤的概率为40%,肿瘤类型以卵巢畸胎瘤为主[3];而另一些抗体相关脑炎与肿瘤的相关性较小,如抗富亮氨酸胶质瘤灭活蛋白1(leucine-rich glioma-inactivated protein 1,LGI1)抗体脑炎等[4]。
在抗细胞内抗体介导的PS中,脑炎损害由抗肿瘤免疫过程中产生的自身免疫性T细胞介导。研究表明,坏死的肿瘤细胞释放的抗原在区域淋巴结中被抗原提呈细胞(antigen-presenting cell,APC)吞噬并加工提呈给免疫细胞,从而激活抗肿瘤免疫应答;细胞毒性T细胞通过颗粒酶和穿孔素等途径攻击具有相似抗原表位的中枢神经细胞,引发神经细胞死亡,而释放的细胞内抗原又可经体液免疫产生自身抗体,但这些抗体不具有直接的致病作用[5]。因此,PS患者体内检出的抗体仅仅是细胞免疫反应激活体液免疫后的副产物,能够可靠地提示发生了细胞免疫的紊乱,但自身并不是介导病理损伤的主要因素。充分认识细胞内抗体的特点对于指导PS患者的治疗具有重要意义,检出细胞内抗体可能预示肿瘤的发生,而及早进行肿瘤筛查能够显著地改善患者的预后。
一些合并肿瘤的AE的发病过程类似,但是免疫毒性作用偏向于由体液免疫产生的自身免疫性抗体所介导,并且对神经元造成的损伤是功能性且可逆的[6]。对于合并畸胎瘤的抗NMDAR抗体脑炎,由于畸胎瘤组织常含有成熟或不成熟的神经组织,因此畸胎瘤中的神经细胞表面抗原在经提呈后激活体液免疫应答所产生的抗体,同样也可以介导脑组织的免疫损伤[7]。基于体内外抗细胞表面抗原抗体致病性研究的结果,认为AE的免疫病理状态是由体内异常的自身反应性抗体所介导。早期切除肿瘤以及应用免疫治疗可以改善患者的预后,而病情自行缓解少见。不同类型AE患者的病情缓解速度、后遗症以及复发率不尽相同。一般而言,与肿瘤相关性较强的AE类型,尤其是存在T细胞介导的细胞毒作用,对免疫治疗的反应较差。
AE与PS的发病机制存在差异,因此治疗原则也存在差异。深入理解AE与PS的特点,有助于早期制定规范的个体化治疗方案。
胸腺肿瘤通常与系统性自身免疫性疾病或神经系统自身免疫性疾病有关,这与胸腺作为免疫细胞成熟以及自身免疫耐受形成的器官存在关联。胸腺髓质上皮细胞表达的自身免疫调节因子(autoimmune regulator,AIRE)基因缺失后,常产生多种与AE相关的抗体,如抗γ-氨基丁酸(gamma-aminobutyric acid,GABA)B型受体和抗谷氨酸脱羧酶65(glutamic acid decarboxylase 65,GAD65)抗体[8]。因此,胸腺肿瘤作为发病诱因,因其可能干扰中枢系统的免疫耐受,具有独特的复杂性。
1.2 病毒感染
研究发现,约25%的单纯疱疹病毒性脑炎(herpes simplex virus encephalitis,HSE)患者体内可检测出抗神经细胞表面蛋白的抗体,主要是抗NMDAR抗体,提示中枢系统病毒感染与AE有关[9],临床上表现为在有效治疗病毒感染数周后,患者又出现一系列精神神经症状,儿童以手足徐动症为主要表现,成人则以精神症状和认知障碍为主要表现[10];此时从患者的血浆和脑脊液中主要检测出抗NMDAR抗体[11];抗病毒治疗无效,但是免疫治疗(糖皮质激素治疗、血浆置换、静脉输注丙种球蛋白等)可以明显改善精神神经症状,并且无再次诱发病毒感染的证据[10]。此外,在部分抗NMDAR脑炎患者中,存在其他病原体感染的血清学依据,如水痘-带状疱疹病毒和支原体等[11],提示除常见的单纯疱疹病毒以外,感染另一些病原体也可能诱发AE。
上述发现揭示,在病毒介导的炎性损伤中,损伤导致细胞表面抗原的释放,继而诱导生成相应的自身免疫性抗体。相对亲神经的单纯疱疹病毒损伤神经细胞后导致抗原的释放,呈递抗原的APC与游离抗原随脑脊液回流汇入外周免疫器官,进一步激活适应性免疫反应。然而,有研究指出,抗NMDAR抗体首先是从脑脊液中检测出来的,并且脑脊液中的细胞能够生成抗NMDAR抗体,由此提示可能存在抗体的鞘内合成[10,12]。由于中枢神经系统缺少负责抗原递呈以及激活适应性免疫反应的细胞和组织,因此推测最初的适应性免疫反应的激活可能发生于中枢神经系统之外,随后发展至中枢神经系统。
1.3 其他诱因
事实上,部分AE的发病诱因仍不明确,既未合并肿瘤,也无近期病毒感染史,提示可能存在其他未知诱因。AE患者体内检测出其他自身抗体如抗核抗体(antinuclear antibody,ANA)的概率高于一般人群,提示此类患者对自身免疫性疾病的易感性[13],因此有必要开展抗体相关脑炎与其他自身免疫性疾病共病的研究。研究发现,抗NMDAR抗体脑炎、抗LGI1抗体脑炎和抗IgLON家族成员5(IgLON family member 5,IgLON5)抗体脑炎与特定的人类白细胞抗原(human leukocyte antigen,HLA)存在相关性[14-16]。不仅如此,抗NMDAR抗体脑炎小鼠模型显示,长期处于应激状态下,血清抗NMDA谷氨酸受体NR1亚单位抗体IgA水平增加[17],提示AE的发生还可能与生活方式有关。
2 免疫耐受失败
自身免疫性疾病的发生起始于免疫自稳状态的破坏。当机体免疫功能正常时,免疫系统能够及时清除体内受伤、衰老和变性的细胞以及外来抗原,并对自身成分保持免疫耐受,即接触抗原性物质时表现出特异性的无应答状态。如果发生感染或肿瘤时,固有免疫细胞可以通过细胞表面的受体结合病原体的外来病原相关分子模式(pathogen-associated molecular pattern,PAMP)或损伤细胞分泌的损伤相关分子模式(damageassociated molecular pattern,DAMP),其中自然杀伤细胞可以通过结合细胞表面异常的主要组织相容性复合体抗原Ⅰ类分子等,及时识别病原体或受损细胞。一方面,通过固有免疫终止病理进程;另一方面,必要时由APC将抗原提呈至适应性免疫细胞,作为适应性免疫应答的起始环节。自身免疫性疾病通常由自身反应性T细胞以及自身反应性抗体所介导,故适应性免疫耐受的终止和破坏是导致自身免疫性疾病发生的根本原因。
在炎症或肿瘤等诱因的作用下,原有的适应性免疫耐受机制受到挑战,少部分的外周自身反应性淋巴细胞异常激活,破坏了适应性免疫耐受。例如,坏死细胞释放的隐蔽抗原或抗原表位扩展暴露的非优势抗原可能与自身反应性T细胞和B细胞发生接触,产生有效的免疫应答;同时,辅助活化信号增多,APC在局部炎症细胞因子的协同刺激作用下,能够活化自身反应性T细胞和B细胞;此外,通过分子模拟等途径产生的经修饰的自身抗原和交叉抗原也能够提供激活新T细胞克隆的活性基团,取代本已耐受的T细胞克隆,通过旁路辅助T细胞,有效地辅助活化自身反应性B细胞。除此之外,活化诱导的细胞死亡(activation-induced cell death,AICD)机制障碍、多克隆激活以及免疫调节紊乱,都可能是抗体相关脑炎发病的潜在免疫病理基础。
3 抗体分类及其生成
抗细胞膜表面抗原抗体大多与AE相关,抗细胞内抗原抗体大多与PS相关。PS患者的临床症状被认为由细胞免疫紊乱主导,而AE则是由体液免疫异常产生的自身抗体所介导的中枢神经系统损伤。在PS中,细胞免疫紊乱是抗肿瘤免疫效应的副产物,自身抗体的产生继发于细胞免疫紊乱,因此抗体仅具诊断价值。基于此原理,针对PS患者的治疗重点不在于缓解异常的自身免疫反应。然而,在AE中,体液免疫产生的自身抗体具有明确的致病作用,因此免疫治疗的疗效显著。
当适应性免疫耐受失败后,自身免疫性B淋巴细胞得到活化,在局部淋巴结或中枢神经系统淋巴滤泡中进行克隆性增殖,最终转化为成熟的浆细胞,继而生成抗体,可根据重链恒定区氨基酸组成的排列顺序分为IgM(μ型重链)、IgD(δ型重链)、IgG(1~4)(γ1~4型重链)、IgA(1~2)(α1~2型重链)和IgE(ε型重链)等。
4 AE致病抗体的作用
4.1 阻断细胞表面受体或离子通道功能
GABAB受体是抑制性神经递质GABAB的一类G蛋白偶联受体,研究提示抗GABAB受体的抗体结合于GABAB1亚基的细胞外结构域,能够阻断受体功能,导致合并严重癫痫的边缘叶脑炎。体外实验发现,在未改变受体密度的前提下,抗体能够拮抗GABAB受体激动剂对于电生理的抑制作用,提示抗体对受体可能存在直接的阻断作用[18-19]。
4.2 调节受体内吞
IgG1与抗原结合可导致抗原交联,抗原抗体复合物被内化或吞噬,最终在细胞内被降解。例如,在抗NMDAR脑炎中,抗体可以促进NMDAR的内吞,降低突触后膜受体的密度,引发以神经精神症状、癫痫和肌张力障碍为主要临床表现的脑炎。NMDAR是一类碘化谷氨酸受体,其抗体主要靶向GluN1亚基。体内外实验均观察到抗体能够选择性地可逆性减少突触表面NMDAR的密度[20],而抗体的受体交联作用可能是导致NMDAR内化的原因,并且抗体与GluN1亚基的特异性结合改变了EphB2受体与NMDAR在细胞表面正常的相互作用,使其在NMDAR内化之前,从突触位点移至突触外位点[21-23]。除此之外,其他类型抗体的体外实验也发现了突触受体数量的减少,包括AMPA受体[24]、GABAA受体[25]、IgLON5[26]、神经连接蛋白3α[27]、二肽氨基肽酶样蛋白(dipeptidyl aminopeptidase-like protein,DPPX)6[28]、多巴胺受体2(dopamine receptor 2,DR2)[29]、抗代谢型谷氨酸受体5(metabotropic glutamate receptor 5,mGluR5)[30]和甘氨酸受体(glycine receptor,GlyR)抗体[31]。
4.3 补体激活与炎症反应
抗原抗体复合物(特别是IgG1和IgG3)的形成可以激活补体系统,促进巨噬细胞的趋化和吞噬作用,并且在细胞膜上形成膜攻击复合物(membrane attack complex,MAC)诱发细胞溶解[32]。在抗体靶向AMPA受体GluA3亚基的Rasmussen脑炎中,发现补体激活的经典途径具有致病作用[33-34]。然而,也有研究者并不认可针对GluA3亚基抗体的致病作用,认为是细胞免疫主导了该类脑炎的损伤病变[35]。此外,体外实验发现,在进行性脑脊髓炎中导致强直及肌阵挛的抗GlyR抗体与补体C3b组分存在共定位[36];尸检发现,在抗接触蛋白相关样蛋白2(contactinassociated protein-like 2,CASPR2)抗体脑炎患者的脑组织中,抗电压门控钾通道蛋白LGI1呈现补体沉积[37-38],提示补体可能在病灶部位与抗原抗体复合物相结合,继而破坏神经元细胞膜,并且活化固有免疫介导的炎症损伤。
4.4 破坏相关蛋白的功能
尽管检测到的抗体大多为IgG1,但也有以IgG4为主。与IgG1不同的是,IgG4无法结合补体,诱导受体交联及内化的能力也较差,因此IgG4大多通过影响正常蛋白之间的相互作用以及干扰蛋白的功能来介导自身免疫性疾病的病理损伤。在抗LGI1抗体介导的边缘性脑炎中,体内实验和体外电生理实验均发现抗LGI1抗体与LGI1蛋白的不同抗原表位相结合,干扰其与突触前蛋白ADAM23和突触后蛋白ADAM22的相互作用,降低突触后AMPA受体密度,改变突触前钾离子通道功能,导致神经元兴奋性增加[39]。在双载蛋白抗体相关副肿瘤性僵人综合征或伴有强直和肌阵孪的进展性脑脊髓炎中,抗体也具有特殊的蛋白功能阻断作用。双载蛋白参与网格蛋白介导的突触前膜囊泡的内吞和循环。体内外实验均发现抗体与双载蛋白SH3结构域的结合阻断了其与动力蛋白及其他细胞内蛋白的相互作用,导致无法进行囊泡内吞,致使突触前膜释放的神经递质囊泡减少,从而影响突触功能[40]。
目前大多数有关抗体相关脑炎致病机制的研究不够深入,需要进一步研究和验证。除此之外,对另一些抗体的致病作用仍知之甚少。在IgLON5抗体脑炎中,患者表现出睡眠中呼吸暂停和异常活动,尸检发现脑组织中存在神经元纤维缠结以及高度磷酸化tau蛋白的沉积[26],由此提示其与神经退行性疾病的潜在关联。然而,目前尚不明确究竟是tau蛋白沉积后引发的免疫学改变,还是自身免疫性疾病导致的tau蛋白沉积。
5 血脑屏障的破坏
血脑屏障由毛细血管内皮细胞、基底膜、周细胞和星形胶质细胞足突组成,能够限制大分子和细胞进入脑实质。血脑屏障在毛细血管处最为紧密,能够控制体液弥散,但在毛细血管后微静脉处则较为薄弱,成为招募免疫细胞的入口[41]。血脑屏障未受损时,抗体可以通过跨细胞分泌或细胞旁途径等形式进入中枢神经系统[42]。然而,尽管外周与中枢神经系统中的抗体存在动态交换,但是一些由抗外周及中枢神经系统共存靶抗原的抗体介导的周围神经疾病,如抗电压门控钙通道抗体介导的兰伯特-伊顿肌无力综合征(Lambert-Eaton myasthenic syndrome,LEMS),并不伴有中枢神经系统损害。与之类似,采用肽链诱导小鼠NMDAR抗体的生成并不会导致出现脑损伤的临床表现和影像学表现,而进一步使用脂多糖破坏血脑屏障后,可以观察到抗体的致病作用[42-43],因此血脑屏障的破坏可能是外周抗体进入中枢神经系统引发疾病的必要条件。在HSE等感染后引发的抗NMDAR脑炎中,抗体可以在鞘内合成。APC经由血脑屏障薄弱处进入脑实质后与抗原结合,然后返回外周激活适应性免疫反应,此后再次进入中枢神经系统,并且分化成浆细胞而生成抗体。值得注意的是,血脑屏障各个部位通透性或破坏程度的差异可能是导致抗体相关中枢神经系统损伤区域存在差异的原因之一。因此,导致血脑屏障破坏的因素可能提示了损伤的区域特征。抗体进入脑实质的部位不同,决定了同一种抗体脑炎患者可能出现不同的神经精神症状[44]。
6 总结
抗体相关脑炎的诊断是以血清或脑脊液中检出自身反应性抗体为依据,而根据靶向抗原位置的不同,可将抗体相关脑炎分成PS与AE这2类致病机制和治疗原则截然不同的疾病。
相较于AE,PS继发于抗肿瘤细胞的免疫反应,因此在对PS进行治疗时需考虑各类原发肿瘤的实际情况,免疫治疗不完全适用。
AE是以体液免疫介导为主的自身免疫性疾病,研究其致病机制有助于理解原发免疫耐受失败的关键环节,探索干预的方法,实现对因治疗。表1总结了AE的致病抗体类型。已有证据表明,肿瘤和病毒感染所致的抗原表位暴露是AE的潜在诱因,但仍有相当一部分抗体类型的产生原因尚不明确。体液免疫起始阶段的固有免疫系统与细胞免疫的辅助性角色,是潜在靶向药物研究的方向。同时,研究血脑屏障在AE致病环节中的作用有助于探究阻断抗体进入中枢神经系统的预防途径。目前,尚缺乏规范化的AE治疗方案,并且鉴于患者的抗体异质性较大,对免疫治疗的反应存在差异,因此有必要开展进一步的研究,基于各类抗体的致病特征,制定个体化的治疗方案。
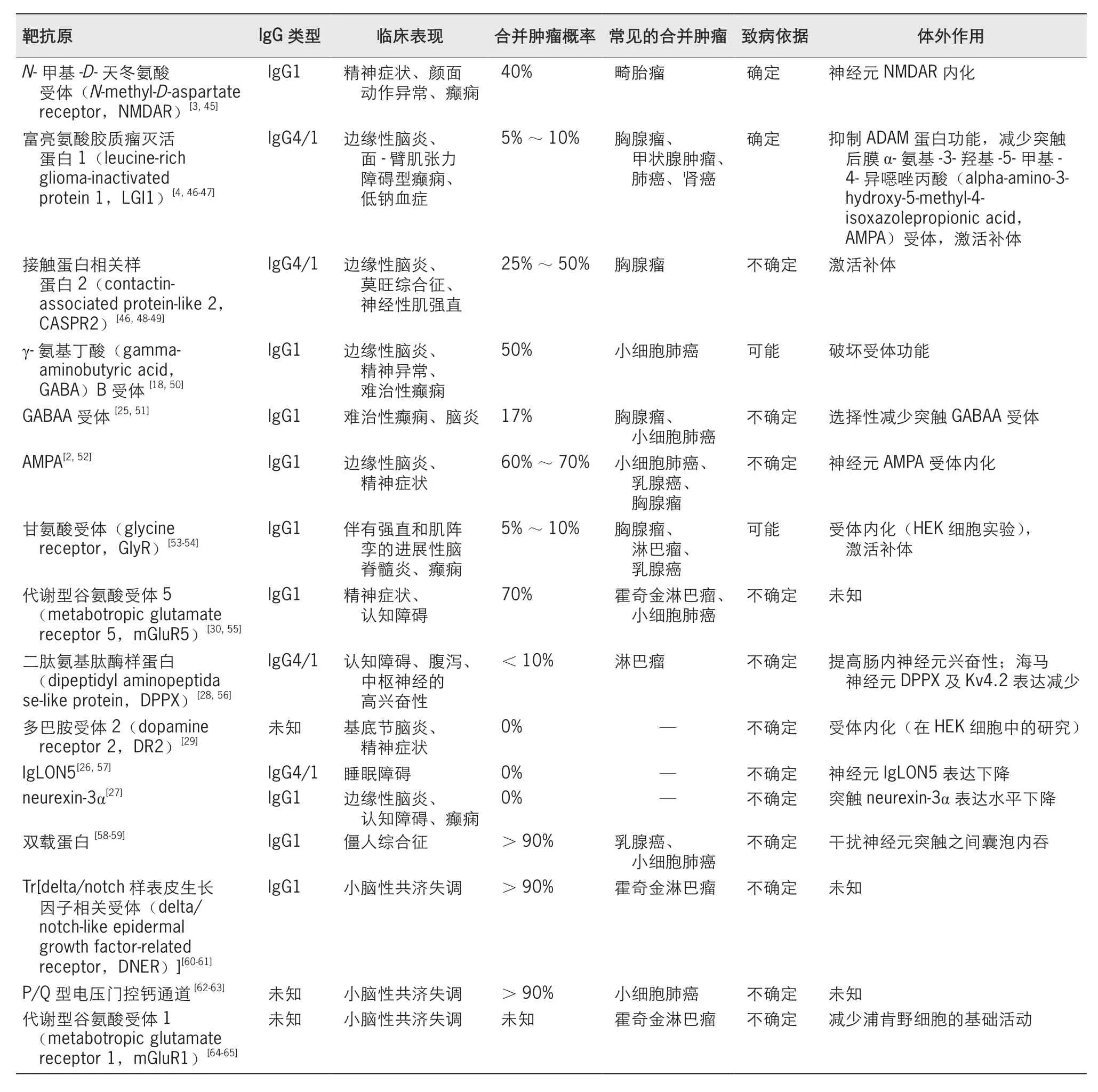
表1 抗体相关脑炎的致病抗体类型
