白蛋白-生育酚纳米粒的构建及其联合化疗-光疗抗乳腺癌细胞多药耐药
2020-06-11高乾乾张娜娜王昊冉陈怡静刘婷婷沈海俊
高乾乾, 张娜娜, 王昊冉, 陈怡静, 刘婷婷, 沈海俊
(江苏大学医学院, 江苏 镇江 212013)
多药耐药是目前肿瘤化疗失败的重要原因,逆转多药耐药是改善肿瘤化疗效果的关键性问题[1]。纳米给药系统的出现为抗肿瘤多药耐药带来了机遇。利用纳米给药系统将光热治疗、光动力治疗、化学治疗相联合,可以显著提高肿瘤的治疗效果,已成为抗肿瘤多药耐药的新型且有效的手段[2-5]。目前,金纳米粒、硫化铜纳米粒、石墨烯纳米片等纳米材料都具有良好的光热转换能力,在肿瘤的光热治疗方面展示了良好的应用潜力[6-8]。但是,这些材料的生物安全性尚未明确,限制了其临床应用。因而,开发具有良好生物相容性的纳米材料,并能够实现化疗和光疗的联合治疗策略具有重要的意义。
本研究拟采用4种食品药品监督管理局批准使用的生物材料:D-α-生育酚琥珀酸酯(D-α-tocopherol succinate,TOS)、人血清白蛋白(human serum albumin,HSA)、吲哚菁绿(indocyanine green,ICG)、多柔比星(doxorubicin,DOX),构建一种负载DOX和ICG的人血清白蛋白-生育酚纳米粒(DOX-loaded HSA-ICG-TOS nanoparticles,简称DOX-HIT-NPs)。其中,DOX为广谱抗癌药,具有良好的化疗效果;ICG在近红外光照下具有光热治疗和光动力治疗的能力[9];TOS是维生素E家族中最有效的抗癌药物,可以引起乳腺癌、前列腺癌、肺癌等多种癌细胞系的凋亡[10],并可以增加DOX对乳腺癌耐药细胞株(MCF-7/ADR)的毒性[11]。因此,DOX-HIT-NPs有望实现化学治疗、光热治疗与光动力治疗的联合应用,逆转肿瘤的多药耐药。
1 材料与方法
1.1 主要材料与仪器
HSA(Sigma公司);TOS、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)购自阿拉丁试剂有限公司;ICG(日本东京化学工业有限公司);DOX(北京华奉联博科技有限公司);Live/Dead细胞染色试剂盒、RPMI 1640培养基、胎牛血清(Thermo Fisher公司);DCFH-DA探针(ROS测试盒)购自南京建成生物研究所;CCK8试剂盒(日本Dojindo公司);红外热成像仪(德国仪器国际贸易有限公司);808 nm光纤耦合激光器(西安赫胥尔镭得激光科技有限公司)。
1.2 DOX-HIT-NPs的制备
首先制备HIT-NPs:称取5 mg HSA溶于10 mL去离子水中,30 mg TOS溶于1 mL乙醇中, 10 mg ICG 溶于1 mL的DMSO中。向TOS溶液中加入适量的EDC和NHS,反应15 min。将10 mL HSA水溶液置于50 mL的离心管中,搅拌条件下,将100 μL TOS(EDC/NHS)溶液逐滴加入到HSA水溶液中,最后将50 μL的ICG溶液逐滴加入到上述混合溶液中,避光搅拌4 h,14 800 r/min离心20 min收集纳米粒,去离子水离心洗涤3次,将获得的HSA-ICG-TOS nanoparticles(HIT-NPs)分散到10 mL去离子水中,备用。
然后制备DOX-HIT-NPs:取1 mL HIT-NPs溶液置于离心管中,将1 mL DOX溶液(0.062 5 mg/mL)逐滴加入,避光搅拌3 h,离心收集纳米粒,去离子水超声分散、洗涤、离心,将获得的搭载DOX的HIT-NPs(DOX-HIT-NPs)分散到1 mL去离子水中,4 ℃保存备用。
1.3 DOX-HIT-NPs的表征
取超声分散后的DOX-HIT-NPs纳米粒溶液,加10 μL溶液于铜网上,自然晾干后,用透射电镜进行观察;采用粒度电位分析仪检测DOX-HIT-NPs的粒径;准备ICG、DOX和DOX-HIT-NPs水溶液,用紫外分光光度计分别进行扫描,波长范围200~900 nm。
1.4 DOX-HIT-NPs的载药量和分散性
按照将DOX负载于HIT-NPs的方法,离心后收集上清液,检测上清液在480 nm处的光密度值。通过参考标准曲线将原始数据转换为DOX浓度,计算DOX-HIT-NPs的载药量和包封率。将获得的DOX-HIT-NPs纳米粒分散到水、PBS、DMEM、RPMI-1640培养基中考察其分散性。计算公式如下:负载DOX的量(μg)= 投入DOX的总量-上清液中DOX的量;载药量 =(负载DOX的量/DOX-HIT-NPs的量)×100%;包封率 =(负载DOX的量/投入DOX的总量)×100%。
1.5 DOX-HIT-NPs的光热转换能力
配制不同浓度的DOX-HIT-NPs溶液,用近红外激光(808 nm,2 W/cm2)照射5 min,每隔30 s用浸入溶液中的热电偶测量纳米颗粒溶液的温度,并用数显温度计进行记录;近红外激光照射3 min后,用红外热成像仪拍摄照片。
1.6 DOX-HIT-NPs的细胞摄取
将MCF-7/ADR细胞按1×105个/孔接种到6孔板中,细胞贴壁后,用含有游离DOX或DOX-HIT-NPs(DOX浓度为10 μg/mL)的新鲜培养基处理细胞。随后,用PBS小心洗涤细胞3次,并用4%(w/v)多聚甲醛固定15 min,弃去多聚甲醛,用PBS小心洗涤细胞3次;然后用DAPI对细胞核染色5~10 min,用PBS小心洗涤细胞3次,封片准备观察,最后使用激光共聚焦显微镜观察DOX的细胞摄取。
1.7 DOX-HIT-NPs的细胞毒性
首先,通过测定近红外光照后活性氧的水平评价DOX-HIT-NPs光动力治疗的可能性。将2×104/孔MCF-7/ADR细胞接种到24孔板中,当细胞完全贴壁后,将细胞分别暴露于完全培养基(对照组)、对照+光照、游离DOX、DOX-HIT-NPs、DOX-HIT-NPs+光照(DOX浓度为10 μg/mL)。激光照射采用808 nm,2 W/cm2,5 min。培养24 h后,除去培养基,PBS洗涤3次,然后加入用PBS稀释1 000倍的DCFH-DA探针,反应20 min左右,用PBS洗涤,荧光显微镜观察。
然后,考察DOX-HIT-NPs的体外化疗-热疗-光动力治疗的联合治疗效果。将MCF-7/ADR细胞分别接种在96孔板中(5×103个/孔),并在细胞培养箱中孵育过夜,当细胞完全贴壁后,按照下列组别进行处理:完全培养基(对照组)、对照+光照组、游离DOX组、DOX-HIT-NPs组、DOX-HIT-NPs+光照组(DOX浓度为10 μg/mL),处理后将细胞继续培养22 h,CCK8法测定细胞活力;另外,用24孔板同法培养与处理细胞,Live/Dead染色试剂盒进行定性分析,荧光显微镜观察染色后的活细胞(绿色)和死细胞(红色)。
1.8 统计学分析
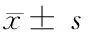
2 结果
2.1 DOX-HIT-NPs的制备和表征
透射电镜观察DOX-HIT-NPs的形态(图1A)显示,DOX-HIT-NPs是近似球形的纳米粒。DOX-HIT-NPs的粒径分布图显示(图1B),DOX-HIT-NPs呈正态分布,平均粒径为278.8 nm,粒径结果比透射电镜显示的颗粒稍大,可能是由于DOX-HIT-NPs表面的蛋白水化层导致的。
HIT-NPs用去离子水离心、洗涤3次后,将获得的纳米颗粒重新分散到水中,呈现明显的绿色(图1C),因为TOS和HSA均为无色,只有ICG为绿色,直观地表明HIT-NPs中存在ICG。进一步地,紫外分光光谱显示DOX-HIT-NPs与游离的ICG在780 nm附近都有一个吸收峰,是ICG的特征吸收峰(图1D)。此结果证明ICG成功地结合到纳米颗粒中。与游离ICG相比,HIT-NPs的吸收峰出现了轻微的红移,这可能是由于ICG与白蛋白复合后分子构象变化所致。同样的DOX-HIT-NPs在近480 nm处具有DOX的特征吸收峰,与游离DOX的特征峰相一致,该结果证明了DOX成功加载到DOX-HIT-NPs中。
A:DOX-HIT-NPs的透射电镜照片;B:DOX-HIT-NPs的粒径分布;C:HIT-NPs分散在水中;D:ICG、DOX和DOX-HIT-NPs的紫外可见吸收光谱
图1 DOX-HIT-NPs的表征
2.2 DOX-HIT-NPs的载药量和分散性
根据DOX的标准曲线,测得DOX-HIT-NPs的载药量为16.0%,包封率为90.1%,表明投入的DOX几乎全部能搭载到HIT-NPs上,说明纳米粒具有良好的载药能力。如图2结果所示,获得的DOX-HIT-NPs可以很容易地分散到水溶液、PBS溶液、DMEM、RPMI 1640培养基中,其良好的分散性有利于纳米粒在这些体系中的稳定存在,在开展细胞实验和动物实验时不会造成聚集而沉淀。

图2 DOX-HIT-NPs在水、PBS、DMEM、RPMI 1640中分散性
2.3 DOX-HIT-NPs的光热转换能力
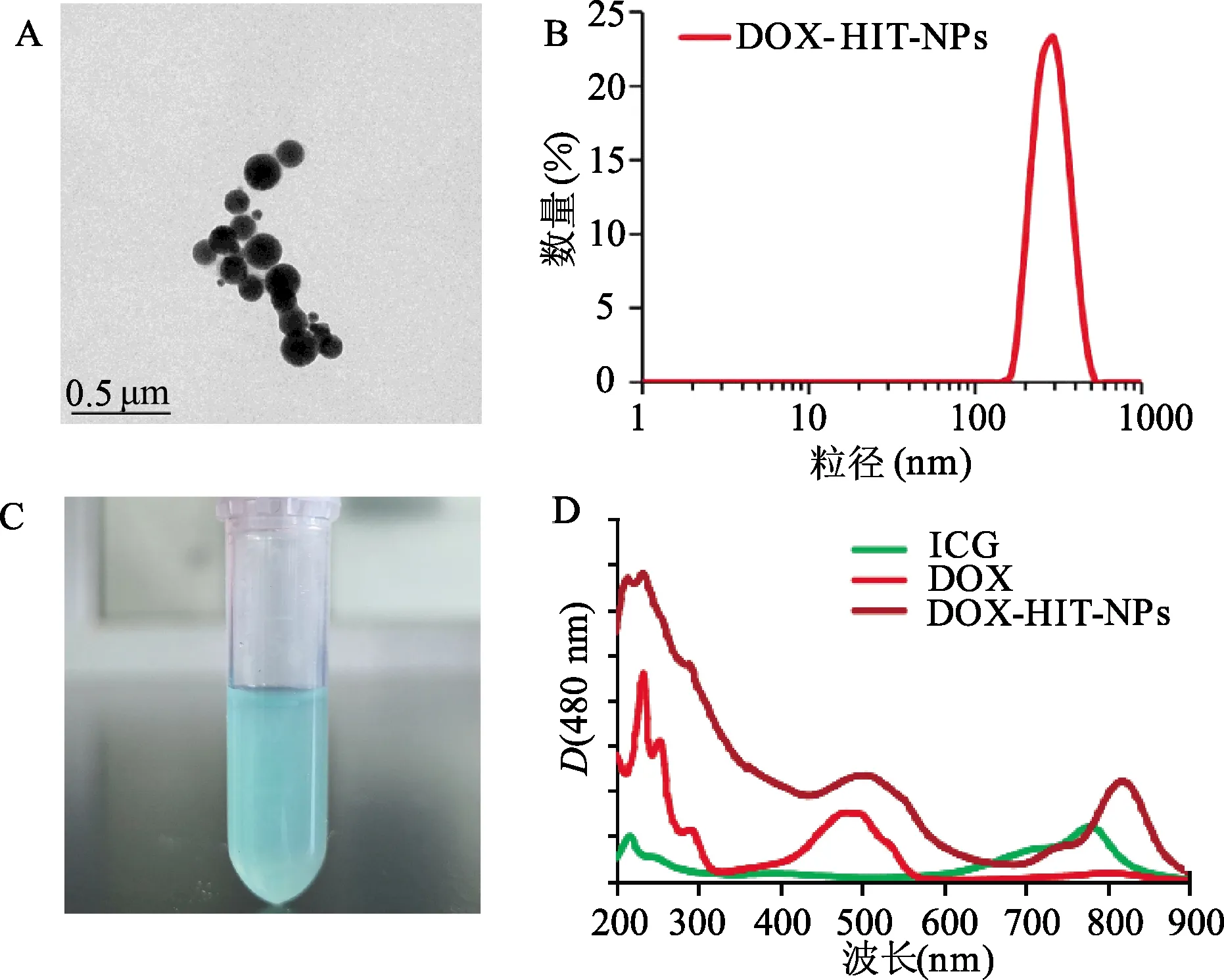
通过近红外激光(808 nm,2 W/cm2)照射来考察DOX-HIT-NPs的光热转换能力。如图3A所示,在相同的近红外激光照射强度下,H2O溶液上升的温度可忽略不计,而DOX-HIT-NPs能够在近红外激光照射下诱导其分散液的快速升温。在60 s内,浓度为0.21 mg/mL DOX-HIT-NPs分散液的温度从室温25.7 ℃升高到45.1 ℃,随着光照时间的延长,最高温度可达到47.9 ℃。当DOX-HIT-NPs浓度为0.35 mg/mL,分散液的最高温度可达到55.5 ℃。红外热成像仪对近红外光照射3 min后的纳米颗粒悬液进行拍照(图3B)所示,红外热成像图像与温度曲线相吻合,相同的光照条件下,纳米粒的浓度越高,温度越高。以上实验结果表明DOX-HIT-NPs具有良好的光热转换能力。
A:DOX-HIT-NPs的光热升温曲线;B:DOX-HIT-NPs的热成像图片图3 DOX-HIT-NPs的光热转换能力
2.4 DOX-HIT-NPs的细胞摄取
运用激光共聚焦显微镜考察MCF-7/ADR细胞对DOX-HIT-NPs的摄取,结果见图4,红色代表DOX的荧光,蓝色代表DAPI的荧光(DAPI主要用于标记细胞核)。图中游离DOX在MCF-7/ADR细胞中含量较少,细胞核内几乎没有(红色和蓝色荧光的无重叠),表现出DOX耐药细胞株的典型特点。而DOX-HIT-NPs的细胞摄取明显高于游离DOX,并且细胞核内的DOX含量亦增高,说明DOX-HIT-NPs可以促进MCF-7/ADR细胞对DOX的摄取,具有一定的逆转耐药的作用。
2.5 DOX-HIT-NPs体外光动力治疗能力评价
如图5结果所示,在对照组、对照+光照组和游离DOX组都没有检测到绿色荧光,说明单纯的光照和DOX不会产生活性氧;MCF-7/ADR细胞在DOX-HIT-NPs处理后可以产生绿色的荧光,说明DOX-HIT-NPs可以产生活性氧,这主要是因为DOX-HIT-NPs中含有TOS,根据文献报道,TOS可能会影响线粒体复合体Ⅱ的泛醌结合位点,诱导活性氧的快速生成。MCF-7/ADR细胞在DOX-HIT-NPs+光照条件下产生的绿色荧光更强,说明DOX-HIT-NPs在光照后活性氧升高,提示DOX-HIT-NPs在近红外光照条件下具有光动力治疗的能力。

图4 DOX-HIT-NPs的细胞摄取(×600)
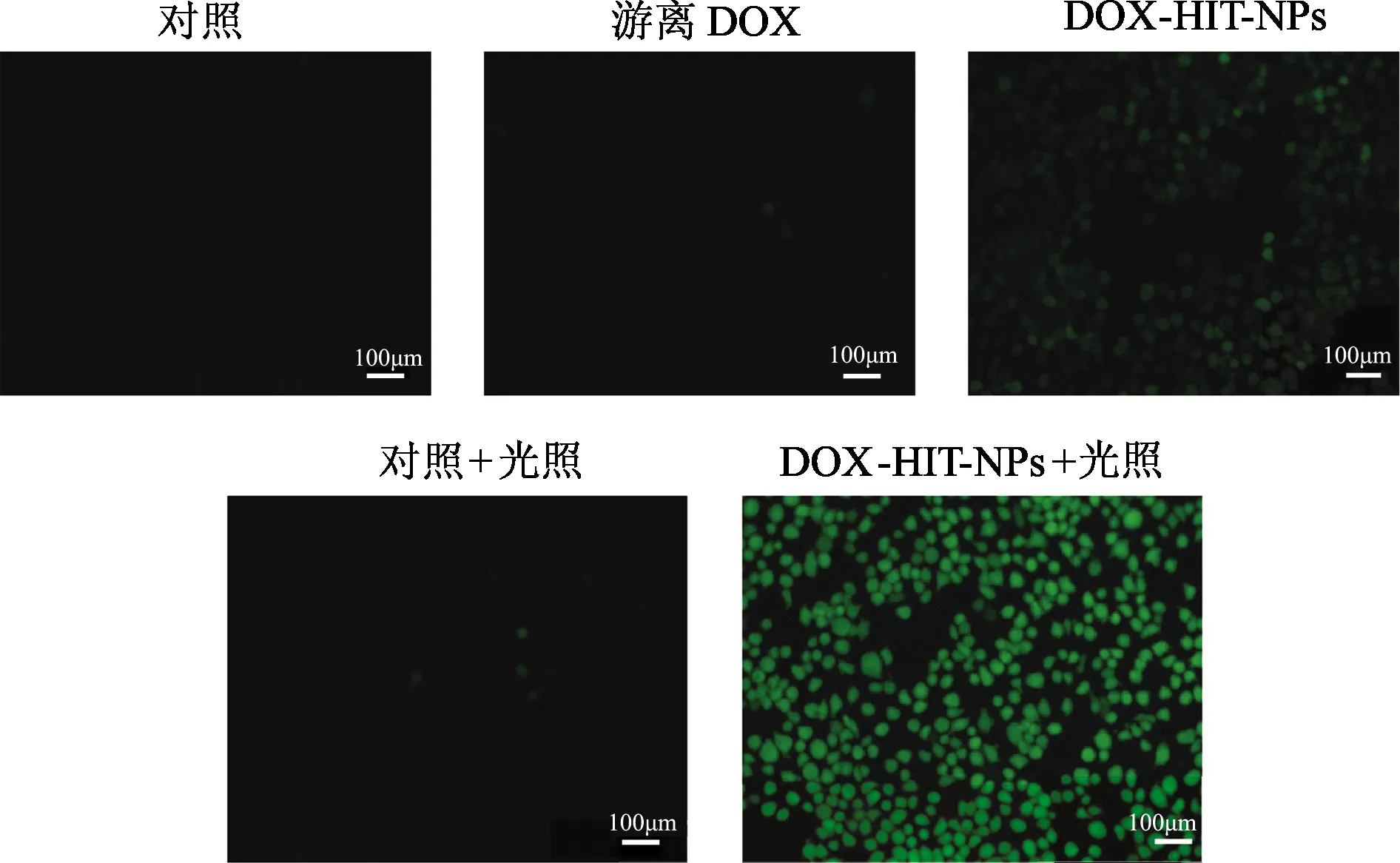
图5 不同因素处理后MCF-7/ADR细胞中活性氧产生情况(×200)
2.6 DOX-HIT-NPs的体外化疗-热疗-光动力治疗的联合治疗效果评价
如图6所示,用单纯近红外激光照射MCF-7/ADR细胞,细胞存活率为98.7%,与对照组相比无统计学意义,说明单纯光照对MCF-7/ADR细胞无影响。与游离DOX组的单纯化疗相比,用DOX-HIT-NPs治疗后,MCF-7/ADR细胞的存活率明显降低,与游离DOX组和DOX-HIT-NPs组相比,用DOX-HIT-NPs加光照治疗后,MCF-7/ADR细胞的存活率显著降低,表明近红外光照产生的光热治疗和光动力治疗显著杀伤了MCF-7/ADR细胞,显示出协同治疗的效果。
为了进一步验证DOX-HIT-NPs对MCF-7/ADR细胞的联合治疗效果,我们通过Live/Dead染色定性地观察了不同组别处理后的MCF-7/ADR细胞。结果如图7所示,与对照组相比,当激光照射后基本上都是绿色信号,说明单纯的激光照射对细胞没什么影响;当用游离DOX培养后,红色的死细胞数量较少,说明MCF-7/ADR细胞对DOX具有一定的耐药性;当用DOX-HIT-NPs处理后,与游离DOX组相比,活细胞数量明显减少,红色信号的死细胞增多,说明DOX-HIT-NPs可以有效地杀伤MCF-7/ADR细胞;当用DOX-HIT-NPs加光照处理后,死细胞数量明显增多,绿色信号的活细胞明显减少,说明在激光照射下DOX-HIT-NPs具有明显的联合治疗效果。这些结果表明DOX-HIT-NPs可以联合化疗-热疗-光动力治疗有效地杀伤耐药的癌细胞。

*:P<0.05,与DOX组比较;#:P<0.05,与DOX-HIT-NPs组比较图6 不同处理组对MCF-7/ADR的细胞毒性

图7 不同处理组MCF-7/ADR细胞的Live/Dead染色图片(×200)
3 讨论
多药耐药是肿瘤治疗的瓶颈,单一的化疗无法满足当前肿瘤治疗的需要。光热治疗法是将光热转换材料注射入体内,靶向聚集在肿瘤部位,在近红外光的照射下将光能转化为热能来杀死癌细胞,是一种无创/微创、恢复时间短、无耐药性的治疗方法。将传统化疗与光热治疗联合可以明显提高治疗效果[3-5],克服肿瘤的多药耐药。光热治疗的关键是光敏剂的选择,无机纳米材料具有良好的光热转换性能,并且可以作为化疗药物的载体,实现化疗与光热治疗的结合,但是在体内的安全性还有待评估[6-8]。本研究以生物相容性优良的HSA、TOS、ICG为原料通过自组装方式成功制备了HIT-NPs,并负载DOX得到DOX-HIT-NPs。将TOS和ICG逐滴添加到HSA水溶液中,ICG可以吸附到HSA的疏水域上[12],而TOS一方面通过疏水作用力与HSA结合[13],另一方面通过TOS的羧基与HSA的氨基反应相互连接。由于TOS的疏水性,在水中会发生聚集而起到“粘合剂”的作用,将与之结合的HSA、与HSA结合的ICG自组装到一起,在水溶液中形成HIT-NPs[13]。由于DOX和TOS之间可以形成离子配对[14],可以将DOX负载到HIT-NPs上,形成DOX-HIT-NPs。DOX-HIT-NPs具有良好的分散性。光热转换能力结果表明,DOX-HIT-NPs的光热转换具有浓度依赖性,即DOX-HIT-NPs浓度越高,光热效应越明显,提示可以通过控制DOX-HIT-NPs浓度来调节温度,在不损伤正常细胞的情况下有效杀伤肿瘤细胞。
根据文献报道,TOS本身也可以促进多种不同类型的肿瘤细胞的凋亡和坏死[10]。此外,TOS可以增加DOX对MCF-7/ADR细胞的毒性作用[11],也可以诱导活性氧的生成,促进肿瘤细胞的凋亡和坏死[15-16]。我们的研究结果也证明,包含TOS的DOX-HIT-NPs可以诱导活性氧的产生,有效抑制MCF-7/ADR的生长。而DOX-HIT-NPs在光照条件下,可以明显增加活性氧的产生,说明DOX-HIT-NPs不仅可以通过光热作用杀死MCF-7/ADR细胞,还具有光动力治疗的能力,可以利用产生活性氧的方式来杀死MCF-7/ADR细胞。另外,细胞实验结果还表明DOX-HIT-NPs能够增加MCF-7/ADR对DOX的摄取,对逆转耐药起到积极的作用;与游离DOX组和DOX-HIT-NPs组相比,用DOX-HIT-NPs加光照治疗后,显著抑制了MCF-7/ADR细胞的增殖,说明DOX-HIT-NPs可以通过联合化学治疗、光热治疗和光动力治疗来杀伤MCF-7/ADR细胞,达到逆转耐药的效果。
综上所述,DOX-HIT-NPs可以将TOS抗肿瘤作用、化学治疗、光热治疗和光动力治疗等多种作用有机整合在一起,对耐药细胞株MCF-7/ADR细胞表现出显著的杀伤效果,加上DOX-HIT-NPs使用的原料已为FDA批准使用,具有优良的生物相容性,因而,DOX-HIT-NPs有望为多药耐药肿瘤的临床治疗提供新的策略。
