磁性二硫化钨的层层自组装修饰:光热-化疗协同抗肿瘤
2020-06-11谢萌杨眉杨娜邓彤彤
谢萌, 杨眉, 杨娜, 邓彤彤
(江苏大学药学院, 江苏 镇江 212013)
目前,癌症仍然是困扰人类健康问题的重大疾病之一[1]。癌症的治疗方法有很多,光热治疗是近年发展起来的新型治疗方式,具有微创、操作简单、效率高的优点[2-3]。但长期的单一治疗会对周围正常组织造成不可避免的附带损伤[4]。因此,当前的研究集中于多元协同治疗,如光热-化疗联合治疗等[5-6]。
过渡金属二硫化钨(WS2)具有优异的药物负载性能和良好的近红外吸收能力[7-9],在临床成像和癌症治疗领域具有良好的发展潜力[10-11]。将氧化铁掺入WS2中构成复合材料时,可以额外表现出良好的磁靶向和超顺磁性,在外加磁场作用下可以定向进入癌细胞。同时,研究表明氧化铁具有磁热和光热转化特性,产生的热能对癌细胞造成不可逆的损伤,可以进一步提高WS2的光热性能[12]。
然而,WS2在生理条件下稳定性差,进入体内后易被免疫系统吞噬[13]。因此,本文旨在合成磁性二硫化钨(magnetic WS2, mWS2)提高光热性能并层层自组装对其修饰改性,以提高其在生理条件下的稳定性,增加体内的循环周期,达到更加高效的治疗效果。
1 材料与方法
1.1 主要材料与仪器
小片径单层WS2纳米片(南京先丰纳米材料科技有限公司);壳聚糖(CS,南京奥多福尼生物科技有限公司);多柔比星(DOX,大连美仑生物有限公司);羧甲基纤维素(CMC)、牛血清白蛋白、无水乙酸钠、六水合三氯化铁及其他分析纯试剂(国药集团化学试剂有限公司);人源性乳腺癌细胞MCF-7细胞株(中国科学院细胞库);超声波细胞粉碎机(宁波新芝生物科技股份有限公司);高速离心机(湖南湘仪实验室仪器开发有限公司);Tecnai G2 F30 S-TWIN场发射透射电子显微镜(美国FEI公司);Nano Brook 90 Plus PALS分析仪(美国布鲁克海文仪器公司)。
1.2 mWS2的制备
称取0.036 g WS2置于干燥烧杯中,加入0.5 mL乙二醇、9.5 mL二乙二醇、0.18 g六水合三氯化铁、0.05 g丙烯酸钠和0.75 g醋酸钠,室温下机械搅拌1 h。将上述溶液装入反应釜中,200 ℃条件下反应24 h。随后将样品13 500 r/min离心30 min,去除上清液。沉淀使用乙醇和超纯水依次洗涤,然后分散至去离子水中,得到1 mg/mL 的mWS2溶液。
1.3 mWS2-CS的合成
称取0.04 g CS,分散于30 mL 0.6%冰醋酸溶液中,超声至溶解后,调节pH值至5.5~6.0,用去离子水定容至40 mL。在机械搅拌下缓慢滴加10 mL mWS2溶液。30 min后用0.22 μm滤膜过滤并收集沉淀,用去离子水洗涤后分散于50 mL水中,超声分散并通入氮气,密封保存备用。
1.4 mWS2-CS/CMC的合成
称取0.04 g CMC,加入200 mL去离子水,探头超声10 min。在机械搅拌作用下缓慢滴加20 mL mWS2-CS溶液。30 min后用0.22 μm滤膜过滤,收集沉淀并分散于20 mL去离子水中,超声分散并通入氮气,密封保存备用。
1.5 磁性考察及形貌表征
分别取适量的mWS2、mWS2-CS/CMC样品置于5 mL玻璃瓶中,将一块强磁铁置于玻璃瓶一侧,放置一段时间后观察磁性。另取适量mWS2材料烘干,使用振动样品磁强计进行磁性能检测。
将样品稀释至0.1 mg/mL滴加到铜片上,溶剂挥发后进行透射电镜表征;将10 μg/mL的样品滴加在云母片上均匀铺平,待溶剂挥发后使用原子力显微镜进行观察和拍摄。
1.6 稳定性考察
取0.02 mg/mL的mWS2、mWS2-CS和mWS2-CS/CMC溶液,依次加入等量去离子水、PBS缓冲液和RPMI-1640培养基(含10%胎牛血清)。常温下避光静置,记录样品的稳定情况。
1.7 光热性能考察
将材料mWS2和mWS2-CS/CMC分别稀释到0.2、0.1、0.05 mg/mL,用808 nm,2 W/cm2的经近红外激光(NIR)照射10 min,用红外热像仪检测温度,每30 s记录一次。
1.8 非特异性蛋白吸附
将样品与牛血清白蛋白溶液按照质量比1 ∶2进行非特异蛋白吸附考察。37℃恒温振荡24 h,取出后离心弃沉淀,检测上清液的荧光值即可计算出牛血清白蛋白吸附率。
1.9 药物负载
称取适量的DOX溶于纯水中,超声分散,配制成1 mg/mL的溶液。按照DOX与材料的质量比2 ∶1进行载药,37℃恒温振荡24 h。随后取出样品,13 500 r/min离心30 min,取上清液测量光密度并计算载药量。
1.10 体外释药
将DOX、mWS2-DOX、mWS2-CS/CMC-DOX用PBS分别稀释至1 mL后置于透析袋中,将透析袋分别放入装有20 mL 不同pH值PBS缓冲液的离心管中,37℃下进行药物释放考察,并在不同时间点取样,测量透析液的荧光值并计算释药量(激发波长为488 nm,发射波长为591 nm,狭缝10 nm)。
此外,将载药后的沉淀分别用pH5.0和pH7.4的PBS分散至1 mL进行近红外促进药物释放考察。光照组用808 nm, 2 W/cm2的近红外激光照射8 min,37℃ 振荡30 min,离心并吸取0.8 mL上清液测荧光,计算药物释放量。重复此步骤,在不同时间点取样测定。非光照组除了不用光照之外,其他步骤均与光照组相同。
1.11 细胞摄取
将MCF-7细胞接种于玻底培养皿中,待细胞长至80%时,加入掺杂了荧光基团FITC的mWS2-CS/CMC材料。摄取2 h后,用4%多聚甲醛固定,并用DAPI对细胞核进行染色。染色完成后滴加防荧光淬灭剂,激光共聚焦显微镜观察材料在细胞内的分布和摄取情况。
1.12 细胞毒性
将MCF-7细胞接种于96孔细胞培养板中,37℃、5% CO2培养24 h后,将载药前后的mWS2、mWS2-CS/CMC稀释为不同浓度加入培养板中,加入PBS缓冲液的细胞作为对照。隔天通过MTT法测定细胞的相对存活率。
1.13 体外光热-化疗联合治疗
将样品分为6组进行光热-化疗联合治疗考察。第1组:PBS;第2组PBS+NIR;第3组:mWS2-CS/CMC;第4组:mWS2-CS/CMC+NIR;第5组:mWS2-CS/CMC-DOX;第6组:mWS2-CS/CMC-DOX+NIR(DOX=25 μg/mL)
将MCF-7细胞接种于96孔细胞培养板中,培养24 h后,将上述组别分别加入培养板中,并对第2、4、6组进行808 nm,2 W/cm2的激光照射处理。随后在37 ℃、5% CO2条件下继续培养24 h,并通过MTT法测定细胞的相对存活率,以此来考察光热-化疗联合治疗的效果。
1.14 统计学分析

2 结果
2.1 磁性考察及形貌表征
由mWS2和mWS2-CS/CMC的磁性考察结果(图1A、1B)可以看出,24 h后样品均被吸附在靠近磁铁的玻璃壁上,表明所合成的材料具有良好的磁性,且修饰后合成材料的磁性并没有减弱。由图1C可见,mWS2的磁滞曲线呈标准的S型,几乎没有出现磁滞现象。
mWS2的透射电镜(图1D)可见,Fe3O4磁性粒子均匀分布在WS2片层上,没有明显的团聚现象。原子力显微镜(图1E、1F)显示mWS2的厚度约为20 nm,粒径在200 nm左右,经过自组装修饰后,厚度增加到80 nm,粒径增至400 nm左右,表明mWS2-CS/CMC成功制备。
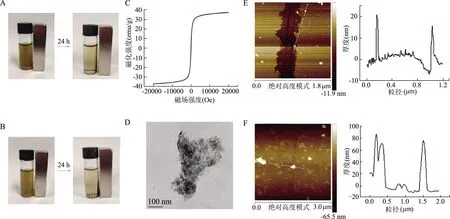
A、B:mWS2和mWS2-CS/CMC的磁性考察照片;C:mWS2的磁滞曲线;D:mWS2的透射电镜图(×97000);E、F:mWS2和mWS2-CS/CMC的原子力显微镜图
图1 材料磁性及形貌表征
2.2 粒径和电位
WS2在经过氧化铁、CS、CMC修饰后,粒径不断增大(图2),表明外壳材料成功地对核心进行了修饰。此外,合成的材料粒径属于纳米级别,可以较好地用于药物负载。样品的Zeta电位图可见,WS2带负电,磁性粒子修饰WS2并不改变其带电情况;mWS2-CS带正电,说明CS成功包裹到mWS2表面;mWS2-CS/CMC带负电,说明CMC成功包裹到mWS2-CS表面。此现象符合层层自组装原理,且合成的最终材料带负电有利于其在水中的稳定性。
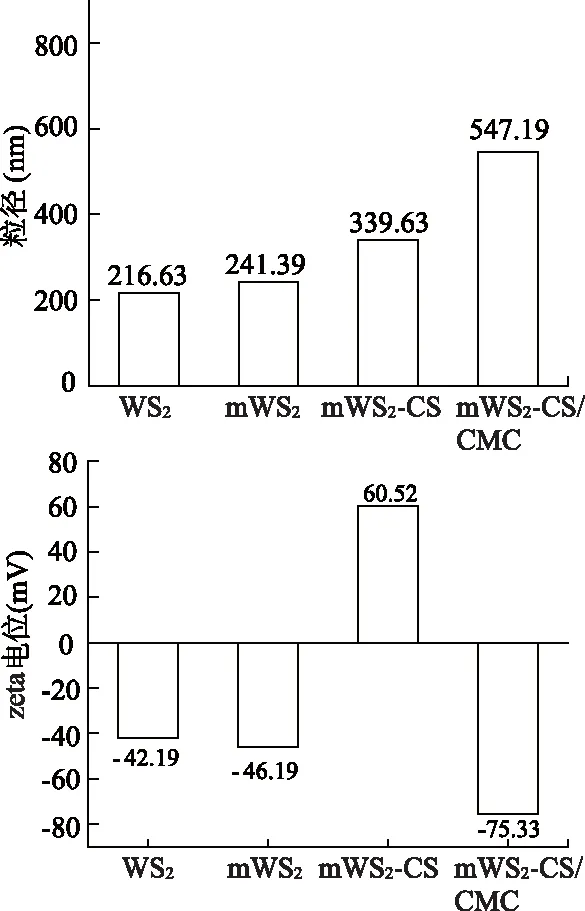
图2 WS2、mWS2、mWS2-CS、mWS2-CS/CMC的粒径和电位图
2.3 稳定性考察
由图3可以看出,避光静置24 h时mWS2和mWS2-CS在纯水、PBS缓冲液和细胞培养液中均出现了部分沉淀,而mWS2-CS/CMC在3种溶液中均无沉淀产生,说明其稳定性在修饰后得到了明显提升,适合作为药物载体。

由左至右依次为纯水、pH为7.4的PBS缓冲液、含10%胎牛血清的RPMI-1640培养液
图3 mWS2、mWS2-CS和mWS2-CS-CMC的稳定性考察
2.4 光热升温
不同浓度WS2、mWS2和mWS2-CS/CMC的光照升温曲线(图4)表明,0.2 mg/mL WS2的最高温度为61℃,同浓度条件下的mWS2最高温度则升至72℃,在进行自组装修饰后,浓度为0.2 mg/mL的mWS2-CS/CMC最高温度仍可达到68℃。当浓度较低时,mWS2和mWS2-CS/CMC的温度也可以达到42℃以上,证明磁性纳米粒子的掺入使WS2的光热性能得到了明显提升。
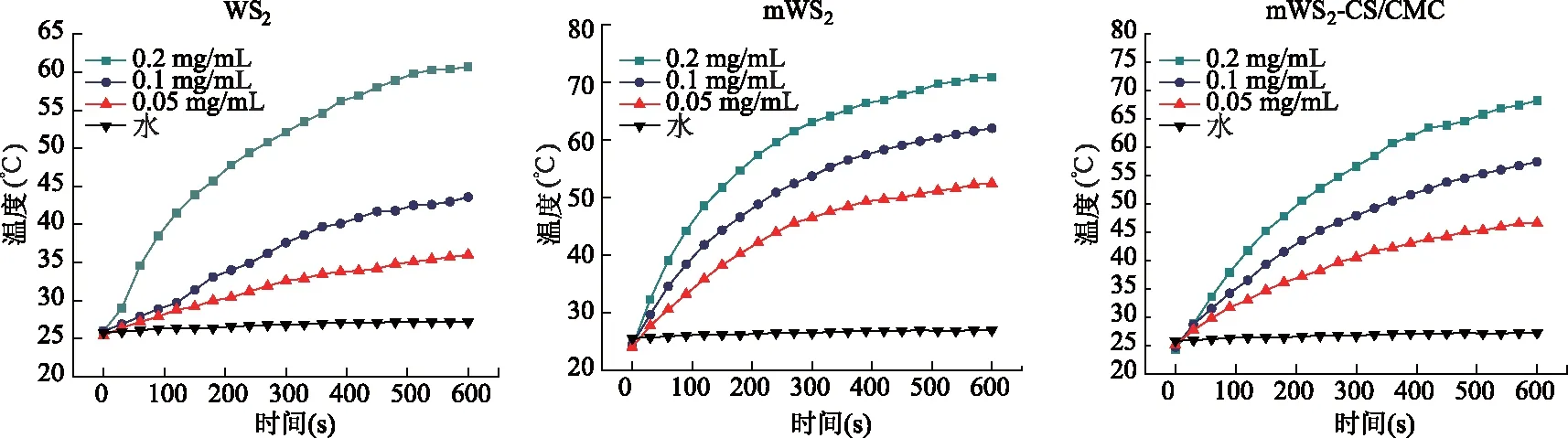
图4 WS2、mWS2和mWS2-CS/CMC的体外升温曲线图
2.5 非特异性蛋白吸附
如图5A所示,WS2吸附率为157.89%,mWS2的蛋白吸附率降至121.96%,mWS2-CS/CMC只有76.21%。结果表明,WS2经过一系列修饰后,表面的亲水性增加,降低了非特异性蛋白的吸附率,避免药物载体材料在进入人体后被巨噬细胞摄取吞噬,降低炎症反应发生的概率,提高药物的疗效和生物利用度。
2.6 药物负载
结果表明,mWS2-CS/CMC的载药量为138.44%,表现出了优异的药物负载量(图5B)。mWS2经过CS和CMC修饰后,其载药稳定性得到极大的改善,在生理环境下基本不会发生聚沉(图5C)。荧光全波长扫描光谱图显示(图5D),当激发波长为488 nm时,DOX在520~650 nm有很强的荧光吸收,而mWS2-DOX、mWS2-CS/CMC-DOX在全波长的荧光强度都很小,说明药物载体mWS2、mWS2-CS/CMC对药物表现出一定的荧光淬灭作用,表明药物成功负载到WS2片层上,而不是吸附在修饰材料表面。

A:WS2、mWS2和mWS2-CS/CMC非特异蛋白吸附率;B:WS2、mWS2和mWS2-CS/CMC的药物负载率;C:DOX(左)、mWS2-DOX(中)及mWS2-CS/CMC-DOX(右)稳定性照片;D:荧光全波长扫描(激发波长为488 nm,扫描波长为520~650 nm)
图5 材料的非特异蛋白吸附和药物负载性能
2.7 药物释放
图6A为mWS2-DOX和mWS2-CS/CMC-DOX在168 h内的药物释放曲线,结果表明,药物在pH5.0溶液中的释放量高于pH7.4环境。从图6B可以看出mWS2-CS/CMC-DOX在有(无)近红外光照射时,药物在酸性条件下的释药率均高于中性,这与体外药物释放曲线一致。

A:不同pH条件下mWS2-DOX和mWS2-CS/CMC-DOX的药物释放;B:4 h内在有(无)近红外光的情况下mWS2-CS/CMC-DOX在不同pH条件下的释放情况
图6 材料的药物释放考察
此外,在pH 5.0时,近红外光照组的释药明显增强,说明近红外光可以促进药物的释放,表现出pH和NIR双响应的释放曲线。人体内的生理环境为中性,而肿瘤部位环境偏酸性。本实验中DOX在偏酸性的环境中释放量大,有利于杀死肿瘤细胞,而减少对正常细胞的伤害。
2.8 细胞摄取和细胞毒性
MCF-7对mWS2-CS/CMC的摄取荧光图显示(图7A),DAPI染色的细胞核产生蓝色荧光,而产生绿色荧光的mWS2-CS/CMC-FITC可以被细胞摄取并且分布在细胞质中,表明所合成的材料生物相容性好,能成功进入癌细胞。
不同浓度梯度mWS2-CS/CMC对癌细胞的杀伤作用表明(图7B),在材料和MCF-7细胞共孵育24 h后,细胞的相对存活率均高于90%,表明mWS2-CS/CMC在一定浓度范围内几乎不存在对细胞的毒性,是一种安全理想的药物载体。从图7C可以看出,载药后的mWS2-CS/CMC-DOX同样可以进入MCF-7,并且对癌细胞产生浓度依赖的杀伤作用,随着浓度的不断升高,细胞的相对存活率不断降低,且修饰后的mWS2-CS/CMC相对于mWS2更容易进入癌细胞,表现出更理想的杀伤效果。
mWS2-CS/CMC在生理条件下具有良好的分散性和稳定性,且载药量高,光热升温性能好,因此可以作为一种优异的药物载体构建光热-化疗联合治疗的纳米平台。体外细胞的光热-化疗联合治疗效果如图8所示,当DOX含量为25 μg/mL时,单一光疗组的细胞存活率约为50%,单一化疗组细胞存活率约为35%,而联合组表现出比单一组优异的细胞杀伤作用,同样时间处理后,细胞存活率降至20%以下。近红外光照射既可以造成一定的光热消融效果,还可以在肿瘤酸性条件下促进药物的释放,使其联合治疗效果达到最大化,从而证明mWS2-CS/CMC作为一种药物载体材料在光热治疗和光热-化疗联合治疗领域表现出了良好的应用潜力。
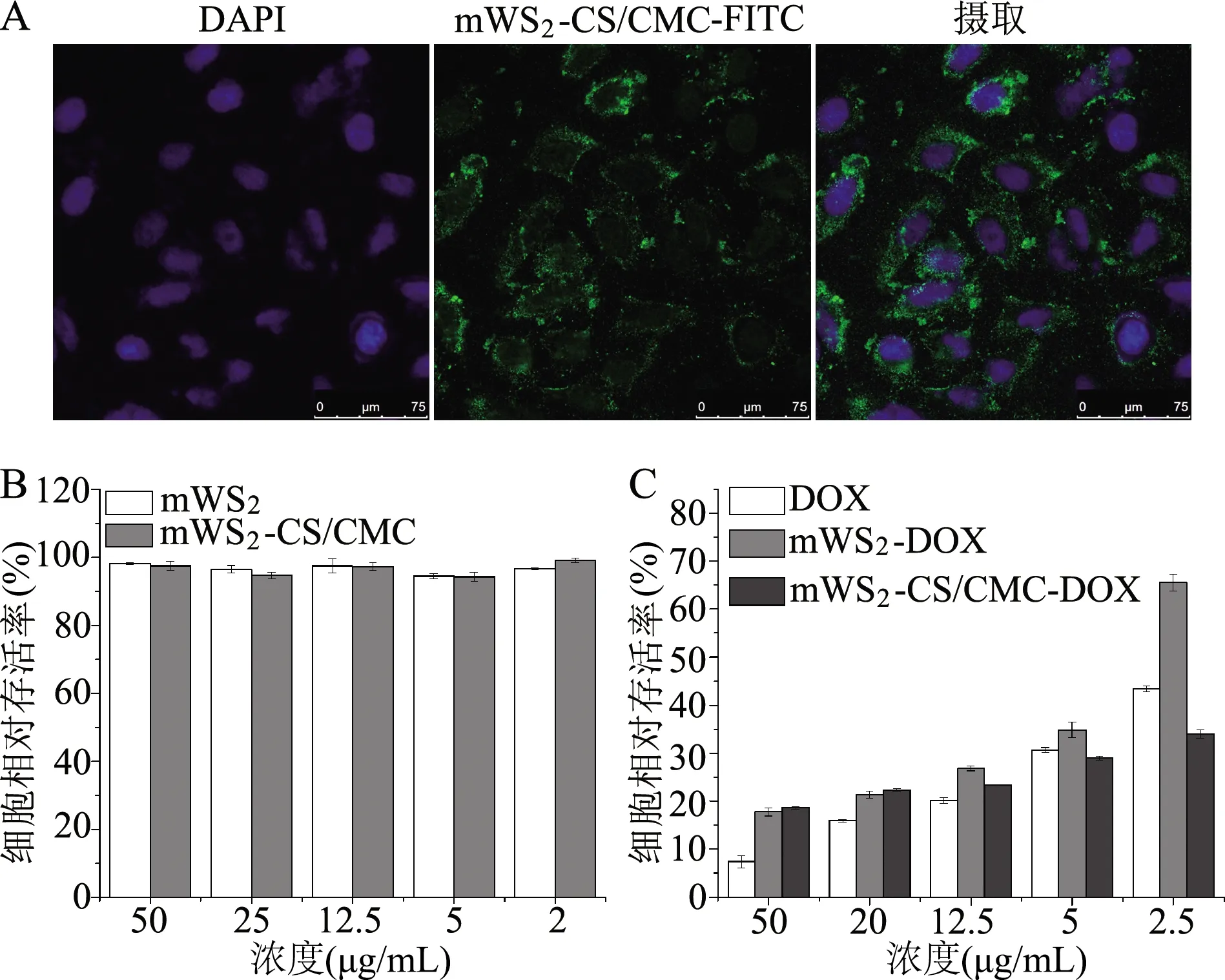
A:MCF-7对mWS2-CS/CMC的摄取荧光图;B:不同浓度mWS2、mWS2-CS/CMC与MCF-7共孵育24 h后的细胞毒性;C:游离DOX、mWS2-DOX、mWS2-CS/CMC-DOX与MCF-7共孵育24 h的细胞存活率
图7 细胞摄取和细胞毒性考察

图8 不同处理组的MCF-7细胞的存活率
3 讨论
近几年,光热治疗因其起效快、治疗时间短、创伤小的优势而得到快速发展。但是激光随着组织深度的增加会减弱,所以需要增加光照功率和时长达到消融理想温度,这将导致对周围正常组织造成不可避免的附带损伤,从而限制其进一步应用。因此,当前的研究热点开始集中于多元协同治疗,通过构建一定的载药平台,取长补短,以达到更加全面的治疗效果。
本课题组之前成功制备了CS/海藻酸钠和CS/葡聚糖自组装修饰的磁性氧化石墨烯[14-15],并考察了其单独光热消融癌细胞的效果,结果显示,当材料浓度达到50 μg/mL时,激光可以对50%左右的癌细胞产生杀伤作用,说明磁性粒子对氧化石墨烯的修饰取得了一定的效果。尽管如此,当适量地降低载体浓度时,磁性氧化石墨烯仍无法达到理想的光疗效果,因此本研究选用光热性能更好的WS2,一种类氧化石墨烯的二维纳米层状材料,并利用生物相容性更加优异的CMC和CS对其进行自组装修饰,制备分散性良好的mWS2-CS/CMC纳米复合材料。
研究发现,所合成的材料具有良好的磁性响应,并且当去掉外磁场后,剩磁很快会消失,表明mWS2-CS/CMC具有超顺磁性,在外加磁场的作用下,可以定向进入肿瘤细胞内,达到高效的药物传递效果。此外,稳定性考察结果表明,其在生理环境中分散性好,稳定性高,且非特异性蛋白吸附量小,进入体内后可以避免自身团聚或对非特异蛋白的大量吸附,从而降低被免疫系统清除吞噬的概率,减少炎症反应发生的同时还可以提高在体内的循环时间,达到长效的药物传递效果。
对药物负载和释放性能的研究显示,mWS2-CS/CMC对抗肿瘤药物DOX有很好的负载能力,且载药稳定性好,体外的药物释放表现出pH和NIR的双响应曲线,酸性条件下NIR照射后可以大量释放药物。由于癌细胞内的酸性环境以及材料磁靶向的定位性能,使其负载的药物在癌细胞内得到充分释放,从而达到理想的治疗效果。mWS2-CS/CMC在体外还具有良好的光照升温效果,在低浓度时,短时间就可以升至光热消融的理想温度,可以作为一种优异的光热转化剂应用于光热治疗领域。细胞实验结果表明,mWS2-CS/CMC可以很好地被MCF-7细胞摄取,并蓄积分布在细胞质中,载体本身对癌细胞几乎不产生毒性,载药后则可以表现出浓度依赖的杀伤特性。
受到之前对磁性氧化石墨烯研究的启发,本研究设计了光热-化疗联合抗癌的实验方案,通过考察单一光疗、单一化疗和联合治疗的效果对其抗癌性能进行评价。研究表明,联合治疗组比单一治疗组表现出更加优异的癌细胞杀伤效果,并且在25 μg/mL时,联合治疗组就可以杀死80%的MCF-7细胞,比磁性氧化石墨烯的效果有了大幅提升。
综上,本研究设计并制备的mWS2-CS/CMC可以作为理想的药物载体应用于癌症治疗领域,为肿瘤的多元多通道治疗提供新的设计思路。
