结肠镜和超声内镜对炎症性肠病诊断和病情评估的价值*
2020-06-09缪佳蓉文韵玲朱云珍缪应雷
缪佳蓉 南 琼 文韵玲 朱云珍 雷 梓 缪应雷&
云南省消化病研究所 昆明医科大学第一附属医院消化内科1(650032)昆明医科大学第一附属医院病理科2
背景:超声内镜(EUS)能清晰显示肠壁层次结构,其用于炎症性肠病(IBD)诊断和活动性评估的价值尚处于探索阶段。目的:探讨结肠镜和EUS在IBD诊断和病情评估中的价值。方法:纳入2017年9月—2019年9月昆明医科大学第一附属医院收治的活动期IBD病例,对其结肠镜和EUS特点进行回顾性分析。结果:共105例活动期IBD患者纳入研究,其中溃疡性结肠炎(UC) 68例,克罗恩病(CD) 37例。Spearman相关系数分析显示,UC患者的溃疡性结肠炎内镜严重度指数(UCEIS)和CD患者的克罗恩病简化内镜评分(SES-CD)均与疾病严重程度呈显著正相关(rs=0.708, rs=0.646; P<0.001)。EUS下UC肠壁多呈对称性增厚,平均厚度(4.46±0.84) mm,以黏膜层增厚为主;CD肠壁多呈非对称性增厚,平均厚度(8.26±1.01) mm,以黏膜下层增厚为主。CD肠壁增厚较UC显著,且更易发现直径>2 mm的脉管结构和瘘管。UC患者黏膜层、黏膜下层厚度和肠壁总厚度均与疾病严重程度呈显著正相关(rs=0.720, rs=0.628, rs=0.671; P<0.001),CD患者各肠壁厚度参数与疾病严重程度均无明显相关性(P>0.05)。结论:结肠镜可诊断和评估IBD病情;EUS有助于鉴别活动期UC与CD,并可通过测量肠壁厚度评估UC疾病严重程度。联合使用结肠镜和EUS可提高IBD的诊治效率。
炎症性肠病(inflammatory bowel disease, IBD)是一种病因尚未明确的慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn’s disease, CD)。近年来,西方国家的IBD发病率趋于稳定,东方国家则呈逐年上升趋势,IBD已成为一种全球性疾病[1]。目前IBD的诊断尚缺乏“金标准”,治疗方案的选择主要取决于病变范围和病情严重程度。因此,早期诊断并准确评估疾病活动性对于IBD的诊治至关重要。在IBD的诸多检查方法中,使用微探头的内镜超声检查(endoscopic ultrasonography, EUS)能清晰显示肠壁层次结构,为IBD的诊治提供了新的途径,但目前关于EUS在IBD诊断中的应用尚无定论,用于评估IBD活动性的价值也仍处于探索阶段[2]。本研究通过回顾性分析IBD患者的结肠镜和EUS图像,探讨两项技术在IBD诊断和病情评估中的价值。
对象与方法
一、研究对象
从昆明医科大学第一附属医院病案数据库中连续选取2017年9月—2019年9月消化内科收治的经内镜和病理确诊的IBD病例。纳入标准:①年龄≥14岁;②确诊IBD,病情评估处于活动期,临床资料完整;③结肠镜检查时接受EUS检查。排除标准:①本人或监护人不同意参与本研究;②患者因耐受性差或不良反应等原因未完成相关检查;③诊断有异议。入组病例根据最终诊断分为UC组和CD组,对两组结肠镜和EUS特点进行回顾性分析。研究方案经昆明医科大学伦理委员会审核批准,入组病例(18岁以上)或其监护人(18岁以下)签署知情同意书。
二、结肠镜和EUS检查经过
EUS检查使用Olympus EU-ME1超声内镜图像处理装置和Olympus UM-G20-29R微型超声探头(探头频率20 MHz)。结肠镜检查使用Olympus CF-Q260AI电子结肠镜。检查前一日流质饮食,检查当日禁食并服用复方聚乙二醇电解质散溶液进行肠道准备。结肠镜检查中观察并记录肠道病变部位、严重程度以及黏膜糜烂、溃疡、息肉等情况。完成结肠镜检查后即行EUS检查,耦合剂使用无菌注射用水。选取病变最明显的部位进行EUS检查,观察并记录下述指标。①肠壁厚度:包括总厚度、黏膜层厚度和黏膜下层厚度,充分注水后于同一截面选取2个部位测量,结果取均值;②肠壁层次变化;③其他特征:包括直径>2 mm的脉管、息肉、肿大淋巴结、脓肿、瘘管等。结肠镜和EUS图像均由2名有5年以上诊断经验的副主任医师采用盲法阅片,结果不一致时经讨论得出一致结论。
三、诊断标准和疾病活动性评估
IBD的诊断符合我国2018年版《炎症性肠病诊断与治疗的共识意见》[3]。对于疾病活动性的严重程度评估,UC采用改良Mayo评分[4],CD采用Best克罗恩病活动指数(Crohn’s disease activity index, CDAI)[5]。病变部位/范围的分类参照蒙特利尔分型[6]。结肠镜下评分UC采用溃疡性结肠炎内镜严重度指数(ulcerative colitis endoscopic index of severity, UCEIS)[7],CD采用克罗恩病简化内镜评分(simple endoscopic score for Crohn’s disease, SES-CD)[8]。
四、统计学分析
结 果
一、一般资料
共105例活动期IBD患者纳入研究,其中UC组68例,CD组37例。UC组男性38例(55.9%),女性30例(44.1%);年龄15~77岁,平均(47.57±15.41)岁;轻度UC 14例(20.6%),中度31例(45.6%),重度23例(33.8%);CD组男性22例(59.5%),女性15例(40.5%);年龄16~64岁,平均(33.38±12.32)岁;轻度CD 13例(35.1%),中度12例(32.4%),重度12例(32.4%)。
UC组病变范围以左半结肠为主(E2;35例,51.5%),其次为广泛结肠(E3;24例,35.3%)和直肠(E1;9例,13.2%)。CD组病变部位以回结肠多见(L3;18例,48.6%),其次为回肠末段(L1;14例,37.8%)和结肠(L2;5例,13.5%),所有患者均无上消化道受累(L4)。
二、结肠镜特点
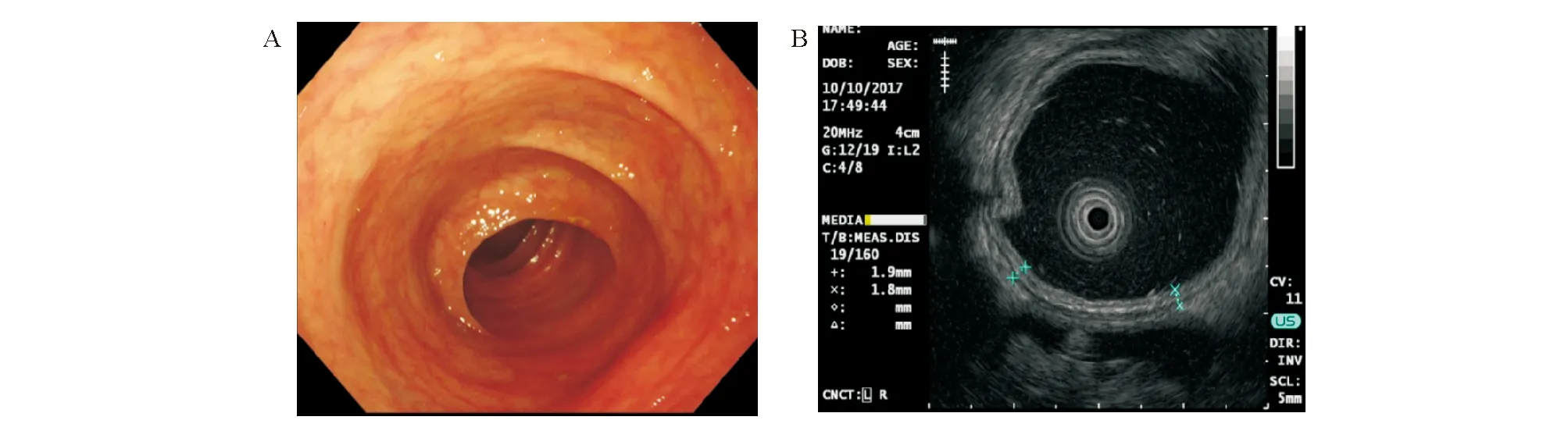
结肠镜下正常结肠黏膜光滑,血管纹理清晰(图1A)。UC患者结肠镜下病变呈连续性、弥漫性分布,黏膜充血水肿、血管纹理消失68例(100.0%),脓性分泌物58例(85.3%),黏膜皱襞消失51例(75.0%),不规则浅溃疡45例(66.2%),出血41例(60.3%),假性息肉34例(50.0%),黏膜桥11例(16.2%),肠腔狭窄5例(7.4%;图2A)。
CD患者结肠镜下病变呈节段性、跳跃性分布,黏膜充血水肿37例(100.0%),多灶性溃疡(>3个)27例(73.0%),纵行溃疡15例(40.5%),假性息肉14例(37.8%),阿弗他溃疡13例(35.1%),铺路石或卵石征11例(29.7%),肠腔狭窄10例(27.0%;图3A)。
三、内镜评分与疾病严重程度的相关性
分别采用改良Mayo评分和UCEIS评分评估UC患者的疾病严重程度和内镜下改变,Spearman相关系数分析显示UCEIS评分与疾病严重程度呈显著正相关(rs=0.708,P<0.001);分别采用Best CDAI评分和SES-CD评分评估CD患者的疾病严重程度和内镜下改变,Spearman相关系数分析显示SES-CD评分与疾病严重程度呈显著正相关(rs=0.646,P<0.001;表1)。因此,IBD患者的内镜评分与临床疾病严重程度密切相关。

表1 IBD患者内镜评分与疾病严重程度的相关性
四、EUS特点
EUS下正常肠壁各层次结构清晰,未见明显增厚(图1B)。UC组63例(92.6%)肠壁增厚,平均厚度(4.46±0.84) mm,以黏膜层增厚为主,多呈对称性增厚;CD组34例(91.9%)肠壁增厚,平均厚度(8.26±1.01) mm,以黏膜下层增厚为主,多呈非对称性增厚。UC组42例(61.8%)黏膜层/黏膜下层界限可辨,59例(86.8%)黏膜下层/固有肌层界限清晰;CD组29例(78.4%)黏膜层/黏膜下层界限可辨,30例(81.1%)黏膜下层/固有肌层界限尚清晰。统计学分析显示,UC肠壁以对称性增厚为特点,CD以非对称性增厚为特点,CD肠壁增厚较UC显著,且更易发现直径>2 mm的脉管结构和瘘管,差异均有统计学意义(P<0.01;图2B、图3B、表2)。
A:结肠镜下降结肠黏膜光滑,血管纹理清晰;B:EUS下降结肠肠壁各层次结构清晰,未见明显增厚

A:结肠镜下降结肠黏膜弥漫性充血水肿、糜烂、溃疡;B:EUS示肠壁全层均匀性增厚,以黏膜层增厚为主,各层层次清晰
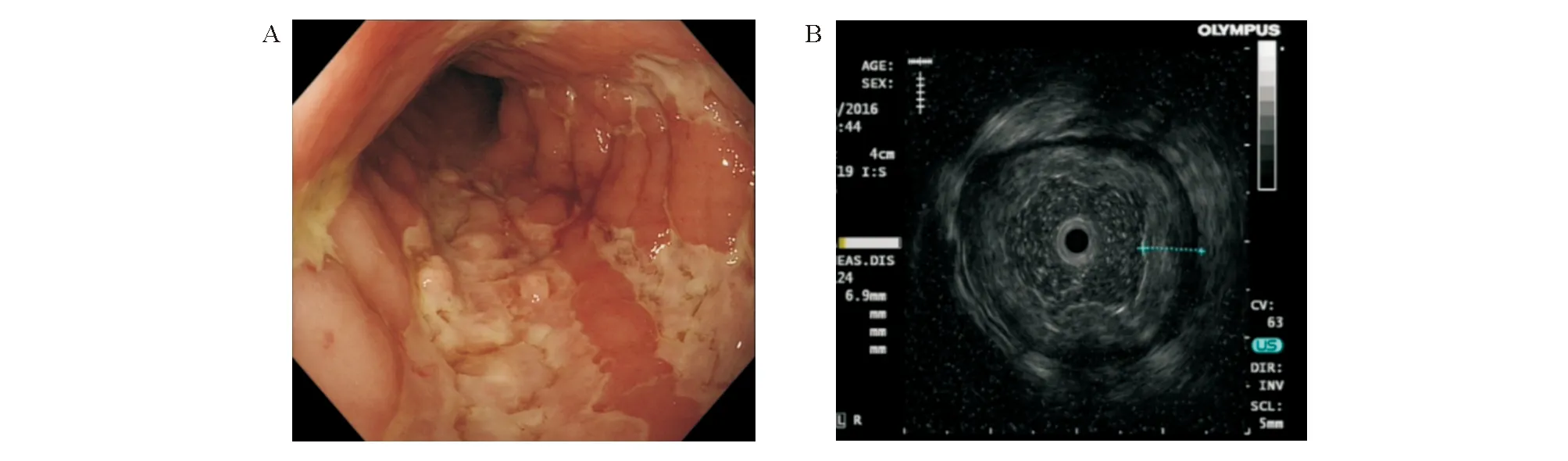
A:结肠镜下降结肠黏膜见多个纵行溃疡,呈铺路石样;B:EUS示肠壁全层不规则增厚,以黏膜下层增厚为主

表2 UC与CD患者EUS下表现比较n(%)
五、EUS下肠壁厚度评估IBD疾病严重程度
活动期UC患者的肠壁总厚度和黏膜层、黏膜下层厚度均随病情加重呈增高趋势,轻、中、重度组间差异有统计学意义(P<0.001);Spearman相关系数分析显示EUS下各肠壁厚度参数均与疾病严重程度呈显著正相关(P<0.001;表3)。
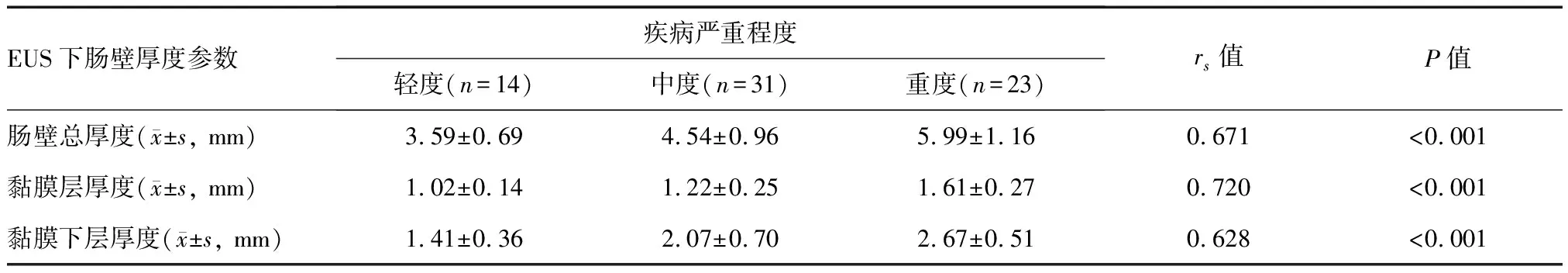
表3 UC患者EUS下肠壁厚度与疾病严重程度的相关性
轻、中、重度活动期CD患者间的肠壁总厚度和黏膜层、黏膜下层厚度差异均无统计学意义(P>0.05);Spearman相关系数分析显示EUS下各肠壁厚度参数与疾病严重程度均无明显相关性(P>0.05;表4)。
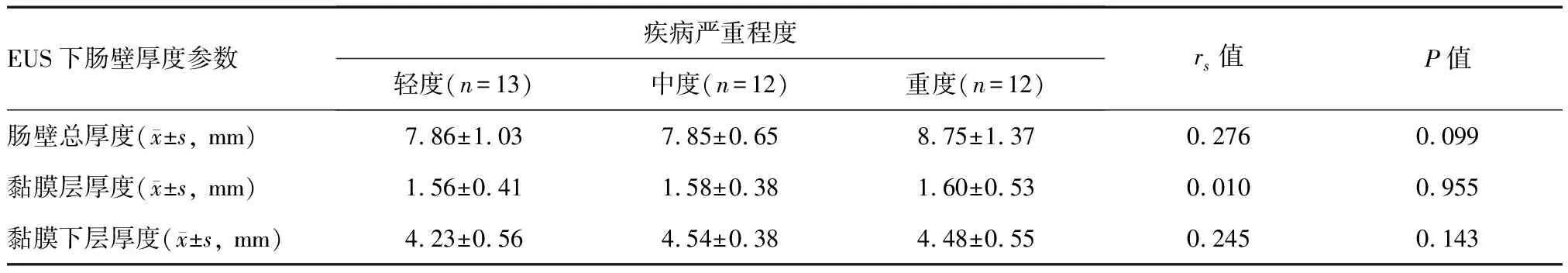
表4 CD患者EUS下肠壁厚度与疾病严重程度的相关性
分别比较轻、中、重度活动期UC与轻、中、重度活动期CD患者的EUS下各肠壁厚度参数,除重度UC与重度CD间黏膜层厚度差异无统计学意义外,其余均为CD组肠壁增厚更为显著,差异有统计学意义(P<0.01;图4)。

图4 UC与CD患者EUS下各肠壁厚度参数比较
讨 论
UC和CD的诊断主要是在排除其他疾病的基础上,结合临床表现、实验室、影像学、内镜检查和组织病理学表现的综合诊断,临床上常出现误诊、漏诊以及诊断困难的情况,其中结肠型CD与UC的鉴别仍是IBD临床诊断中的难题[9]。两者的治疗方案需基于对病变部位、范围和病情严重程度的评估,但目前仍缺乏最佳判断指标。
结肠镜下UC的主要特点为:病变多从直肠开始,呈连续性、弥漫性分布,病变黏膜血管纹理模糊或消失,黏膜充血水肿、质脆、自发或接触性出血、表面覆脓性分泌物,可见多发糜烂或溃疡、结肠袋变浅或消失,部分患者可见假性息肉、黏膜桥等。结肠镜下CD的主要特点为:病变呈节段性、跳跃性、非对称性分布,以末段回肠受累最为多见,罕有直肠受累,并可出现瘘管和肛周病变[10]。本组UC和CD患者的结肠镜下表现与文献报道相符。
临床上有多种内镜评分系统可用于评估IBD的疾病活动性及其严重程度,迄今仍缺乏统一标准[11]。本研究分别采用UCEIS和SES-CD评分评估UC和CD的内镜下表现,结果显示两种内镜评分与临床疾病严重程度之间均存在较好的相关性,可作为IBD病情评估的有效方法。
EUS能清晰显示胃肠道管壁的层次结构,为IBD的诊断、鉴别诊断和治疗提供了新的途径,且具有操作简便、可在结肠镜下发现病灶后即刻进行、不增加患者痛苦的优势。本研究中,UC与CD表现出明显不同的EUS特点:UC病变以黏膜层改变为主,肠壁呈连续对称性增厚,CD以黏膜下层增厚为主,多呈非对称性增厚;CD更易发现直径>2 mm的脉管结构和瘘管;CD肠壁增厚较UC显著,轻、中、重度活动期CD的肠壁总厚度、黏膜下层厚度均显著高于相应疾病严重程度的UC。上述EUS特点与组织学上CD的透壁性炎症、非对称性分布和UC的病变表浅、对称性分布相符。Roushan等[2]的研究评价了EUS测量乙状结肠中段肠壁厚度鉴别结肠UC与CD的准确性,结果显示其敏感性为100%(90.7%~100%),特异性为90.9%(70.8%~98.8%)。Ellrichmann等[12]的研究显示,EUS测量乙状结肠中段黏膜层、黏膜下层厚度和肠壁总厚度与发现局部淋巴结联合,鉴别活动期UC与CD的敏感性为92.3%。既往关于EUS在IBD中应用的研究较少,一些学者探讨了腹壁超声用于IBD评估的价值,分析显示小肠超声检查发现肠壁增厚(>3 mm)、假性分层和局部肠壁血供丰富对于CD的诊断具有重要意义[13];肠壁增厚和局部肠壁血供丰富可反映UC的疾病活动度[14]。但腹壁超声探头频率较低,受肠腔内气体、腹壁脂肪等因素的影响大,图像清晰度不如EUS。
本研究中轻、中、重度活动期UC患者间EUS下肠壁总厚度、黏膜层厚度和黏膜下层厚度差异均有统计学意义,各肠壁厚度参数与UC疾病严重程度呈显著正相关,表明EUS测量肠壁厚度可作为UC病情评估的有效手段。但在CD患者中,尽管轻、中、重度活动期CD患者的肠壁总厚度、黏膜层和黏膜下层均增厚,但各组间差异无统计学意义,各肠壁厚度参数与CD疾病严重程度之间无明显相关性,提示EUS对于CD病情评估无明显价值,其原因可能为不同严重程度CD病变间的炎症浸润深度差异并不显著,也可能与本组CD病例样本量较小有关,后续拟扩大样本量、开展多中心研究对本研究结果加以验证。
综上所述,IBD的诊断、鉴别诊断以及疾病活动性严重程度的评估仍是临床工作中的难点,结肠镜是诊断IBD的首要手段,常用内镜评分UCEIS和SES-CD与IBD临床疾病严重程度之间存在较好的相关性;EUS有助于鉴别活动期UC与CD,并可通过测量肠壁厚度评估UC疾病严重程度。诊断IBD时可联合使用结肠镜和EUS以提高诊断率、准确预测疾病活动性严重程度,从而指导选择最佳治疗方案。
