原发性胃肠道恶性黑色素瘤1例并文献复习
2020-06-09谢转红马文莉李戟玭丁霏霏
谢转红 马文莉 李戟玭 丁霏霏 王 祥
兰州大学第二临床医学院1(730030) 兰州大学第二医院消化内科2
病例:患者女,49岁,因“食欲不振半年余,间断腹胀10余天”于2020年1月8日收治入院。患者半年余前无明显诱因下出现食欲不振、腹胀,无其他消化道症状。既往有高血压病史,入院体检未见阳性体征。生化检查:乳酸脱氢酶(LDH) 471 U/L,血、粪常规检查无异常。胃镜检查:胃底、胃体、胃窦、十二指肠降部可见多发大小不等的黑色素瘤形成,中央凹陷,周边黏膜糜烂隆起(图1)。超声胃镜检查:胃窦部黑色素瘤处胃壁结构存在,黏膜肌层略有增厚。胃底黑色素瘤处胃壁前三层结构消失融合,呈略低回声改变(图2)。病理结果:胃黏膜中见成片黑色素细胞,大部分细胞被黑色素覆盖,少数细胞见大核仁,有深染,异型(图3)。免疫组化染色:CK-p(+),Vimentin(+),S100(+),HMB-45(+),Melan A(+),SOX10(+),Syn(-),CD117(-),Dog1(-),CD34(-),CD30(-),Ki-67阳性细胞数65%。结肠镜检查:回盲部、升结肠、横结肠、降结肠可见大小不等、形态不一的黑色素瘤形成(图4)。胸腹部增强CT:1. 双肺多发结节影,纵隔内淋巴结肿大,考虑转移。2. 胃腔充盈尚可,胃壁未见明显肿块影;肝内多发占位,胃窦旁和肝门部软组织肿块,双侧肾上腺占位,腹膜后肿块,考虑转移。3. 右侧肩胛骨骨质破坏,考虑转移(图5)。头颅MRI:双侧大脑半球、小脑半球、左侧丘脑、桥脑可见多发异常强化影,考虑转移(图6)。SPECT:双侧肩胛骨、肱骨头、部分胸腰椎示踪剂异常浓聚(图7)。患者无皮肤、眼部等处恶性黑色素瘤病史,考虑为原发性胃肠道恶性黑色素瘤。患者已发生双肺、纵隔、肝脏、双侧肾上腺、腹膜、脑、骨转移,为晚期恶性黑色素瘤,TNM分期为Ⅳ期。结合患者家庭经济情况和家属意愿,未进一步行基因检测,遂给予“顺铂+替莫唑胺+重组人血管内皮抑制素注射液(商品名:恩度)”方案治疗,目前尚在正规治疗中。
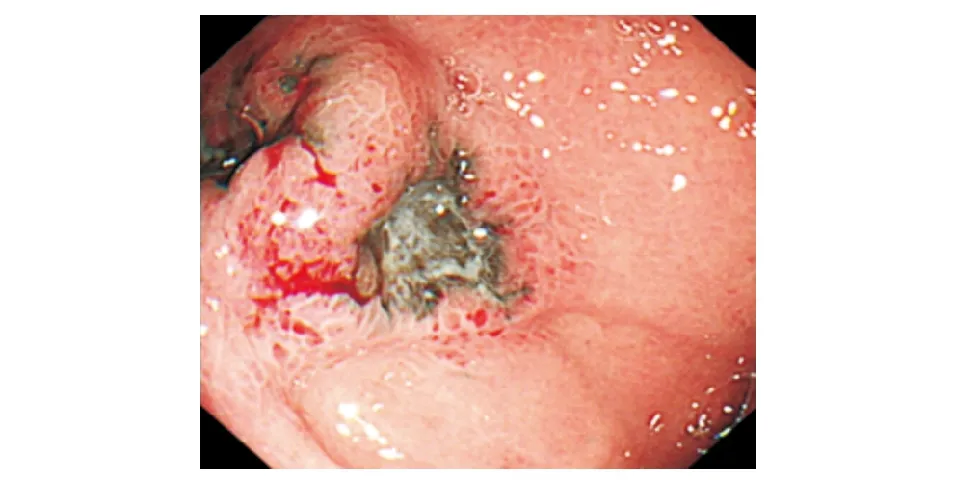
图1 胃镜检查示胃底、胃体、胃窦、十二指肠降部多发黑色素瘤形成

图2 超声胃镜检查示胃窦部黑色素瘤处胃壁结构存在,黏膜肌层略有增厚。胃底黑色素瘤处胃壁前三层结构消失融合,呈略低回声改变

图3 HE染色(×400)示胃黏膜中成片黑色素细胞,大部分细胞被黑色素覆盖,少数细胞见大核仁,有深染,异型

图4 结肠镜检查示回盲部、升结肠、横结肠、降结肠多发黑色素瘤形成

A:双肺多发结节影,纵隔内淋巴结肿大;B:胃腔充盈尚可,胃壁未见明显肿块影;肝内多发占位,胃窦旁和肝门部软组织肿块
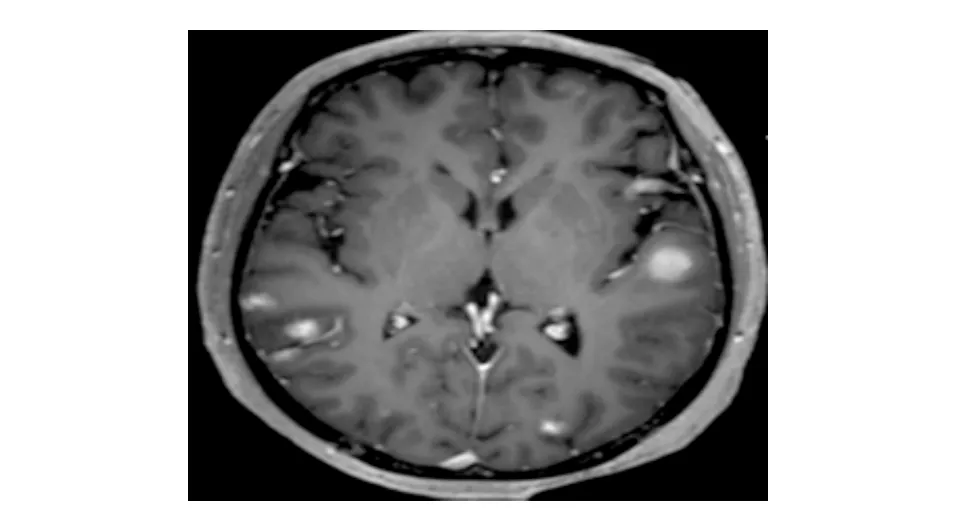
图6 头颅MRI示双侧大脑半球、小脑半球、左侧丘脑、桥脑可见多发异常强化影

图7 SPECT示双侧肩胛骨、肱骨头、部分胸腰椎示踪剂异常浓聚
讨论:恶性黑色素瘤是黑色素细胞发生突变形成的恶性肿瘤,以组织内含有黑色素为特征,好发于皮肤、眼、口腔、消化道、呼吸道、生殖系统的黏膜、眼球的睫状体、虹膜、脉络膜以及脑膜的脉络膜等处。根据基因突变特点,恶性黑色素瘤可分为肢端型、黏膜型、慢性阳光损伤型和非慢性阳光损伤型。其中黏膜型起源于黏膜中的黑色素细胞,按部位可分为头颈部(鼻腔/鼻窦/鼻咽、口腔)、胃肠道(上、下消化道)、生殖道、泌尿道、呼吸道等[1]。据文献报道,发生于皮肤的黑色素瘤的高危因素与严重的日光晒伤史、皮肤癌病史、肢端皮肤色素痣、不恰当处理(切割、针挑等)有关,而黏膜型尚不明确[2]。Cheung等[3]的研究发现,原发性胃肠道黑色素瘤的常见发生部位为口鼻咽(32.8%)、肛管(31.4%)、直肠(22.2%),而食管(5.9%)、胃(2.7%)、小肠(2.3%)、胆囊(1.4%)和结直肠(0.9%)较为少见。
胃肠道恶性黑色素瘤多为其他部位病灶通过淋巴管或血管转移所致(43.5%)[4],呈浸润性生长,预后差,中位生存期<1年。发生胃肠道转移者生前被确诊仅占4%,尸解中发现胃肠道转移者约60%[5-6]。其中51.9%转移至小肠,转移至胃、结肠、直肠肛门的比例分别为33.3%、22.2%、25%[7]。原发性胃肠道恶性黑色素瘤极为罕见,发病中位年龄为59岁,以直肠肛管最多见(64.74%),食管(29.27%)和胃少见(2.67%)[8]。研究发现原发性胃肠道恶性黑色素瘤的发生可能与以下两种发病机制有关:①胃肠内APUD细胞可获得或保留向黑色素细胞脱分化的能力,并随后发生恶性转化。②黑色素细胞向胃肠道异位迁移[9-10]。有研究提出了一种区分原发性支气管黑色素瘤和继发性支气管黑色素瘤的标准,其同样适用于原发性胃肠道黑色素瘤。包括:①手术病理证实的单一孤立的胃肠道黑色素瘤病灶;②既往无切除的皮肤或眼部黑色素瘤病史;③形态学与原发肿瘤相契合;④手术时无其他处可证实的黑色素瘤;⑤仔细尸检,确定患者死因[11]。
原发性胃肠道恶性黑色素瘤的临床表现不典型,常见症状包括腹部不适、腹痛、厌食、恶心、呕吐、消瘦、呕血、黑便、贫血、肠梗阻、肠穿孔等。LDH是目前认为有参考价值的血液学指标。CT、MRI和骨扫描等影像学检查虽不能判断肿瘤的性质,但可了解病变范围和有无发生转移,有助于临床分期的确定和治疗方案的选择。内镜检查是常用的检查手段,大部分肿瘤表面常有不同程度的色素沉着,而当色素形成较少时,易与其他胃肠道肿瘤相混淆,包括间质瘤、神经内分泌癌、低分化腺癌、淋巴瘤和肉瘤等[12]。在检查过程中,对于可疑病灶需行组织病理学检查和免疫组化检查。常用的特征性肿瘤标志物包括S100蛋白、SOX10、HMB-45、Melan A、酪氨酸酶和MITF等。其中S100蛋白的敏感性最高,但特异性较差;而HMB-45、Melan A和酪氨酸酶等特异性较高,敏感性不一。因此联合检测多种标志物可提高黑色素瘤的检出率。此外,Ki-67和cyclin D1可用于肿瘤良恶性的鉴别;基因检测既可用于诊断和鉴别诊断,还可预测分子靶向药物的治疗效果并指导临床治疗,包括BRAF、C-KIT、NRAS、PDGFRA[1,13]。
原发性胃肠道恶性黑色素瘤通常较早发生转移,预后差,1年生存率为83%,2年生存率为57%,5年生存率仅为16%[14]。因此,早发现、早诊断、早治疗可延长患者的生存期。然而目前缺乏有效的治疗方法,90%~95%的患者早期可选择手术切除。但多数患者发现时已属晚期,失去手术机会,其他常见治疗方法有放化疗、免疫治疗、靶向治疗和联合治疗。根据2019 CSCO指南,推荐Ⅳ期黏膜型黑色素瘤的治疗方案为化疗+抗血管生成药物;如携带BRAF V600突变,可选择BRAF抑制剂[1]。本例患者确诊时已发生多处转移,因家庭经济等多种原因,未行基因检测,选用化疗联合抗血管生成药物治疗,目前疗效尚可,但其预后和生存期限不容乐观。
综上所述,原发性胃肠道恶性黑色素瘤极为少见,缺乏典型的临床表现,发现时多为中晚期,且缺乏有效的治疗手段。因此,提高临床医师和辅助科室医师对本病的认识,深入检查并扩展免疫组化技术,早期发现并进行根治性手术是改善患者预后、延长生存期的有效手段。
