温度敏感型富血小板血浆对角膜碱烧伤组织血管内皮细胞形成的影响
2020-06-09彭小维曾桂香杨洋于春红
彭小维 曾桂香 杨洋 于春红
南昌大学第二附属医院儿童眼科(南昌330006)
角膜碱烧伤是眼科常见的而且比较严重的外伤性眼病,烧伤后由于角膜上皮的大量破坏,引起角膜组织感染、溃疡,最终角膜穿孔和新生血管形成导致视力丧失[1-2]。目前角膜碱烧伤临床上主要以药物和手术治疗,治疗方法和效果仍然是眼科的热点和难点。近几年兴起的损伤性修复治疗为角膜上皮组织的修复起到了一定的作用,减少了角膜感染。自体富血小板血浆(platelet-rich plasma,PRP)作为一种损伤修复性生物制剂,近年来已被广泛应用于临床疾病的治疗,包括颌面部创伤愈合[3]、促进周围神经再生[4]、整形美容[5-6]、骨科[7-8]和眼科疾病[9-10]等。在眼表疾病中仍然以局部滴用PRP为主[11-13],由于眼部结构的特殊性,各种血眼屏障的存在,降低了它在眼表的吸收和利用。因此本研究以泊洛沙姆407为基质将其制成温度敏感型富血小板血浆凝胶(temperature sensitive platelet-rich plasma,TSPRP),观察其对兔角膜碱烧伤的治疗效果。
1 材料与方法
1.1 实验动物健康日本大耳白兔(南昌龙平兔业公司)20只,雌雄不限(雌兔未孕),体质量2.0~2.5 kg。
1.2 主要试剂和设备免疫组化用兔CD34抗体(PAB18289):ABNOVA公司,电子恒温水浴锅(ZSXH-618 上海智城分析仪器制造公司),泊洛沙姆407(F127 上海协泰化工公司),1 mol/L NaOH溶液(南昌大学医学院),Olympus 显微镜(上海泽途机电设备公司),PRP(采血制备),血小板计数板(上海医乐医用光学仪器厂),离心机(SC-04 安徽中科中佳科学仪器公司),0.9%NS,分析天秤(FA2104 上海良平仪器仪表公司),全自动血细胞分析(XE-2100 希森美康医用电子公司)。
1.3 兔角膜碱烧伤模型制作及分组置开睑器,0.5%丁卡因麻醉右眼,以直径为10 mm的浸有1 mol/L NaOH溶液的滤纸片贴于角膜上1 min 取下,用NS 冲洗角膜及结膜囊2 min,制备兔角膜碱烧伤模型。采用随机数字表法将兔分为NS组、PRP组、TSPRP组、GBM组4个组,每组5只大耳白兔。分别采用NS、PRP、TSPRP和GBM 点眼,每日4次,连续2 周。
1.4 PRP 制备(1)抽取静脉血放置抗凝管中;(2)用215 g(350 rpm)速度将静脉血离心10 min(常温);(3)吸取全部贫血小板血浆、血小板浓缩物及交界面下少量红细胞放置空白管中,用863 g(1 420 rpm)速度进行第2次离心(常温)10 min;(4)保留少量上清液,将余下液体混合,得到PRP。制备好的PRP 低温保存,3 d 后重新制备。
1.5 TSPRP制备用泊洛沙姆和灭菌注射用水以50%的浓度混合,冰箱(4℃)放置24 h,完全溶解混合均匀制得GBM。再将GBM与PRP 按浓度为23%的比例混均,控制pH 值为7.1,胶凝温度在34℃,即得TSPRP。制备好的TSPRP 低温保存,3 d 后重新制备。
1.6 角膜溃疡和炎症评分标准角膜炎症评分:角膜透明无混浊(0分);角膜轻度混浊可见虹膜纹理(1分);角膜中度混浊看不见虹膜纹理(2分);角膜中度混浊隐约可见瞳孔(3分);角膜重度混浊看不清瞳孔(4分)。角膜溃疡(荧光素钠染色)评分:无着色(0分);染色面积≤1/4 象限(1分);1/4象限<染色面积≤1/2 象限(2分);1/2 象限<染色面积≤3/4 象限(3分);染色面积>3/4 象限(4分)。
1.7 标本采集和免疫组织化学染色2 周后,过量麻醉处死,角膜常规甲醛固定,脱水、浸蜡、包埋、切片。免疫组织化学染色采用SP 法,DAB 显色,CD34抗体浓度为1∶200。微血管判断标准:以CD34表达来标记血管内皮,管腔>8个红细胞、血管有较厚肌层的均不计数,内皮细胞成簇或单个内皮细胞染成棕黄色均作为一个血管计数。每张切片任意取5个视野,测定微血管面密度和微血管数,取平均值。
1.8 统计学方法以()表示实验数据,方差齐性用Bartlett 法检验,用LSD-t检验及方差分析进行组间和组内的多重比较,P<0.05表示差异有统计学意义。
2 结果
2.1 TSPRP配制的TSPRP浓度为23%,pH 值为7.0,刺激试验无充血、流泪、畏光等,血小板平均值为1 016.54×109/L,胶凝温度为34℃。
2.2 角膜溃疡和炎症治疗14 d,裂隙灯下见NS组和GBM组角膜混浊、水肿,上皮缺损,溃疡明显,角膜炎症和溃疡评分经LSD-t检验,差异无统计学意义(P>0.05);PRP组和TSPRP组角膜上皮完整,基质周边清亮、中央混浊和水肿,透过周边可见部分虹膜,角膜炎症和溃疡评分与NS组比较,经LSD-t检验,差异有统计学意义(P<0.05);TSPRP组与PRP组相比,角膜透明性较好,新生血管少,角膜炎症和溃疡评分经LSD-t 检验,差异有统计学意义(P<0.05)。角膜炎症和溃疡评分见表1和表2。
表1 角膜炎症评分Tab.1 Corneal inflammation scores(n=5)±s

表1 角膜炎症评分Tab.1 Corneal inflammation scores(n=5)±s
注:P<0.05(F = 238.29);GBM与NS组P>0.05(t = 1.20)、PRP和TSPRP与NS组比较P<0.05(t=14.35、22.73)、TSPRP与PRP组P<0.05(t=8.37)
组别NS GBM PRP TSPR即刻4.0±0 4.0±0 4.0±0 4.0±0 3 d 4.0±0 3.9±0.4 3.8±0.5 3.7±0.8 5 d 3.8±0.4 3.7±0.8 3.0±0.5 2.8±0.6 7 d 3.5±0.5 3.5±0.4 2.7±0.6 2.2±0.8 10 d 3.0±0.4 2.9±0.6 2.0±0.5 1.3±0.3 14 d 2.6±0.5 2.5±0.8 1.4±0.4 0.7±0.5
表2 角膜溃疡评分Tab.2 Corneal ulcer scores(n=5) ±s
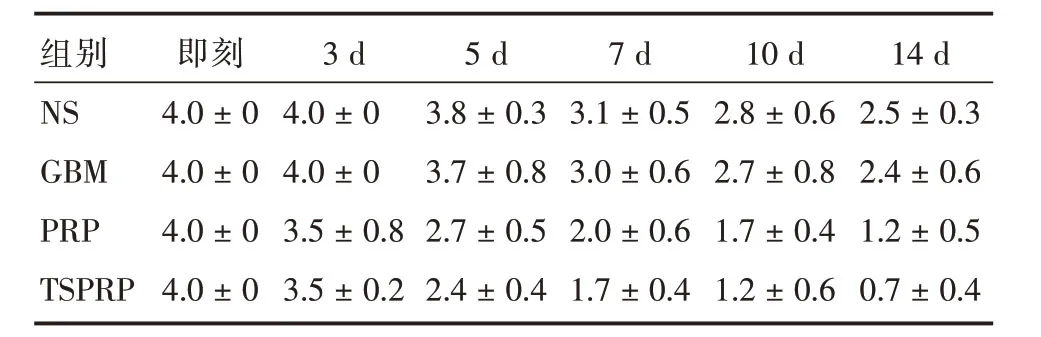
表2 角膜溃疡评分Tab.2 Corneal ulcer scores(n=5) ±s
注:P<0.05(F = 137.60);GBM与NS组无P>0.05(t = 1.00)、PRP和TSPRP与NS组比较P<0.05(t = 13.00、18.00)、TSPRP与PRP组P<0.05(t=5.00)
组别NS GBM PRP TSPRP即刻4.0±0 4.0±0 4.0±0 4.0±0 3 d 4.0±0 4.0±0 3.5±0.8 3.5±0.2 5 d 3.8±0.3 3.7±0.8 2.7±0.5 2.4±0.4 7 d 3.1±0.5 3.0±0.6 2.0±0.6 1.7±0.4 10 d 2.8±0.6 2.7±0.8 1.7±0.4 1.2±0.6 14 d 2.5±0.3 2.4±0.6 1.2±0.5 0.7±0.4
表3 微血管数和微血管面密度Tab.3 Microvascular number and surface density(n=5)±s

表3 微血管数和微血管面密度Tab.3 Microvascular number and surface density(n=5)±s
注:NS与GBM组P>0.05(ta = 1.20,tb = 0.38)、PRP和TSPRP与NS组 比 较P<0.05(ta = 6.32和7.85,tb = 3.92和6.01)、PRP与TSPRP组P<0.05(ta=2.31,tb=3.10)
组别NS GBM PRP TSPRP微血管数(个/mm2)a 21.00±2.64 21.12±1.86 15.50±0.85 13.21±0.25微血管面密度b 0.081 2±0.000 4 0.077 4±0.000 3 0.042 0±0.000 1 0.011 0±0.000 2
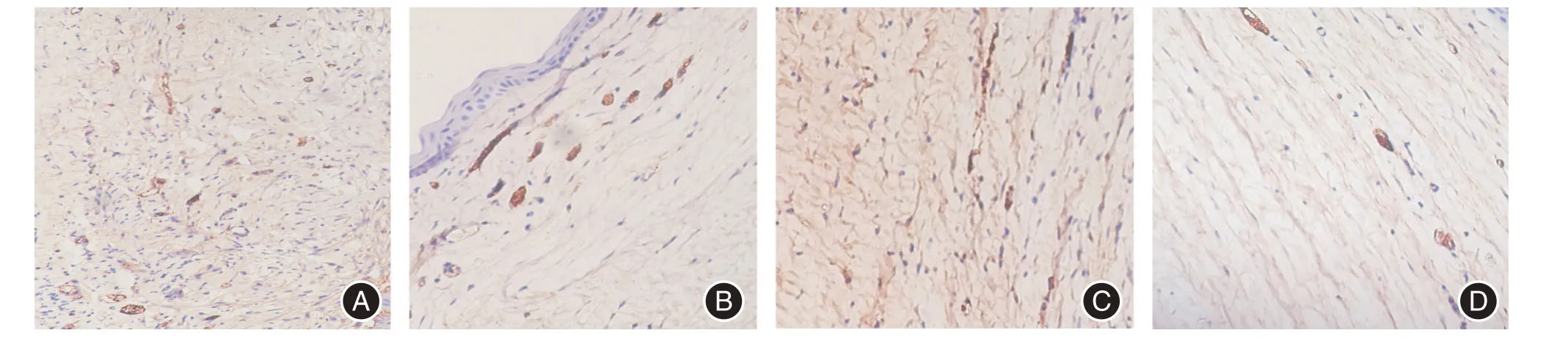
图1 免疫组织化学染色(×400)Fig.1 Immunohistochemical staining(×400)
3 讨论
正常角膜在多种因素共同作用下处于稳定的“血管赦免”状态而保持角膜的透明性,这也是角膜发挥正常生理功能的基础。然而各种疾病的损伤破坏,会造成这种平衡状态被打破,从而促进新生血管的形成。角膜中含有多种血管生成因子,能够促进血管内皮细胞的迁移和增殖,增加血管的通透性,促使新生血管的生成,而且大多数抗血管生成因子,例如血管内皮生长因子、内皮抑素、凝血细胞反应素和血管抑素等在角膜上皮高表达[14]。因此,眼表的损伤性修复被认为是损伤愈合的关键,重组牛碱性成纤维细胞生长因子[15-17]和小牛血清去蛋白眼用凝胶[18]等是目前临床上常用的眼表损伤修复药物,这些外源性的生物制剂存在免疫排斥反应从而使角膜损伤性修复效果不是很满意,造成角膜新生血管,所以寻找一种新的可行的角膜损伤修复药物就成为研究的重点。
PRP 因富含有各种组织细胞修复所需的大量生长因子和细胞因子,如转化生长因子β、血管内皮生长因子、碱性成纤维细胞生长因子、血小板源性生长因子、胰岛素样生长因子等[19-20],对组织的再生和修复有很好的促进作用,可减少角膜新生血管的生成。RONCL 等[21]和PANDA 等[22]通过研究,发现PRP 能够促进角膜上皮缺损的再愈合,缩短修复时间,降低感染率和角膜新生血管发生率,促进视力的恢复。本研究将PRP 滴于角膜碱烧伤动物模型眼表,治疗14 d 后,角膜上皮修复完整,周边角膜清亮,透过角膜可见部分虹膜,治疗效果与SHABAN 等[13]报道相似。但是本实验中发现PRP 滴于眼表难以通过角膜和血房水屏障,再加上泪液对药物的稀释和冲洗、泪道的引流等,从而降低了它在眼部的生物利用度。
为了解决这个问题,笔者利用温敏剂泊洛沙姆和PRP 制成TSPRP。通过对照实验,观察角膜炎症和溃疡的变化,采用免疫组织化学染色对新生血管内皮细胞进行计数和测定微血管面密度。治疗14 d 后发现TSPRP组在角膜炎症控制、角膜上皮修复,以及微血管数和微血管密度上都明显好于PRP组,两者比较存在差异。分析原因可能是由于这种凝胶在常温下成液态,滴于眼表后形成凝胶状态,能将其携带的药物束缚于分子间隙中,使其具有很好的亲水性,控制药物的释放,延长药物与给药部位的接触时间,提高药物的眼部生物利用度。本研究结果提示在未来的眼科药物中可以采用温敏型制剂等新型给药系统,以提高药物的眼部生物利用度,减少局部给药次数和给药剂量,方便患者给药,降低药物的不良反应。
本实验在观察微血管数和微血管密度时采用抗CD34染色,主要是由于目前除了较为常用的抗体CD31、CD34、Ⅷ因子等,显示血管内皮细胞的抗体种类繁多[23]。CD34 不仅能显示微血管内皮细胞,在正常血管特别是大血管中也能表达,所以抗CD34染色能够理想地显示新生的、微小的、不成熟的血管,以及原先存在的大血管[24];另外CD34也是内皮细胞分化的高度敏感性标志物,因此抗CD34 对新生内皮细胞染色具有背景染色清晰、对比度高、轮廓明显、染色较正常内皮细胞更深等优点,所以它是重复性最理想的内皮细胞标记物[25]。因此本研究选用CD34抗体进行免疫组织化学染色。
综上,温度敏感型给药系统由于生物利用度高,相对毒副作用少,已成为药剂学和临床研究中的热点,在眼科用药中也体现了它的优势。但是温度敏感型给药系统在眼科中的应用还面临很多实质性的问题,影响药物分布和释药的因素很多,包括药物本身的理化参数、载体的种类、制备的工艺等,诸多因素尚在探索中。
