二维液相色谱测定氨磺必利血药浓度的临床应用分析
2020-06-08姚树永钱正康
尚 翔,姚树永,刘 威,钱正康
0 引言
精神分裂症是一种具有严重致残、高复发性的慢性迁徙性精神疾病[1],研究显示,中国地区精神分裂症的患病率约为0.42%[2],临床对于精神分裂症的治疗仍然以药物为主。近年来,非典型抗精神病药物已逐渐作为首选药物广泛应用于各类型精神分裂症的治疗。氨磺必利在2010年引进中国,其因具有低发生率的锥体外系反应而广泛应用,然而较少有资料研究氨磺必利在中国人群中的血药浓度情况。有报道,氨磺必利的血药浓度与锥体外系不良反应具有正相关关系[3]。本研究对精神分裂症住院患者179例次的氨磺必利血药浓度数据进行统计与分析,旨在探讨和分析影响患者氨磺必利血药浓度的因素。
1 资料与方法
1.1 一般资料 采用回顾性调查方法,选择2018年7月至2019年4月我院被诊断为精神分裂症[符合国际疾病与相关健康问题统计分类第10版(ICD-10)标准]并接受氨磺必利治疗的住院患者;排除服药依从性差、未达到稳态浓度和患有严重肾脏疾病的患者。通过收集整理性别、年龄、用药剂量和血药浓度监测结果,最后共收集179例作为研究对象,其中男147例,女32例,年龄13~78岁,平均(36.27±13.45)岁。
1.2 样品处理 血液样品低速离心(3 500 r/min)5 min,准确吸取ORG-1去蛋白剂1 000 μl至1.5 ml的EP管中,再准确加入400 μl血清,涡旋振荡1 min后,高速离心(14 500 r/min)8 min,取1 000 μl上清液至1.5 ml进样瓶中,振荡摇匀,备用。
1.3 氨磺必利测定方法 采用FLC 2701全自动二维液相色谱系统(湖南德米特仪器有限公司)进行氨磺必利血药浓度的测定,测定方法:系统中一维液相色谱柱为Aston SX1(4.6 mm× 25 mm,5 μm),流动相为CAA-1D萃取剂,流速0.7 ml/min;中间色谱柱Aston SCX2(4.6 mm×10 mm,5 μm);系统中二维色谱柱为Aston SN(4.6 mm×50 mm,5 μm),流动相为碱∶酸∶甲醇∶乙腈=48∶24∶10∶18(体积比),流速1.2 ml/min。柱温40 ℃,检测波长282 nm,在进样体积300 μl的条件下测定氨磺必利。其基本原理是第一维色谱柱负责样品萃取富集以及初步分离,通过中间柱转移到第二维色谱柱,第二维色谱柱负责进一步分离检测。所用试剂均购自湖南德米特科技有限公司。
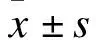
2 结果
2.1 二维液相色谱适用性 提取回收率是体现二维液相色谱系统准确性的重要指标。本研究采用的FLC 2701全自动二维液相色谱系统在低、中、高浓度组中提取回收率分别为93.41%、93.76%、95.41%(表1)。日内、日间精密度均<4.34%。研究采用的测定氨磺必利血药浓度的方法通过英国政府化学家实验室(Laboratory of the Government Chemist,LGC)认证,结果可靠,准确性和测定范围等满足要求,可以作为临床氨磺必利治疗药物监测的可靠方法。
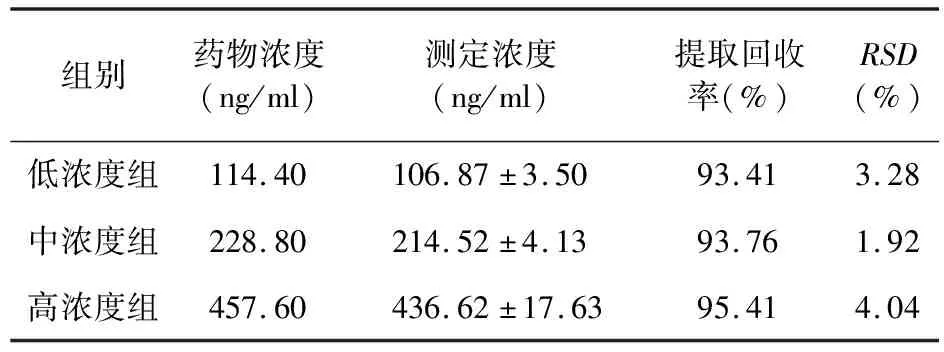
表1 二维液相色谱提取回收率
2.2 剂量与血药浓度 选择2018年7月至2019年4月在我院住院服用氨磺必利的179例患者,监测结果显示,患者服用氨磺必利后平均血药浓度为567.93 ng/ml,在有效浓度(100~320 ng/ml)[4]内的患者仅占19.89%,而高于有效浓度范围和超过警戒值(640 ng/ml)的比例高达77.89%。见表2。在服用相同剂量的氨磺必利情况下,不同患者血药浓度个体差异明显。见图1。

表2 氨磺必利剂量与血药浓度的关系
2.3 年龄与血药浓度 不同年龄段中,氨磺必利平均血药浓度水平远高于神经精神药理学与药物精神病学协会(AGNP)推荐的有效浓度范围。见表3。

图1 氨磺必利剂量下血药浓度分布
2.4 性别与血药浓度 男性患者氨磺必利平均血药浓度为548.88 ng/ml,女性为631.45 ng/ml,女性患者平均血药浓度略高于男性患者,差异无统计学意义(P=0.16)。见表4。

表3 不同年龄段患者氨磺必利血药浓度水平

表4 不同性别患者氨磺必利血药浓度水平
不同性别患者氨磺必利血药浓度分布见表5。高于有效浓度和在有效浓度范围内的患者中,男性均显著多于女性(P=0.01)。此外,女性相较于男性患者,较少使用氨磺必利,这可能是由于氨磺必利会导致血清催乳素升高,从而引起泌乳、闭经等不良反应[5]。
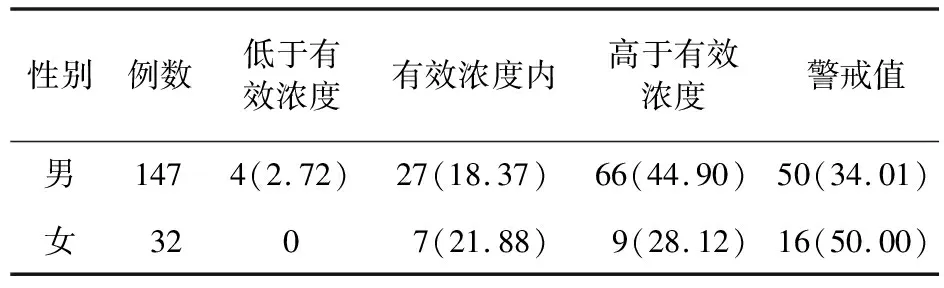
表5 不同性别患者氨磺必利血药浓度分布[例(%)]
3 讨论
氨磺必利是苯酰胺类第2代抗精神病药物,对突触前及突触后多巴胺D2/D3受体具有双重阻断作用[6]。在低剂量时,氨磺必利能够阻断突触前多巴胺D2/D3受体,造成负回馈机制的中断,使多巴胺释放增加,改善阴性症状;高剂量时能够阻断突触后多巴胺D2/D3受体,抑制多巴胺神经信号的传导,从而改善阳性症状。最新研究显示,氨磺必利对抑郁症以及呕吐有治疗作用[7-8]。氨磺必利药物不良反应涉及多个系统,主要包括神经系统异常、心血管异常以及内分泌系统异常,其中锥体外系反应和催乳素升高较为常见[9]。氨磺必利在临床中起始推荐剂量为200~400 mg/d,根据患者病情严重程度,剂量应当做出相应调整,大部分患者目标剂量为800~1 000 mg/d,最大剂量1 200 mg/d[10-11]。
研究显示,中国人群中氨磺必利的血药浓度水平明显高于AGNP推荐的有效浓度范围。同时,王占璋等[12]采用高效液相色谱-质谱联用法测定患者的氨磺必利浓度,发现成人患者服用氨磺必利后平均血药浓度为374.75 ng/ml。Wang等[13]采用超高效液相色谱串联质谱法监测抗精神分裂症药物氨磺必利的血药浓度,结果表明,中国人群中氨磺必利血药浓度水平为445.2 ng/ml。两项研究中氨磺必利血药浓度都高于AGNP中推荐范围。
氨磺必利血浆蛋白结合率约17%[14],表明身体中血浆蛋白水平的波动对氨磺必利的血药浓度影响小于血浆蛋白结合率高的药物。氨磺必利在服用吸收后呈现双高峰,分别出现于服药后1 h和3~4 h。除高碳水化合物饮食减少吸收外,食物不影响生物利用度。氨磺必利主要经肾脏(70%)以原型从尿液中排泄,另外,约15%经胆汁分泌,通过肠道排泄,很少经肝代谢[15],所以肝脏功能对氨磺必利的排泄影响较小。健康老年人和肾功能减退者肾脏清除功能减弱,其氨磺必利排泄能力可能会有一定程度下降。
有报道,在联合用药中,锂盐和氯氮平[16]对氨磺必利的血药浓度水平有较大影响。锂盐的肾毒性造成肾排泄功能下降,从而导致氨磺必利排泄减慢,进而浓度升高;氯氮平的代谢产物N-去甲氯氮平可能与氨磺必利竞争肾脏中的转运体,导致二者排泄的速度减慢。血药浓度较高可能会导致不良反应发生率升高。基因多态性是目前个体化用药差异研究的热点。人体多药耐药基因(ABCB1)负责编码P-糖蛋白(P-gp)。后者是一种跨膜蛋白,存在于质膜中,依赖ATP介导底物转运[17]。近年研究发现,一些抗精神病药物是P-gp的底物,如氨磺必利、帕利培酮和利培酮[18-19]。体外研究显示,ABCB1 1199G>A多态性能够引起P-gp介导的抗精神病药氨磺必利转运和分布的改变,从而影响氨磺必利的血药浓度[20]。
AGNP是根据西方国家的研究所制定的血药浓度参考范围,其能否切实地符合中国人群值得深入研究。已有研究表明,中国人群中氨磺必利血药浓度水平明显高于AGNP推荐的有效浓度范围。因此,针对氨磺必利的治疗药物监测制定出符合中国人群的特异性治疗参考范围十分迫切,有助于提高中国患者的用药安全性。此外,本研究中涉及的样本数有限,结果可能有失偏颇,下一步应当继续扩大样本数量,进行深入研究。
