响应面试验设计优选山楂最佳蜜制工艺
2020-06-08敖楠楠叶斌斌姜明月
敖楠楠,才 谦,曲 扬,叶斌斌,姜明月,郑 彧
0 引言
山楂为蔷薇科植物山里红(CrataeguspinnatifidaBge.Var.majorN.E.Br.)或山楂(CrataeguspinnatifidaBge.)的干燥成熟果实,具消食健胃、行气散瘀、化浊降脂之功效,用于肉食积滞、胃脘胀满、泻痢腹痛、淤血经闭、产后瘀阻、心腹刺痛、胸痹心痛、疝气疼痛及高脂血症[1]。近年来,有研究表明,山楂对于心脑血管系统疾病有很好的治疗作用[2-4],已应用于冠心病、高血脂的临床治疗[5-7]。中国药典收载的饮片有生山楂、炒山楂、焦山楂。由于传统炮制过程中的高温会使黄酮类成分有不同程度的下降,而黄酮类成分是降血脂以及治疗心血管疾病的主要药效物质,所以导致炮制品在降血脂以及治疗心血管系统疾病方面的作用低于生品[8]。临床上,山楂与蜂蜜联用已用于冠心病的预防和治疗[9-10],可能是由于蜂蜜具有补中益气、缓急止痛的功效[11-12]。有报道,有些中药蜜制后会使部分黄酮苷、多糖等有效成分的含量升高[13-16],因此,以蜂蜜作为山楂炮制辅料具有一定的研究意义。根据中药炮制学辞典及地方志中记载,山楂还有蜜制、蜜制楂炭等炮制方法[17-18],但未对蜜制工艺进行规范。本实验就山楂蜜制工艺展开试验,筛选山楂蜜制品的最佳炮制工艺,为山楂炮制品的药效研究提供新的理论依据,为山楂更合理的临床应用奠定基础。
1 材料
1.1 仪器与设备 高效液相色谱仪(CBM-10A VP Plus);SPD-10AVP紫外检测器(日本岛津公司);AE240十万分之一分析天平(瑞士MettLer公司);电子天平(日本岛津AY220)50 g手提式高速万能粉碎机(温岭市林大机械有限公司);手动可调式移液器(百灵威科技有限公司);KQ-250DB数控超声波清洗器(功率:300 W,频率:50 kHz,昆山市超声仪器有限公司);石英比色皿(宜兴市亮光高科分析仪器厂);电热恒温鼓风干燥箱(上海精宏实验设备有限公司,phq-9246A);旋转蒸发仪(上海荣亚生活仪器厂,型号:RE3000C),SHZ循环水式多用真空泵[河南省予华仪器有限公司,型号:SHZ-D(Ⅲ)]。
1.2 材料与试剂 山楂饮片(购于阳光大药房,批号:180301,产地:山东),异槲皮苷对照品(批号:wkq18022308)、儿茶素对照品(批号:wkq18013103)、表儿茶素对照品(批号:wkq1801603)、金丝桃苷(批号:wkq18111901)及原花青素B2(批号:wkq18042608)均来自四川维克奇生物科技有限公司,纯度均为:HPLC≥98%,蜂蜜(江西意蜂实业有限公司,批号:20180505,产品标准号:GB14963),葡萄糖(江苏永健医药科技有限公司,批号:110833-201409,纯度>98.0%),苯酚(分析纯),浓盐酸(分析纯),甲醇(色谱纯),乙腈(色谱纯),娃哈哈纯净水。
2 方法与结果
2.1 HPLC法测定儿茶素、表儿茶素、原花青素B2、金丝桃苷、异槲皮苷含量
2.1.1 色谱条件 Welchrom C18色谱柱(4.6 mm×250 mm,5 μm),流动相:0.1%冰醋酸水溶液(A),甲醇-乙腈(B)(1∶2),梯度洗脱(0~25 min,8%~25% B;25~30 min,25%~28% B;30~40 min,28%~32% B;40~45 min,32%~35% B),体积流量:1 ml/min;柱温:30 ℃;检测波长:280 nm、360 nm。进样量:20 μl。
2.1.2 对照品溶液的配制 精密称取原花青素B2、表儿茶素、儿茶素、金丝桃苷和异槲皮苷0.005 g,原花青素B2、表儿茶素、儿茶素用蒸馏水定容至5 ml容量瓶中得到混合对照品A;金丝桃苷、异槲皮苷用甲醇定容至5 ml容量瓶中,得到混合对照品B。最后稀释得到各混合对照品溶液中原花青素B2、表儿茶素、儿茶素、金丝桃苷和异槲皮苷浓度为0.358 67、0.337 33、0.351 33、0.057 4、0.056 6 mg/ml。
2.2 紫外分光光度法测定多糖含量[19]
2.2.1 测定方法 精密吸取多糖溶液于干净具塞试管中,加蒸馏水补充至2 ml,按照顺序依次加入1 ml 5%苯酚溶液,摇匀,再加入浓硫酸5 ml,振荡摇匀,静置10 min,20 ℃水浴20 min,在490 nm下测定吸光度值。
2.2.2 对照品溶液配制 精密称取葡萄糖标准品0.1 g,蒸馏水定容至1 L容量瓶中,得到0.1 mg/ml的葡萄糖标准品溶液。
2.3 山楂蜜制品的制备 将蜂蜜倒入锅内,加热至徐徐沸腾,改用文火保持微沸,除去上浮泡沫和蜡质,再炼制沸腾起鱼眼泡,炼制滴水成珠[12]。精密称取炼蜜一定质量,1∶1加入蒸馏水混匀后,加入山楂饮片搅拌,闷润6 h,放入烘箱中烘制,以不沾手为度,取出,放凉,得到山楂蜜制品,备用。
2.4 供试品溶液制备 将山楂饮片40 ℃烘干至恒重,精密称取样品粉末(过2号筛)2 g,炮制品按比例折合称取样品,置于50 ml锥形瓶中,加入1∶10的水,超声提取40 min后离心,离心后吸取上清液定容至50 ml,1∶3比例加入无水乙醇,水提醇沉,静置12 h,抽滤,滤渣用无水乙醇洗2~3次,得到的上层沉淀转移至25 ml容量瓶中用蒸馏水定容,用于测定多糖的测定;下层滤液减压浓缩用蒸馏水定容至5 ml,用于HPLC分析。HPLC色谱图结果见图1。
2.5 方法学考察
2.5.1 线性关系考察 ①取“2.1.2”项下2种混合对照品溶液,混合对照品A稀释0、2、5、10、15倍,混合对照品B稀释0、2、4、6、8倍。在“2.1.1”项色谱条件下进行分析,以溶液浓度为横坐标(X),以峰面积为纵坐标(Y)进行线性回归分析。②取“2.2.3”项下葡萄糖标准品溶液,精密吸取0、0.2、0.4、0.6、0.8、1.0、1.2 ml的葡萄糖标准品溶液于干净的具塞试管中,按照“2.1.2”项的多糖测定方法进行测定,以溶液浓度为横坐标(X),吸光度值为纵坐标(Y),进行线性回归分析,结果见表1,可知各成分在测定范围内线性关系良好。
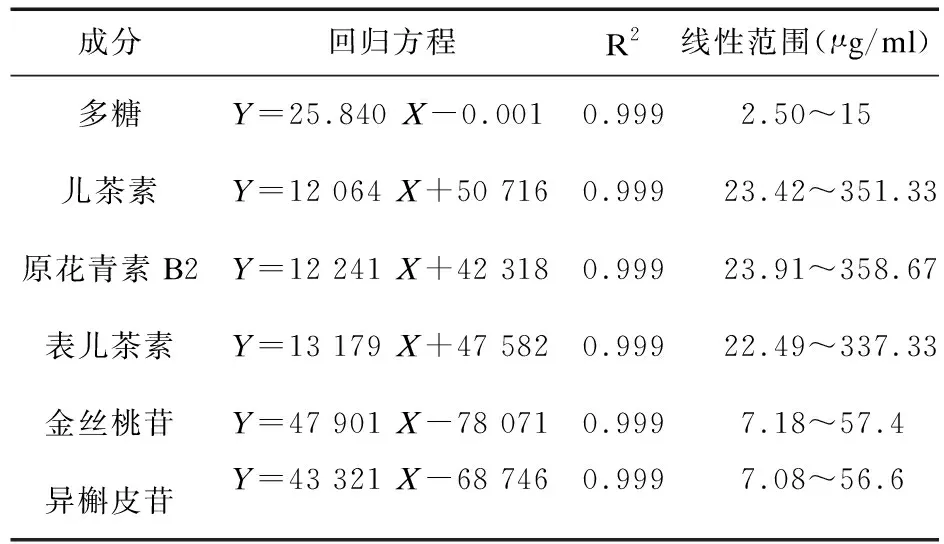
表1 各成分线性关系
2.5.2 精密度试验 取相同的供试品溶液,在“2.1.1”项色谱条件下测定6次,测定各峰面积RSD值为1.97%~2.67%,测得多糖的吸光度值为2.15%~3.01%。
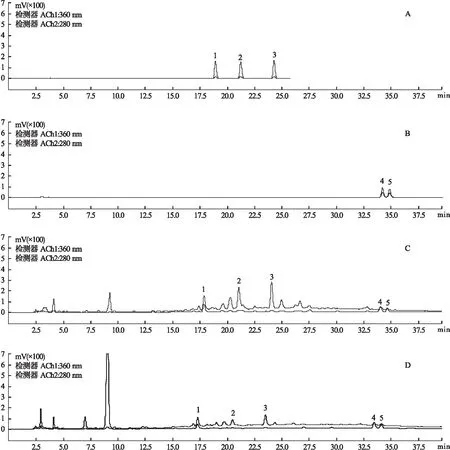
图1 各成分测定色谱图
2.5.3 稳定性试验 取相同供试品溶液,在“2.1.1”项色谱条件下于0、2、4、8、12、24 h进样和测定吸光度值,测得各成分峰面积RSD值为2.02%~2.55%;取相同供试品溶液,在“2.1.2”项色谱条件下于0、2、4、6、8、10、12 h后测定多糖的吸光度值为1.98%~2.38%之间。
2.5.4 重复性试验 精密称取相同药材粉末6份,按照“2.4”项制备供试品溶液,在“2.1.1”项色谱条件下进行测定,测得各成分峰面积RSD值为2.14%~2.97%,多糖的吸光度值为2.75%~3.11%。
2.5.5 加样回收率试验 精密称取蜜制山楂粉2 g,共6份,每份中加入儿茶素对照品0.82 mg、原花青素对照品1.38 mg、表儿茶素对照品1.93 mg、金丝桃苷对照品0.31 mg、异槲皮苷对照品0.28 mg,按照“2.4”项方法制备供试品溶液,在“2.1.1”项色谱条件下进行测定,测得儿茶素、原花青素B2、表儿茶素、金丝桃苷、异槲皮苷的平均加样回收率分别为97.18%±2.87%、96.52%±1.96%、95.98%±1.72%、101.16%±1.85%、97.17%±2.60%。
精密吸取山楂多糖供试品溶液25 ml,共6份,加入适量葡萄糖,按照“2.2.1”项进行测定,测得多糖平均加样回收率为100.17%±1.99%。
2.6 蜜制工艺优化 在单因素考察实验中,考察了烘制时间、烘制温度、炼蜜与水的比例、闷润时间及加蜜量。炼蜜与水的比例中,若加水量过多,则在炮制过程中不能烘干完全;若水的比例过少,则在炮制过程炼蜜有损失。单因素考察显示,加入1∶1的水量时,比例适中。观察闷润时间2、4、6、8、10、12 h,发现在闷润6 h后各指标含量无明显增加,因此,选择炼蜜与水的比例为1∶1,闷润时间为6 h为定因素。选择烘制时间(A)、烘制温度(B)、加蜜量(C)为影响因素,采用加权评分的方法优化山楂蜜制工艺(设定满分为100,权重系数分布为多糖、表儿茶素、儿茶素、原花青素B2均为0.2,金丝桃苷、异槲皮苷为0.1,Y=0.2W1/W1max+0.2W2/W2max+0.2W3/W3max+0.2W4/W4max+0.1W5/W5max+0.1W6/W6max),见表2、表3。

表2 因素水平表
通过Design Expert 8.0.6.1软件进行多元回归分析,得到方程为Y=96.02-3.93A-5.10B+0.91C+0.67AB-0.78AC+0.79BC-15.51A2-19.63B2-6.30C2(R2=0.975 6),方差分析结果见表4。根据方差分析结果分析,该模型P<0.05,可用于预测。因素A、B对于综合评分的影响极显著,因素C对于综合评分的影响有显著性。AB、AC、BC交互项影响不显著、失拟项影响不显著,提示方程拟合度好。响应面分析见图2。
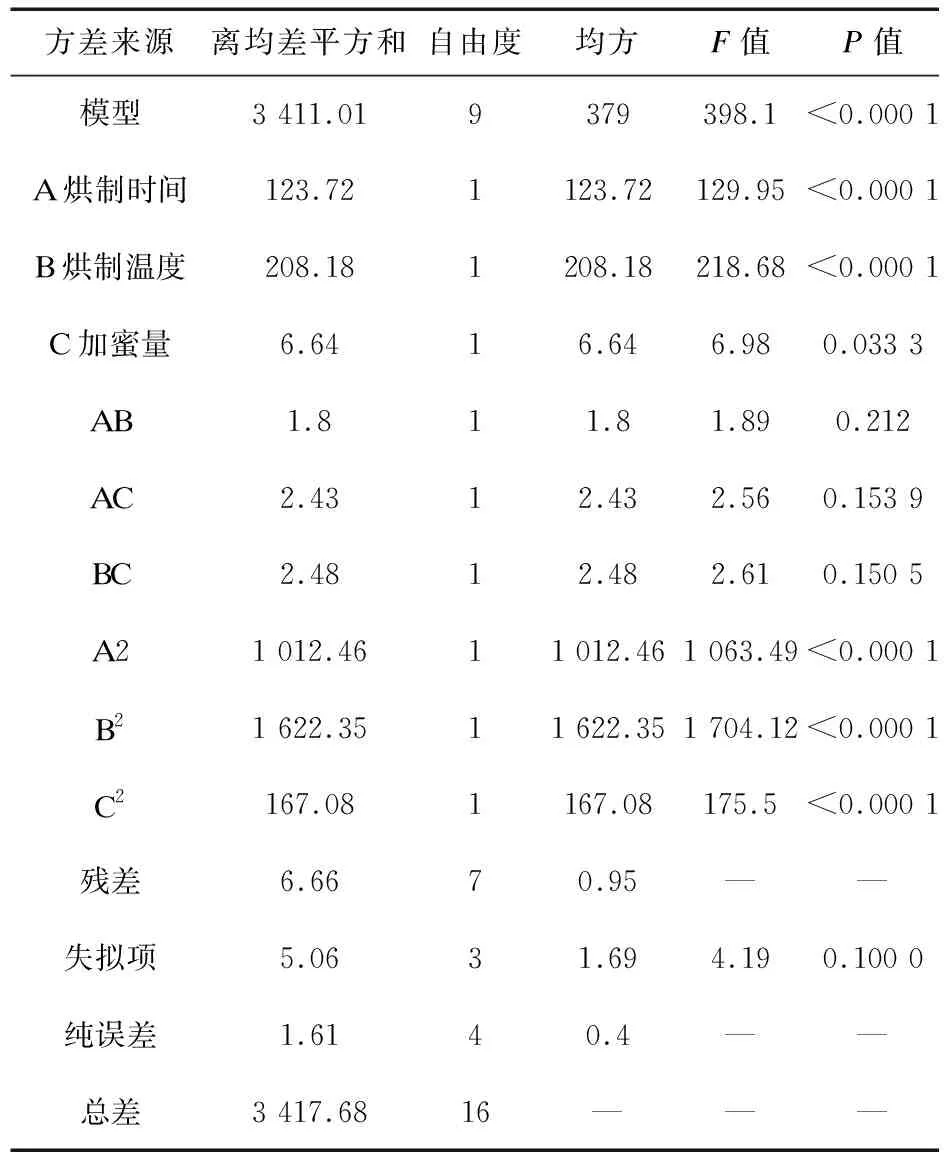
表4 方差分析结果
2.7 验证试验 根据回归方程,得到最佳蜜制工艺为每100 g山楂中加入15.37 g炼蜜,闷润6 h后98.69 ℃下烘制86.05 min。但为了试验的可操作性考虑,将其修正为100 g山楂加入15 g炼蜜,100 ℃下烘制90 min。取3份山楂药材在上述条件下进行验证,测得多糖含量为40.2 mg/g,儿茶素含量为0.65 mg/g,表儿茶素含量为1.1 mg/g,原花青素B2含量为1.0 mg/g,金丝桃苷含量为0.57 mg/g,异槲皮苷含量为0.54 mg/g,综合评分为96.08,与预测值96.64接近,表明工艺稳定可行。
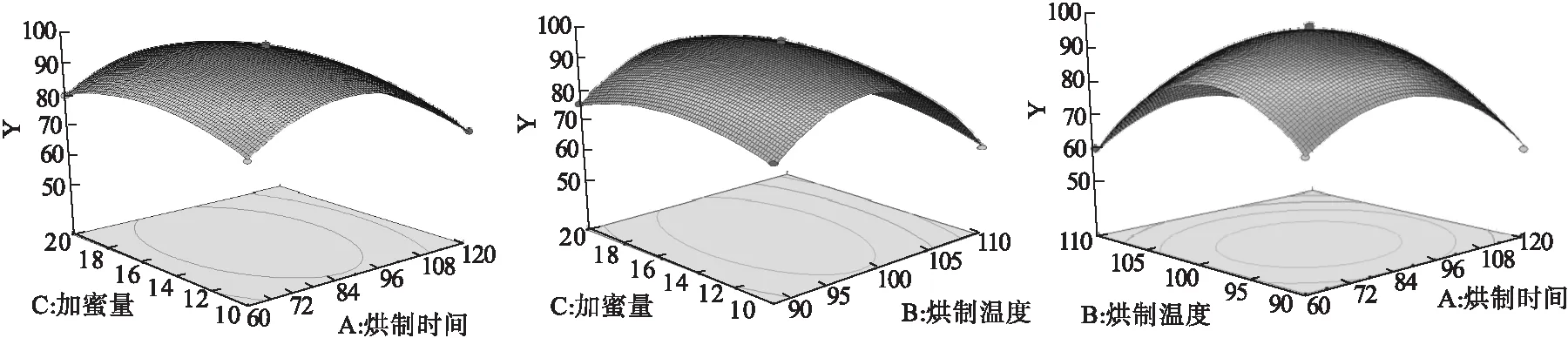
图2 各因素响应面图
3 讨论
山楂现代炒制工艺中考察指标多为有机酸及总黄酮[20-22],但山楂中含有大量多糖类及儿茶素类等成分,后者均为山楂的有效物质[23-25]。因此,本试验以儿茶素、表儿茶素、原花青素B2、金丝桃苷、异槲皮苷、多糖等多种有效成分为指标,多方对炮制工艺进行监控,避免了单一指标的片面性。同时,本试验采用了Box-Behnken设计优化蜜制工艺,该方法选择实验体系的目标响应值作为单个或多个实验因素的函数,与正交设计、均匀设计比较更接近客观实际,且兼顾了多个影响因素及因素之间的相互作用,使试验次数较少的同时获得更精确的参数[23]。
山楂生品各成分含量测定结果如下:多糖(20.64 mg/g),儿茶素(0.82 mg/g),表儿茶素(1.38 mg/g),原花青素B2(1.93 mg/g),金丝桃苷(0.31 mg/g),异槲皮苷(0.28 mg/g)。山楂蜜制品与山楂生品相比,多糖类成分增加明显。为避免蜂蜜对于多糖含量测定产生干扰,将炼蜜与炮制品在相同条件下进行提取,发现炼蜜经醇沉后无多糖析出,其中单糖等低聚糖含量达92%,据此可排除蜂蜜的干扰。除山楂外,百合、甘草等中药在蜜制后多糖含量升高[13-14],但多糖含量升高的具体机制尚无明确结论,有待进一步研究。儿茶素类物质经炮制后含量略有降低,这可能是由于儿茶素类成分在加热条件下,逐渐发生分解。黄酮苷类成分较生品含量升高,但当炮制温度超过110 ℃时含量又会逐步下降。这一变化可能是当炮制温度适宜后起到“杀酶保苷的作用”[15],黄芪等中药在蜜制后黄酮苷类物质确有升高[16]。
本试验对多糖、儿茶素类及黄酮苷类药效成分炮制前后的变化进行了初步研究。在工艺优化基础上,根据工艺优化结果对生山楂及山楂蜜制品的抗心肌缺血的药效进行了试验,结果发现,山楂经蜜制后抗心肌缺血作用强于生山楂,但具体作用机制有待进一步研究。本课题组认为,从药效及有效成分的研究结果分析,山楂蜜制具有一定的研究意义。后续将考察蜜制品与生品其他化学成分的变化,研究蜜制品与生品药效学产生差异的机制,为山楂蜜制品的应用奠定基础。
