VEGF通过 NF-κB通路对内皮细胞血清类黏蛋白1表达的影响
2020-06-09周经霞曾超胜
陈 琳,周经霞,曾超胜
0 引言
血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)是目前已知最强的促血管生成因子,可以保护神经细胞、促进神经轴突再生,帮助缺血性脑组织恢复血供,是一个很有前景的治疗缺血性脑卒中的生物因子[1]。然而,VEGF在发挥治疗缺血性脑卒的作用时,会加重血脑屏障完整性的破坏,导致脑水肿等严重不良反应,阻碍VEGF的临床应用[2-3]。转录调控核因子-κB(NF-κB)通路是重要的炎性细胞因子调节通路,在脑卒中时处于激活状态,P65蛋白是NF-κB通路的核心蛋白,激活后入核发挥转录因子的作用,调节一系列基因的表达[4]。血清类黏蛋白(Orosomucoid,ORM)对于维持多个组织和器官毛细血管的通透性有重要作用,外源性给予ORM可以显著增强血脑屏障,其中ORM1占ORM的75%以上[5]。本研究观察VEGF 对血管内皮细胞ORM1表达的影响,并探讨NF-κB通路在其中的作用。
1 材料与方法
1.1 主要试剂与仪器 人真皮微血管内皮细胞 (HDMEC)购自上海细胞生物研究所,内皮细胞生长补充因子(ECGS)、VEGF、DAPI和NF-κB通路抑制剂(PDTC)购于美国Sigma公司,Trizol和反转录试剂盒购自美国英韦创津公司、荧光定量PCR(Real-time PCR)试剂盒购自上海生工生物工程有限公司,ORM1和内参β-actin 引物由深圳华大基因公司设计和合成,见表1。细胞蛋白裂解液和细胞核蛋白提取试剂盒购自北京碧云天公司,内皮细胞培养基(ECM)和胎牛血清购于美国 Gibco 公司,ORM1、P65以及内参GAPDH、Histone抗体购自美国Abcam公司,MCO-20AIC型CO2培养箱购自日本 SANYO 公司,ABI 7500 型Real-time PCR仪为美国应用生物系统公司产品,Multiskan Spectrum酶标仪购自美国Thermo公司。
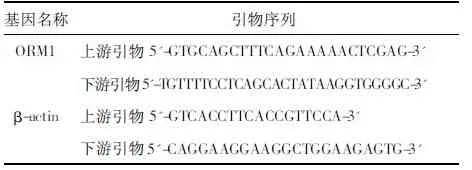
表1 引物序列表
1.2 细胞培养和传代 HDMEC细胞培养于5%胎牛血清、1%ECGS、100 U/ml青霉素和100 mg/ml链霉素的ECM培养液中,置于5%CO2、37 ℃ 细胞培养箱,待细胞达到80%融合(对数生长期)时传代进行试验。
1.3 ORM1基因表达的Real-time PCR定量检测 取对数生长的HDMEC细胞接种于6孔板,分为对照组、低剂量VEGF (20 μmol/L)组、高剂量VEGF (40 μmol/L)组和PDTC(5 μg/L)组,共4组。培养12 h细胞贴壁后,加入相关试剂,继续培养12 h后加入Trizol裂解细胞,提取细胞总RNA,按照逆转录试剂盒说明书操作反转录出cDNA第1链,取1 μg cDNA,按照Real-time PCR试剂盒说明书操作,检测ORM1基因的相对表达量,反应条件为:94 ℃ 3 min;而后进行35个循环(94 ℃ 45 s,60 ℃ 30 s);72.5 min。对照内参β-actin,用2-△△Ct表示ORM1的相对表达水平。
1.4 P65蛋白免疫荧光分析 按“1.3”项方法进行细胞分组,制作细胞爬片,培养12 h细胞贴壁后,加入相关试剂,继续培养12 h,室温下用4%多聚甲醛固定10 min后,含0.5%Triton X-100的PBS中渗透15 min,含0.3% H2O2的0.01 mol/L Tris缓冲液中30 min,加入P65一抗4 ℃下孵育过夜,APC标记二抗(红色荧光)孵育2 h,细胞核染料DAPI(蓝色荧光)复染30 min,荧光显微镜分析图像。
1.5 ORM1和P65蛋白表达的Western blot检测 按“1.3”项方法进行细胞分组。培养12 h细胞贴壁后,加入相关试剂,继续培养12 h后,每组细胞分为2份,提取细胞总蛋白和细胞核蛋白,所有蛋白经SDS-聚丙烯酰胺凝胶电泳,恒流电转至PVDF膜,孵育ORM1和P65抗体(1∶1 000)过夜,细胞总蛋白内参使用β-actin抗体(1∶5 000),细胞核内参使用Histone抗体(1∶5 000),HRP标记二抗孵育2 h,加入化学发光剂,曝光后Total Lab Quant v11.5 软件扫描目的条带,以内参为对照计算各条带的相对灰度值。
1.6 统计学方法 采用 SPSS 17.0 统计软件对数据进行统计处理,计量资料多组间比较采用单因素方差分析,两两比较用 LSD法分析,P<0.05为差异有统计学意义。
2 结果
2.1 VEGF对ORM1基因表达的影响 Real-time PCR定量检测显示,对照组、低剂量VEGF组、高剂量VEGF组和PDTC组ORM1基因的2-△△Ct值为0.324±0.053、0.252±0.042、0.192±0.034、0.166±0.027,差异有统计学意义(P<0.05)。
2.2 VEGF对P65蛋白表达的影响 免疫荧光染色显示,低剂量VEGF组、高剂量VEGF组和PDTC组P65蛋白表达低于对照组。见图1。
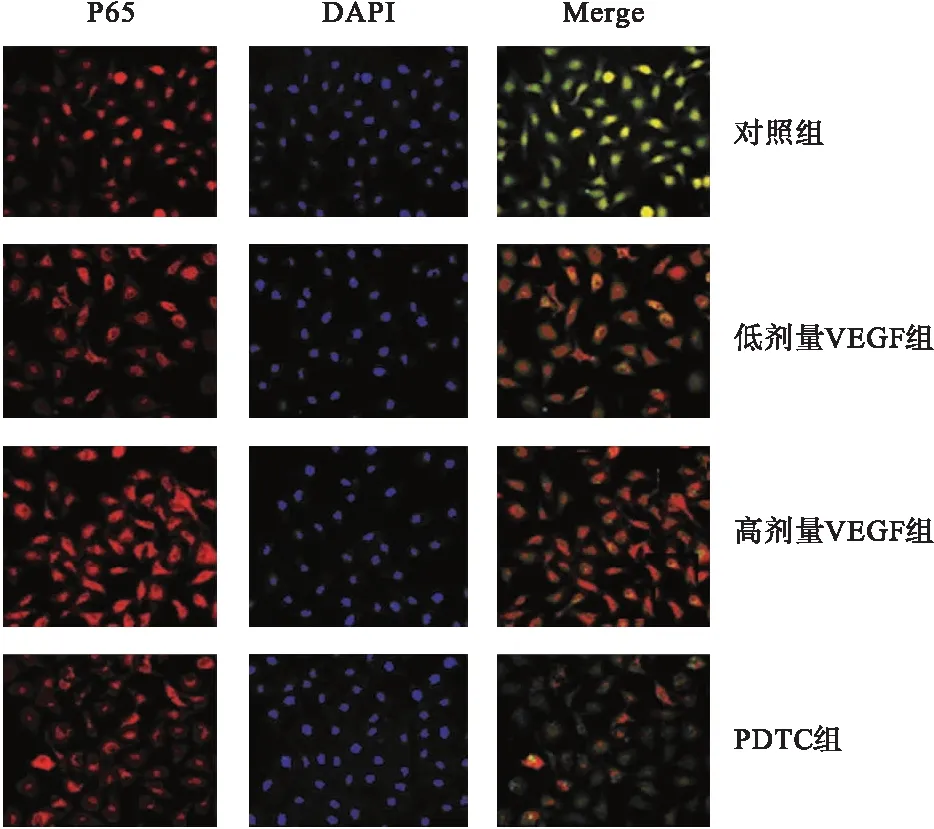
图1 P65蛋白的免疫荧光染色结果(200×)
Western blot检测结果显示,对照组、低剂量VEGF组、高剂量VEGF组和PDTC组P65蛋白表达的相对灰度值分别为0.527±0.114、0.316±0.065、0.242±0.038、0.105±0.012,各组间比较差异有统计学意义(P<0.05)。见图2。
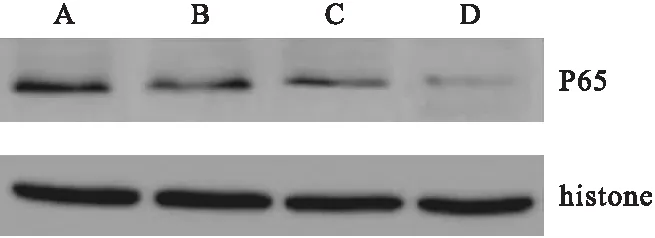
图2 细胞核P65蛋白的Western blot检测结果
2.3 VEGF对ORM1蛋白表达的影响 Western blot检测结果显示,对照组、低剂量VEGF组、高剂量VEGF组和PDTC组ORM1蛋白表达的相对灰度值分别为0.874±0.142、0.462±0.083、0.305±0.047、0.126±0.014,各组间差异有统计学意义(P<0.01)。见图3。
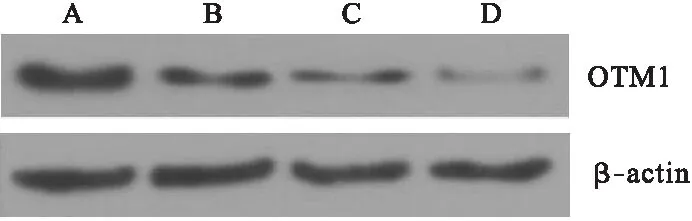
图3 ORM1蛋白的Western blot检测结果
3 讨论
研究发现,VEGF在脑卒中发生时表达升高[6],而且在损伤的脊髓处注入VEGF后可显著减少凋亡细胞的数量。VEGF除了可以促进内皮细胞分裂血管生成外,还可以保护神经细胞。研究显示,VEGF在发挥脑损伤后修复作用的同时,也可导致脑水肿的不良反应,研究VEGF致脑水肿的机制将会为克服VEGF的不良反应带来新的作用靶点[7]。
ORM是内皮细胞中主要的连接糖蛋白,是已明确的血脑屏障通透性相关基因[8],Wu等[9]研究发现,ORM参与了VEGF导致的血脑屏障损伤过程。本研究显示,VEGF可以显著抑制内皮细胞ORM1基因和蛋白的表达。韩雨薇等[10]的研究显示,抑制VEGF诱导的血管内皮紧密连接损伤,可以对蛛网膜下腔出血大鼠模型发挥治疗作用。NF-κB是体内一个重要的信号调控通路,其通过P65蛋白入核发挥转录因子的作用,调控一系列下游基因的表达,如产生炎症因子增加脑卒中患者的脑损伤,或者上调一氧化氮合酶表达生成大量一氧化氮诱导神经元细胞凋亡[11]。本研究显示,VEGF可以显著抑制NF-κB通路中的P65蛋白入核。VEGF对脑卒中的治疗作用可能与抑制NF-κB通路相关[12],但是P65蛋白入核减少后,ORM1基因和蛋白表达也出现了显著减少,并且本研究中,使用NF-κB通路特异性抑制剂PDTC后,ORM1基因和蛋白的表达下降,提示NF-κB通路调控ORM1表达,其具体调控机制还有待进一步的研究阐明。阻断NF-κB通路对ORM1的调控作用,将会为克服VEGF致脑水肿提供一个新的研究方向。临床研究显示,脑缺血再灌注损伤患者会出现VEGF一过性的升高,但很少出现脑水肿,只表现为视乳头水肿、皮下水肿、浆膜腔积液,是否是因为VEGF治疗时血液浓度大量快速的增加,或者血液中VEGF达到一定水平才会引起脑水肿的发生,有待进一步的研究来探讨。
综上所述,本研究结果表明,VEGF通过抑制NF-κB通路下调了ORM1基因和蛋白表达,这可能是VEGF致脑水肿的作用机制。
