一种基于萘酰亚胺神经介质模拟物荧光增强型探针
2020-06-05赵磊陈康程探宇
赵磊 陈康 程探宇


摘 要: 神经毒剂,如沙林、梭曼和塔崩等都是剧毒的有机磷化合物,可以用作化学武器,主要是抑制乙酰胆碱酶的活性,进而引起神经系统的紊乱,所以快速方便地检测此类化合物具有重要的意义.设计并合成了一种以萘酰亚胺为荧光团、肼基作为活性基团的快速响应荧光探针(PND),该探针可用于检测神经毒剂模拟物:氯磷酸二乙酯(DCP)和氰基磷酸二乙酯(DCNP),而且表现出了高选择性和高灵敏度.
关键词: 荧光探针; 萘酰亚胺; 水合肼; 神经性毒剂
中图分类号: O 657.34 文献标志码: A 文章编号: 1000-5137(2020)02-0184-07
A naphthalimide-based fluorescence-enhanced probe for nerve agent mimics
ZHAO Lei, CHEN Kang, CHENG Tanyu*
(College of Chemistry and Materials Science,Shanghai Normal University,Shanghai 200234,China)
Abstract: Neurotoxic agents,such as sarin,soman and tauben,are highly toxic organophosphorus compounds,which can be used as chemical weapons.These compounds mainly inhibit the activity of acetylcholine enzymes,which in turn cause nervous system disorders.Thus,it is greatly important to quickly and conveniently detect such compounds.Herein,a fluorescent probe(PND) based on naphthalimide and hydrazine group was developed,which displayed high selectivity and sensitivity for nerve agent mimicsdiethyl chlorophosphate(DCP) and diethyl cyanophosphonate(DCNP).
Key words: fluorescent probe; naphthalimide; hydrazine hydrate; nerve agent
0 引 言
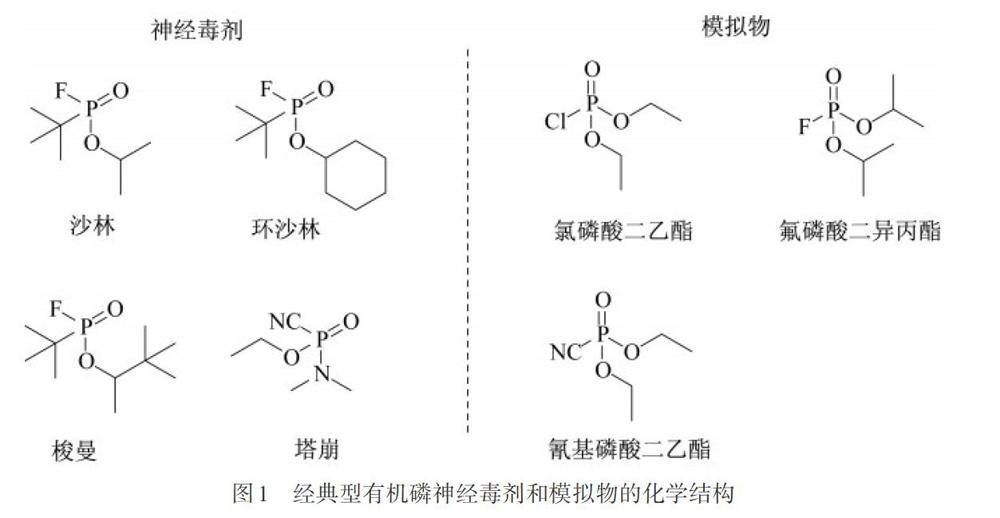
神经毒剂,沙林、梭曼、塔崩等是一类具有致命剧毒性的有机磷化合物,如图1所示,可用作化学武器等,其毒性高、致命快的特点,对人体安全构成了威胁[1-2].神经毒剂生产成本低,简单易得,且广泛使用[3-5].这些无色无味的毒剂形式多样,主要有气体、气溶胶或液体等形式,很容易被动物和人类吸入,或通过皮肤接触吸收,导致死亡.虽然一些国际条约禁止发展、生产和储存化學武器,但一些国家仍在对其进行研究[2,5-6].神经毒剂进入人体的作用机制主要是抑制蛋白酶的活性,尤其是乙酰胆碱酯酶的活性.乙酰胆碱酯酶是人体内的中枢神经酶,神经毒剂与胆碱酯酶结合成稳定的磷酰化胆碱酯酶,使胆碱酯酶丧失分解乙酰胆碱的活性,导致乙酰胆碱在神经突触连接处的过度积累,会造成肌肉松弛障碍、神经紊乱甚至死亡.因此,对于神经毒剂的检测变得尤为重要[7-10].2016年,KIM等[11]报道了一种荧光探针o-OH检测神经毒剂模拟物氯磷酸二乙酯(DCP),如图2所示,该荧光探针o-OH能够检测和定量固定在固体基质上的溶液和气相中的有机磷神经毒剂模拟物,通过抑制反应性酚醛酸磷酸化后的内旋,从而产生较强的荧光“打开”响应,探针o-OH在N,N-二甲基甲酰胺(DMF)中荧光信号很弱,荧光量子产率(ΦF)为0.002,与DCP作用以后,得到探针o-Ophos,探针o-Ophos在DMF中表现出很强的荧光信号,ΦF为0.490,具有选择性好、灵敏度高、荧光信号变化明显等优点.
由于神经毒剂的毒性大且生产方便,发展高灵敏度和高选择性的检测方法已成为该领域的一个研究热点.目前,基于电位法、表面声波光谱法、酶法、电化学、气相色谱/质谱法等方法,已经发展出多种检测神经毒剂的方法[10,12-14].这些方法具有灵敏度高、操作简单、可移植性好等优点[11].迄今为止报道的用于检测有机磷神经毒剂的荧光探针大多采用了常见的传感方案[15-17],探针的响应主要取决于神经毒剂的亲电性,从而导致磷酸盐酯中间体的形成,将磷酸基通过亲核反应转移到含氮(N)或氧(O)的基团上,如羟基、氨基、肟基、羰基等,能调节光诱导电子转移(PET)、内电荷转移(ICT)[18]、荧光共振能量转移等能量/电子/电荷转移过程[4,15,19-20].最后,这些探针可以被不同波段的光激发表现出不同的荧光信号,从而实现对神经毒剂的检测.在各种荧光基团中,萘酰亚胺荧光团显示出明显的优势,例如,高发光量子产率、强烈的荧光发射,以及易于支架修饰等特点[21-23].本文作者通过萘酰亚胺为母体和水合肼反应形成探针PND,用于快速、灵敏地检测神经毒剂模拟物.
1 实验部分
1.1 仪器和试剂
主要仪器:核磁共振仪(400 MHz),DRX-400,Bruker;紫外-可见光分光光度计,UV-3900,Hitachi;荧光光谱仪,F-7000,Hitachi.
主要试剂:二氯甲烷(泰坦科技),无水乙纯(泰坦科技),石油醚(泰坦科技),乙酸乙酯(泰坦科技),甲醇(泰坦科技),柱层析硅胶(200~300目,黄海),乙腈(安耐吉),N,N-二异丙基乙胺(分析纯AR,麦克林),乙二醇单甲醚(分析纯AR,麦克林),DCP,氰基磷酸二乙酯(DCNP),水合肼(质量分数为80%,安耐吉),N,N-二甲基甲酰胺(安耐吉),4-溴-1,8-萘二甲酸酐(安耐吉).
1.2 实验合成
1.2.1 化合物2的合成[24]
如图3所示,首先将4-溴-1,8-萘二酸酐(831 mg,2.9 mmol)和正丁胺(279 mg,3 mmol)放入50 mL的烧瓶中,加入10 mL无水乙醇溶解,混合物加热回流5 h.反应完全后,通过旋转蒸发仪减压除去溶剂,经柱层析(V(石油醚)/V(二氯甲烷)=1∶2)纯化粗残渣,得到纯净的化合物2为淡黄色固体(877 mg,74%产率).1H NMR(400 MHz,CDCl3)δ,8.57(dd,J=7.3,1.2 Hz,1H),8.47(dd,J=8.5,1.1 Hz,1H),8.33(d,J=7.8 Hz,1H),7.95(d,J=7.9 Hz,1H),7.76(dd,J=8.5,7.3 Hz,1H),4.15~4.02(m,2H),1.70~1.58(m,2H),1.43~1.30(m,2H),0.90(t,J=7.4 Hz,3H).13C NMR(100 MHz,CDCl3)δ,163.52,133.08,131.91,131.10,131.02,130.53,130.08,128.90,128.00,123.12,122.26,40.36,30.16,20.36,13.82.
1.2.2 化合物PND的合成[25]
如图3所示,称取1.0 g化合物2加入到烧瓶中,用10 mL乙二醇单甲醚溶解后120 ℃回流,直到溶液变得澄清,之后向烧瓶中缓慢滴加1 mL,80%(质量分数)的水合肼搅拌10 min,在氮气(N2)保护的条件下回流4 h,TLC点板监控反应,反应完全冷却至室温后,晶体过滤分离,用乙醇洗涤多次后,得到淡黄色固体PND 0.81 g,产率为94%.1H NMR(400 MHz,DMSO-d6) δ,9.12(s,1H),8.89~8.16(m,3H),7.63(t,J=8.0 Hz,1H),7.24(d,J=8.6 Hz,1H),4.67(s,2H),4.25~3.87(m,2H),1.82~1.49(m,2H),1.45~1.16(m,2H),0.92(t,J=7.3 Hz,3H).
2 熒光探针的性能测试
2.1 PND反应体系随时间变化的测试
1 cm的石英比色皿中加入2 mL PND溶液(10 μL,10 μmol·L-1),随后加入DCP或DCNP(20 μL,20 μmol·L-1),混合均匀后,在DMF中测试探针PND随反应时间的光谱变化.
2.2 PND反应体系的浓度滴定实验
1 cm石英比色皿中加入2 mL的PND溶液(10 μL,10 μmol·L-1),随后逐渐滴加DCP或DCNP(2 μL,2 μmol·L-1),混合均匀后,在DMF中测试体系的光谱变化,滴加到体系荧光强度不再变化为止.
2.3 PND对不同神经毒剂模拟物的选择性实验
1 cm石英比色皿中加入2 mL的PND溶液(10 μL,10 μmol·L-1),随后分别加入3种不同种类的神经毒剂模拟物:甲基膦酸二甲酯(DMMP)、磷酸三乙酯(TEP)和磷酸三丁酯(HBT)(20 μL,20 μmol·L-1),混合均与后,在DMF中测试PND对不同神经模拟物的荧光强度变化.
3 结果与讨论
3.1 PND反应体系随反应时间的光谱变化
由于DCP和DCNP容易水解,选定DMF作为测试体系,为了确定PND与毒剂模拟物DCP和DCNP的反应时间,首先测定了PND对DCP的响应时间曲线,如图4所示,探针PND(10 μL)在体系中,在420 nm出现了特征吸收峰,在加入20 μmol的DCP之后,溶液的紫外吸收光谱发生了蓝移,图4(a)所示,在380 nm处出现了新的吸收峰,在395 nm处有一个等吸收点,这可能是因为连接萘酰亚胺的N上的孤对电子被磷束缚,由于诱导反应从而降低了N的给电子能力,导致了吸收的蓝移.同时,如图4(b)所示,探针PND初始荧光信号很弱,在加入DCP后,体系的荧光强度逐渐增强,最终荧光强度稳定不变,通由图4(b)的插图可以看出,加入DCP 5 min后荧光强度趋于稳定,这表明DCP与PND基本反应完全.由于DCP和DCNP有着类似的化学性质,在相同条件下也能表现出非常相似的光谱变化.DCP和DCNP都可以使探针PND的荧光强度增强,这可能是由于肼基与磷酸二乙酯的结合导致探针母体的PET过程受阻,其反应机制如图5所示.
3.2 PND反應体系的浓度滴定实验
对PND反应体系进行了浓度滴定实验,如图6所示,在没有DCP的情况下,几乎没有观察到PND在DMF中的荧光强度,当加入0.2当量(即2 μL,2 μmol·L-1)DCP时,探针的紫外光谱强度明显降低和蓝移,如图6(a)所示.而在520 nm处的荧光迅速增强,如图6(b)所示,随着DCP的逐步滴加,荧光发射强度逐渐增加,当DCP物质的量浓度达到20 μmol·L-1时,荧光强度达到最大且稳定不变.此外,从图6(a),6(b)的插图可以看出荧光和紫外展现出相似的结果,与自由探针PND相比,探针复合DCP后的荧光强度增强了100倍,这些变化可归因于磷酰胺阻断了孤对电子的给电子能力,进而导致PET关闭,使荧光增强.图6(c),6(d)为PND对DCNP物质的量浓度滴定的紫外光谱和荧光光谱图,由于DCNP和DCP有着类似的性质,所测得的光谱几乎一致.另外,如图7所示,在DMF测试体系中,探针PND随DCP浓度增大,荧光信号逐渐增强.
3.3 PND对不同毒剂模拟物的选择性实验
为了进一步确定探针PND的选择性,采用了3种有机磷化合物DMMP,TEP和HBT作为潜在的干扰物,如图8所示.当存在DCP和DCNP时,PND在520 nm处产生荧光的明显增强,并且其他干扰物的溶液荧光没有明显变化.由此可见,探针PND对毒剂模拟物DCP和DCNP有很好的选择性.
4 结 论
本文设计并合成了基于萘酰亚胺的荧光传感器,用于神经毒剂模拟物DCP和DCNP的检测,随着DCP或DCNP的加入,体系的荧光明显增强(开关响应),另外探针PND对其他模拟物无明显响应.因此,PND对神经毒剂的检测具有很高的灵敏度和选择性.从基础科学的角度来看,PND作为神经毒剂探针具有多种优点,例如涉及简单的合成程序和实时检测,并且可以提供颜色和荧光变化,以帮助实现更好的选择性模式.总之,本文作者开发了一种荧光增强型探针PND,可以高选择性检测神经毒剂模拟物DCP和DCNP,具有一定的应用价值.
参考文献:
[1] LIU G,LIN Y.Electrochemical sensor for organophosphate pesticides and nerve agents using zirconia nanoparticles as selective sorbents [J].Analytical Chemistry,2005,77(18):5894-5901.
[2] LEE H,KIM H J.Novel fluorescent probe for the selective detection of organophosphorous nerve agents through a cascade reaction from oxime to nitrile via isoxazole [J].Tetrahedron,2014,70(18):2966-2970.
[3] WANG J,TIMCHALK C,LIN Y.Carbon nanotube-based electrochemical sensor for assay of salivary cholinesterase enzyme activity:an exposure biomarker of organophosphate pesticides and nerve agents [J].Environmental Science & Technology,2008,42(7):2688-2693.
[4] DE GRENB D,MORENO D,TORROBA T,et al.Fluorescent discrimination between traces of chemical warfare agents and their mimics [J]. Journal of the American Chemical Society,2014,136(11):4125-4128.
[5] JANG Y J,MURALE D P,CHURCHILL D G.Novel reversible and selective nerve agent simulant detection in conjunction with superoxide “turn-on” probing [J].Analyst,2014,139(7):1614-1617.
[6] JANG Y J,TSAY O G,MURALE D P,et al.Novel and selective detection of tabun mimics [J].Chemical Communications,2014,50(56):7531-7534.
[7] DE SOUZA L G,RENN M N,FIGUEROA-VILLARJ D.Coumarins as cholinesterase inhibitors:a review [J].Chemico-Biological Interactions,2016,254:11-23.
[8] XIE S S,WANG X,JIANG N,et al.Multi-target tacrine-coumarin hybrids:cholinesterase and monoamine oxidase B inhibition properties against alzheimer's disease [J]. European Journal of Medicinal Chemistry,2015,95:153-165.
[9] ATRI A,FR?LICH L,BALLARD C,et al.Effect of idalopirdine as adjunct to cholinesterase inhibitors on change in cognition in patients with alzheimer disease:three randomized clinical trials [J]. JAMA,2018,319(2):130-142.
[10] WANG X,LI P,DING Q,et al.Observation of acetylcholinesterase in stress-induced depression phenotypes by two-photon fluorescence imaging in the mouse brain [J]. Journal of the American Chemical Society,2019,141(5):2061-2068.
[11] KIM T I,MAITY S B,BOUFFARD J,et al.Molecular rotors for the detection of chemical warfare agent simulants [J].Analytical Chemistry,2016,88(18):9259-9263.
[12] GOSWAMI S,DAS S,AICH K.Fluorescent chemodosimeter based on spirobenzopyran for organophosphorus nerve agent mimics(DCP) [J].RSC Advances,2015,5(37):28996-29001.
[13] HU X X,SU Y T,MA Y W,et al.A near infrared colorimetric and fluorometric probe for organophosphorus nerve agent mimics by intramolecular amidation [J]. Chemical Communications,2015,51(82):15118-15121.
[14] MAHAPATRA A K,MAITI K,MANNA S K,et al.A cyclization-induced emission enhancement(CIEE)-based ratiometric fluorogenic and chromogenic probe for the facile detection of a nerve agent simulant DCP [J].Chemical Communications,2015,51(47):9729-9732.
[15] VAN HOUTEN K A,HEATH D C,PILATO R S.Rapid luminescent detection of phosphate esters in solution and the gas phase using(dppe)Pt{S2C2(2-pyridyl)(CH2CH2OH)} [J].Journal of the American Chemical Society,1998,120(47):12359-12360.
[16] ZHANG S W,SWAGER T M.Fluorescent detection of chemical warfare agents:functional group specific ratiometric chemosensors [J]. Journal of the American Chemical Society,2003,125(12):3420-3421.
[17] DALE T J,REBEK J.Fluorescent sensors for organophosphorus nerve agent mimics [J].Journal of the American Chemical Society,2006,128(14):4500-4501.
[18] BARBA-BON A,COSTERO A M,GIL S,et al.Highly selective detection of nerve-agent simulants with BODIPY dyes [J].Chemistry:A European Journal,2014,20(21):6339-6347.
[19] ZHOU X,ZENG Y Y,CHEN L Y,et al.A Fluorescent sensor for dual-channel discrimination between phosgene and a nerve-gas mimic [J].Angewandte Chemie International Edition,2016,55(15):4729-4733.
[20] XUAN W,CAO Y,ZHOU J,et al.A FRET-based ratiometric fluorescent and colorimetric probe for the facile detection of organophosphonate nerve agent mimic DCP [J].Chemical Communications,2013,49(89):10474-10476.
[21] YAKUBOVSKYI V P,SHANDURA M P,KOVTUN Y P.Boradipyrromethenecyanines derived from conformationally restricted nuclei [J].Dyes And Pigments,2010,87(1):17-21.
[22] ADARSH N,KRISHNAN M S,RAMAIAH D.Sensitive naked eye detection of hydrogen sulfide and nitric oxide by Aza-BODIPY dyes in aqueous medium [J].Analytical Chemistry,2014,86(18):9335-9342.
[23] IEDA N,HOTTA Y,MIYATA N,et al.Photomanipulation of vasodilation with a blue-llight-controllable nitric oxide releaser [J]. Journal of the American Chemical Society,2014,136(19):7085-7091.
[24] UN H I,WU S,HUANG C B,et al.A naphthalimide-based fluorescent probe for highly selective detection of histidine in aqueous solution and its application in in vivo imaging [J].Chemical Communications,2015,51(15):3143-3146.
[25] TANG Y,KONG X,XU A,et al.Development of a two-photon fluorescent probe for imaging of endogenous formaldehyde in living tissues [J].Angewandte Chemie International Edition,2016,128(10):3417-3420.
(責任编辑:郁 慧,包震宇)
收稿日期: 2019-11-19
基金项目: 国家自然科学基金(21872095)
作者简介: 赵 磊(1993—),男,硕士研究生,主要从事小分子荧光探针方面的研究.E-mail:zhaolei19930923@163.com
通信作者: 程探宇(1983—),男,副教授,主要从事不对称催化方面的研究.E-mail:tycheng@shnu.edu.cn
引用格式: 赵磊,陈康,程探宇.一种基于萘酰亚胺神经介质模拟物荧光增强型探针 [J].上海师范大学学报(自然科学版),2020,49(2):184-190.
Citation format: ZHAO L,CHEN K,CHENG T Y.A naphthalimide-based fluorescence-enhanced probe for nerve agent mimics [J].Journal of Shanghai Normal University(Natural Sciences),2020,49(2):184-190.
DOI: 10.3969/J.ISSN.1000-5137.2020.02.008
