党参多糖抑制PI3K/AKT通路对人肝癌HepG2细胞生长和运动能力的影响
2020-06-05刘云鹤蔡金保王红丽河南省南阳医学高等专科学校第一附属医院肿瘤内科南阳473000
刘云鹤 蔡金保 王红丽 (河南省南阳医学高等专科学校第一附属医院肿瘤内科,南阳 473000)
肝癌(hepatocellular carcinoma,HCC)是全球最常见的三大癌症死亡原因之一,尽管在预防、筛查、诊断和治疗新技术方面均取得进展,但因其具有很强的生长增殖、黏附和侵袭转移能力,发病率和死亡率仍不断上升[1]。在全世界范围内,每年约有60万人死于肝癌,随肿瘤负荷和转移情况的不同,其治疗方案也不尽相同,尤其对于肝癌晚期的治疗费用昂贵且效果不佳[2,3]。党参多糖(codonopsis pilosula polysaccharides,CPP)是其有效成分之一,具有广泛的生物活性。大量研究表明,党参多糖具有免疫调节、抗病毒、保肝、抗氧化应激和神经保护等功能[4-9]。目前其对肿瘤的作用研究并不多见,研究表明,其对乳腺癌、宫颈癌等肿瘤细胞能产生抑制作用[10,11]。Bai等[12]研究发现,党参提取所得的两种水溶性多糖对肝癌HepG2表现出抑制作用,其机制与诱导细胞周期阻滞和凋亡蛋白表达、抑制细胞迁移相关。众所周知,PI3K能活化AKT,参与调控细胞增殖、分化、迁移和凋亡等多种信号传导。在对前列腺癌的研究中发现,PI3K/AKT参与了细胞凋亡、增殖、迁移和侵袭,是癌症治疗的新途径[13]。党参多糖能否通过PI3K/AKT通路对人肝癌细胞产生影响还未见报道。因此,本文以体外培养的人肝癌HepG2细胞为研究对象,研究党参多糖对人肝癌HepG2细胞生长和运动能力的影响及其可能机制。
1 材料与方法
1.1材料
1.1.1细胞系与主要试剂 人肝癌HepG2细胞株购自中国医学科学院基础医学研究所细胞中心;DMEM培养液、胎牛血清、0.25%胰酶购自赛默飞世尔公司;DMSO购自上海生工;党参多糖(纯度≥98%)、RIPA裂解液购自美国Sigma公司;Transwell小室购自北京优尼康生物技术有限公司;Matrix基质胶购自BD公司;BCA试剂盒购自碧云天生物科技公司;单克隆抗体、辣根过氧化物酶标记二抗购自Santa Cruze公司。
1.1.2主要仪器设备 恒温培养箱购自美国ThermoForma公司;电泳仪和半干转膜仪购自美国伯乐公司;Gel View 6000化学发光凝胶成像系统购自广州云星仪器有限公司;普通光学显微镜购自日本奥林巴斯公司;FACSAria流式细胞仪购自美国BD公司;超净工作台购自苏州中亚净化设备有限公司。
1.2方法
1.2.1细胞培养 用含有10%胎牛血清的DMEM培养基,将HepG2细胞培养于37℃、5% CO2的恒温培养箱中。镜下观察细胞生长状态,细胞融合率达80%时可传代。
1.2.2CCK8实验 将人肝癌HepG2细胞调整到2×104个/ml密度接种于96孔板,每孔加入100 μl,待细胞贴壁后,分别给予对应终浓度党参多糖(CPP),每个剂量组设6个复孔,按实验设计培养对应时间之后每孔加入10 μl CCK8溶液,继续孵育4 h。采用450 nm吸光度于酶标仪上测定各组人肝癌HepG2细胞存活率。
1.2.3流式细胞术 以1×105个/ml密度将人肝癌HepG2细胞接种于6孔板中,待细胞融合率达80%以上时用胰酶处理并收集细胞,调整密度为1×106个/ml。严格按照FITC-Annexin V试剂盒说明书,每个样本加入5 μl的FITC-Annexin V和PI染色液,室温避光孵育15 min后,上机检测。
1.2.4Transwell实验 Transwell小室下层加入含胎牛血清培养液,以1×105个/ml密度将人肝癌HepG2细胞接种于提前用Matrigel基质胶包被好的Transwell小室上层,上层培养液不加胎牛血清。培养24 h后,无菌拭去Matrigel基质胶和小室上层细胞,PBS洗涤3次,4%多聚甲醛固定,用结晶紫染色细胞,流水冲洗后自然晾干。镜下随机选取5个视野计数。实验至少重复3次,设6个复孔。
1.2.5划痕实验 用记号笔在12孔板背面画出5条平行直线,灭菌备用。以1×105个/ml密度将人肝癌HepG2细胞接种于灭菌12孔板中。待细胞贴壁后,用10 μl枪头垂直于记号笔横线划痕,PBS清洗3次。给予对应终浓度药液处理后继续培养24 h。随机选取5个视野观察并拍照。
1.2.6蛋白印迹实验 用RIPA蛋白裂解液于冰上提取各组细胞总蛋白,用BCA试剂盒进行蛋白定量。蛋白变性后,取等量蛋白行SDS-PAGE电泳分离蛋白,转膜。5%脱脂奶粉室温封闭2 h,加入一抗,4℃孵育过夜。弃去残液,清洗后加入辣根过氧化物酶标记的二抗,室温孵育1 h。滴加ECL于暗室曝光显影,以GAPDH为内参。

2 结果
2.1党参多糖对体外培养HepG2细胞存活率的影响 CCK8法检测人肝癌HepG2细胞存活情况,结果显示:与Control组相比,50 μmol/L及以上浓度组细胞存活率的组间差距具有统计学意义(P<0.05,图1),且细胞的存活率随着CPP浓度增加而降低;而其他浓度组细胞的存活率组间差异无统计学意义。表明党参多糖能剂量依赖性的降低HepG2细胞的存活率,而当终浓度达到50 μmol/L时可出现明显的细胞毒性作用。故选择无明显细胞毒作用的三个最大浓度进行后续试验,即5、10和20 μmol/L。
2.2党参多糖对体外培养HepG2细胞凋亡率的影响 流式细胞术检测各组细胞凋亡情况,结果表明:与Control组相比,CPP处理组培养HepG2细胞后,细胞凋亡率明显增加(P<0.05,图2),且随着党参多糖处理浓度增大,HepG2细胞凋亡率也随着增加。
2.3党参多糖对体外培养HepG2细胞迁移的影响 划痕实验检测党参多糖对HepG2细胞转移的影响,结果如图3所示,与Control组相比,经CPP处理24 h后各剂量组划痕愈合率随CPP浓度增大而明显降低(P<0.01),且与党参多糖浓度呈反比。
2.4党参多糖对体外培养HepG2细胞侵袭的影响 Transwell检测党参多糖对HepG2细胞侵袭的影响,结果显示:与Control组相比,经CPP处理后,各剂量组镜下观察侵袭细胞数量明显减少(P<0.01,图4),且CPP浓度越大,侵袭细胞数越少。
2.5党参多糖对体外培养HepG2细胞上皮间质转化相关蛋白表达的影响 Western blot检测HepG2细胞上皮间质转化相关蛋白的表达情况,结果如图5所示:与Control组相比,CPP处理组细胞上皮标记蛋白E-cadherin表达明显上调(P<0.01),间质标记蛋白N-cadherin和Vimentin的表达明显下调(P<0.01),这种调节作用与党参多糖浓度相关。提示,党参多糖能剂量依赖性的抑制HepG2细胞的上皮间质转化能力。

图1 CPP对HepG2细胞存活率的影响Fig.1 Effect of CPP on cell viability of HepG2 cellsNote:Compared with Control group,*.P<0.05.

图2 CPP对HepG2细胞凋亡率的影响Fig.2 Effect of CPP on apoptosis rate of HEPG2 cellsNote:Compared with Control group,*.P<0.05.
2.6党参多糖对体外培养HepG2细胞信号通路的影响 Western blot检测HepG2细胞信号通路相关蛋白的表达情况,结果如图6所示:与Control组相比,CPP处理组细胞p-PI3K和p-AKT/AKT的蛋白表达水平被明显抑制(P<0.05),且这种抑制作用与党参多糖浓度呈正比。表明,党参多糖能剂量依赖性的抑制p-PI3K和p-AKT/AKT的蛋白表达,从而影响PI3K/AKT信号通路。

图3 CPP对HepG2细胞迁移的影响Fig.3 Effects of CPP on invasion ability of HepG2 cellsNote:Compared with Control group,*.P<0.05.

图4 CPP对HepG2细胞侵袭的影响Fig.4 Effects of CPP on migration ability of HepG2 cellsNote:Compared with Control group,*.P<0.05.
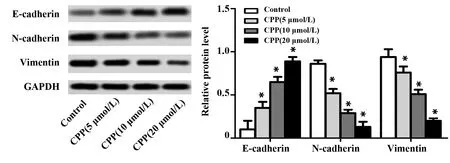
图5 CPP对HepG2细胞上皮间质转化相关蛋白表达的影响Fig.5 Effect of CPP on expression of epithelial-mesenchymal transition-related protein in HepG2 cellsNote:Compared with Control group,*.P<0.05.

图6 CPP对HepG2细胞信号通路的影响Fig.6 Effect of CPP on signaling pathway in HepG2 cellsNote:Compared with Control group,*.P<0.05.
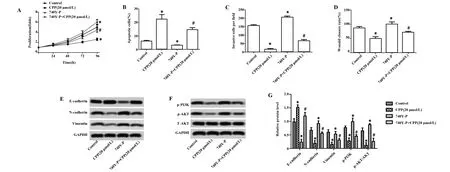
图7 CPP与740Y-P共处理对HepG2细胞增殖、凋亡、迁移和侵袭能力影响Fig.7 Effect on proliferation,apoptosis,invasion and migration of HepG2 cells after treated by CPP and/or 740Y-PNote:A.Cell proliferation detected by CCK-8;B.Detection of apoptosis by flow cytometry;C.Cell invasion detected by Transwell test;D.Cell migration detected by scratch test;E,F.Protein expression of EMT-related and signaling pathway tested by Western blot;G.The statistics of protein expression of EMT-related and signaling pathway.Compared with Control group,*.P<0.05;compared with 740Y-P group,#.P<0.05.
2.7CPP、740Y-P单用或联用对HepG2细胞增殖、凋亡、迁移和侵袭的影响 在有/没有PI3K激活剂740Y-P的情况下检测20 μmol/L党参多糖对HepG2细胞增殖、凋亡、侵袭和迁移能力的影响,结果如图7所示:与Control组相比,20 μmol/L党参多糖能明显抑制HepG2细胞的增殖、迁移和侵袭,促进细胞凋亡(P<0.05);而740Y-P与党参多糖对HepG2细胞的作用正好相反(P<0.05);而两者联用时,与740Y-P 组相比,20 μmol/L党参多糖能逆转740Y-P对HepG2细胞增殖、凋亡、迁移和侵袭的作用(P<0.05)。
3 讨论
原发性肝癌是起源于肝脏上皮或间叶组织的恶性肿瘤,随着人们生活水平的提高,肝癌发病率呈逐年上升趋势,且越来越年轻化,其发病是多因素、多步骤综合作用的结果。研究表明,PI3K/AKT通路的异常激活常与细胞转化、肿瘤发生、癌症发展以及药物耐药性有关,因此临床上有许多靶向该通路的药物单独或联合用于实体瘤和血液恶性肿瘤的治疗中[14]。比如激活PI3K/AKT信号通路能增加结肠癌SW480细胞对顺铂的耐药性[15]。近年来,对天然提取物的抗癌作用研究越来越多。研究表明,在人结肠癌HT-29细胞中,白茅苷能明显抑制人结肠癌HT-29细胞和胃癌SGC-7901细胞的生长,且能通过上调p53和半胱天冬氨酸酶(Caspase)级联诱导细胞凋亡[16,17]。而党参多糖也具有包括抗癌在内的多种生物学活性,因此本文以体外培养的人肝癌HepG2细胞为研究对象,探讨党参多糖能否通过PI3K/AKT信号通路对人肝癌HepG2细胞产生抑制作用。
细胞异常增殖和凋亡抑制是肿瘤发生的重要特点,因此抑制其增殖和促进其凋亡发生是抗癌药开发的重要思路。研究表明,许多天然提取物对体外培养的肿瘤细胞能表现出抑制作用。Hui等[18]研究发现,高良姜石油醚馏分得到的益智油通过上调PTEN表达、下调PI3K/AKT磷酸化诱导细胞凋亡而对多种肝癌细胞系的生长呈浓度和时间依赖性的抑制作用。研究表明,党参多糖对乳腺癌细胞系BT549、MDA-MB-231和宫颈癌细胞系Hela均能表现出明显的抑制增殖作用;且能通过上调Bax/Bcl-2比值和Caspase-3表达来诱导肿瘤细胞凋亡发生[10,12]。我们的研究也发现,党参多糖50 μmol/L及以上浓度对人肝癌HepG2细胞会产生明显的细胞毒性,5、10和20 μmol/L浓度均能明显抑制HepG2细胞增殖和促进细胞凋亡。目前对党参多糖的研究并没有深入到单糖成分的活性研究层面,且不同的提取和分离纯化方法得到的党参多糖含量大不相同,既往研究确定了其主要成分包括鼠李糖、阿拉伯糖、半乳糖、核糖、甘露糖、果糖、木糖和葡萄糖等[19],在本文中党参多糖对HepG2细胞的毒性或活性来源尚不明确,还有待进一步研究。
抑制肿瘤细胞侵袭和转移是抗癌药的又一重要靶点。研究表明,五味子乙素能抑制P-AKT、p-mTOR和MMP-9的表达,剂量依赖性的抑制恶性胶质瘤细胞系U251和U87细胞的迁移和侵袭[20]。上皮间质转化(epithelial mesenchymal transition,EMT)是指上皮细胞失去极性和细胞获得间质特性从而增加细胞转移和侵袭能力的过程[21,22],是多种肿瘤发生转移和侵袭的重要过程。E-cadherin是一种重要的细胞黏附因子,参与并介导细胞之间相互黏附,与多种肿瘤的侵袭转移有不可分割的联系,它的低表达或者表达缺失被认为是肿瘤上皮间质转化的关键步骤。为了进一步探讨党参多糖对HepG2细胞的作用,我们检测了细胞迁移、侵袭和EMT相关蛋白的表达水平,结果表明:党参多糖明显抑制HepG2细胞的迁移和侵袭能力,并下调间质标记蛋白、上调上皮间质蛋白表达,从而抑制肿瘤细胞的侵袭和迁移能力。
众所周知,PI3K隶属于磷脂激酶家族,机体内多种生长因子均能激活PI3K产生第二信使PIP3,进而结合活化含有PH结构域的苏氨酸激酶AKT,参与调控细胞增殖、分化、迁移和凋亡等多种信号传导,其中也包括癌症[23]。研究表明,调节PI3K/AKT通路能影响三阴性乳腺癌(triple-nagative breast cancer,TNBC)细胞的增殖、侵袭和迁移能力,抑制大肠癌细胞的增殖、迁移和侵袭,同时促进其细胞凋亡[24,25]。Liu等[26]研究发现,苦参碱(Oxymatrine,OMT)和/或奥沙利铂(OXA)联用处理结肠癌细胞系HT29和SW480,能通过降低PI3K/AKT通路相关蛋白表达而诱导结肠癌细胞发生凋亡。我们的研究也证实,PI3K/Akt信号通路的磷酸化激活降低是党参多糖抑制HepG2细胞生长和运动能力的作用机制,但党参多糖对HepG2细胞的这种作用是否还有其他信号通路的参与还有待进一步研究。
本文研究表明,党参多糖能抑制体外培养的人肝癌HepG2细胞增殖、侵袭和迁移能力,并促进其细胞凋亡发生;影响上皮间质转化相关蛋白E-cadherin、N-cadherin、Vimentin表达上皮和下调PI3K/AKT信号通路的磷酸化激活;还能在单用或与PI3K激活剂740Y-P联用时表现出对HepG2细胞增殖、凋亡、侵袭和迁移能力的抑制作用。综上所述,党参多糖能通过抑制PI3K/AKT信号通路活化实现对人肝癌HepG2细胞生长和运动能力的抑制作用。因此,党参多糖可能是一种潜在的治疗肝癌的药物,但对其单糖成分及在党参多糖活性成分中的角色还需要进行深入的研究。
