MRI联合1H-MRS对原发性脑淋巴瘤的诊断
2020-06-05姜国锦刘宇亭
姜国锦,刘宇亭
(绍兴文理学院附属医院,浙江 绍兴312000)
原发性脑淋巴瘤(PLB)是一种少见的颅脊柱轴的非霍奇金淋巴瘤的的结外变异型,占颅脑肿瘤1%~5%[1],近年来,发病率逐渐上升且原发性脑淋巴瘤高度恶性型增加、中度恶性型减少[2]。PLB对放化疗敏感,早期诊断对临床治疗方案的制定及预后至关重要。本文收集13例经手术病理证实的原发性脑淋巴瘤的MRI影像及临床资料,并结合1HMRS对其MRI特征进行回顾性分析,旨在提高对该疾病的认识水平和术前影像学诊断。
1 资料与方法
1.1 一般资料 收集2012年1月-2018年12月本院经临床及病理确诊的原发性脑淋巴瘤患者13例,其中男8例,女5例;年龄21-75岁,平均(59.2±15.6)岁。本组所有患者未发现特异性临床症状及体征,其中主要表现为头痛头晕8例,恶心2例,视物模糊1例,言语不清1例,肢体无力2例,精神障碍2例,大部分患者以上临床表现同时存在。发现轻度偏瘫1例,共济失调1例。13例中8例接受开颅手术,术后接受化疗;5例接受立体定向穿刺活检,确诊后接受化疗联合放疗后进行MR随访检查,2例半年后死亡。术前误诊为高级别胶质瘤2例,脑梗死1例,转移瘤1例。13例均为B淋巴细胞源性非霍奇金淋巴瘤,其中弥漫性大B细胞型淋巴瘤12例,免疫母细胞型1例。患者均无器官移植病史及免疫功能缺陷病史,并经影像及其他检查排除系统性淋巴瘤。
1.2 方法 13例均采用Siemens Avanto 1.5T超导MRI扫描仪,头颅线圈,扫描参数为:横断面SE系列 T1WI(TR 450ms,TE 140ms),T2WI(TR 5000ms.TE 108ms),平面回波(EPI)系列行 DWI(TR 3800ms,TE102ms,b 值分别为 0、1000s/mm2),层厚 5-8mm。层间距1mm。13例在常规平扫基础上行MRS扫描,采用点分辨频谱分析法采集信号,成像参数:TR1700ms,TE 135ms,行多体素扫描,层厚 15mm。FOV 160mm×160mm,一次激发,波谱感兴趣区包括病变区、正常对照区。频谱分析应用机器自带软件,测定胆碱(Cho)、肌酸(Cr)、N-乙酰天门冬氨酸(NAA)、脂质(Lip)、乳酸(Lac)峰下面积及 Cho/Cr、Cho/NAA、NAA/Cr。常规平扫后经肘静脉注射对比剂(Gd-DTPA),剂量 0.2mL/kg,行横断面、冠状位及矢状面扫描。
1.3 观察指标 (1)基本征象。病灶数量(单发或多发)、发病部位、大小、形态及瘤周水肿情况[3]:0级指肿瘤周围无水肿,1级指轻度水肿且水肿带宽度≤2cm,2级指中度水肿且水肿带宽度>2cm~1/2大脑半球,3级指重度水肿且水肿带宽度≥1/2大脑半球。(2)MRI表现。平扫及增强扫描特征以及1H-MRS信号特征,测算对比Cho/Cr、Cho/NAA、NAA/Cr的变化情况。
1.4 统计学处理 采用SPSS17.0统计分析软件,计量资料用(±s)表示,采用 t检验。
2 结果
2.1 基本征象 病灶单发11例(84.6%),多发2例(15.4%),共发现病灶17个,其中脑干2个,侧脑室旁4个,枕叶3个,顶叶及颞叶各2个,小脑半球4个。病灶位于脑深部近中线区域10例(76.9%)。肿瘤形态为结节、肿块 12 个(图 1),不规则5个(图2)。10例(76.9%)可见2级以上瘤周水肿(图 3)。
2.2 MRI表现
2.2.1 平扫 病灶T1WI多呈稍低或等信号(图1A)。T2WI多呈等、稍高信号(图1B),多数病灶信号均匀,肿瘤内未见明显囊变、坏死,16个病灶周围可见不同程度水肿信号。DWI及ADC值:17个病灶中12个DWI呈均匀高信号(图4A),ADC呈低信号(图 4B),ADC 值约(0.58±0.05)×10-3mm2/s;5 个病灶DWI呈略高信号(图5A),ADC呈略低信号(图5B),ADC 值约(0.75±0.12)×10-3mm2/s。
2.2.2 增强扫描 11个病灶呈团块状、结节状明显均匀强化,其中一个呈“握拳征”(图6),6个病灶呈斑片状中度强化(图7)。
2.2.31H-MRS 13例均行患侧区与对侧镜像健侧区检查(图 7),并测算对比 Cho、Cr、NAA、Lip、Lac、Cho/Cr、Cho/NAA、NAA/Cr的变化。发现患侧区 Cho/Cr、Cho/NAA明显高于健侧区,NAA/Cr明显低于健侧区,差异均有统计学意义(P<0.05)。详见表1。
表1 患侧与健侧1H-MRS主要数据比较(±s)
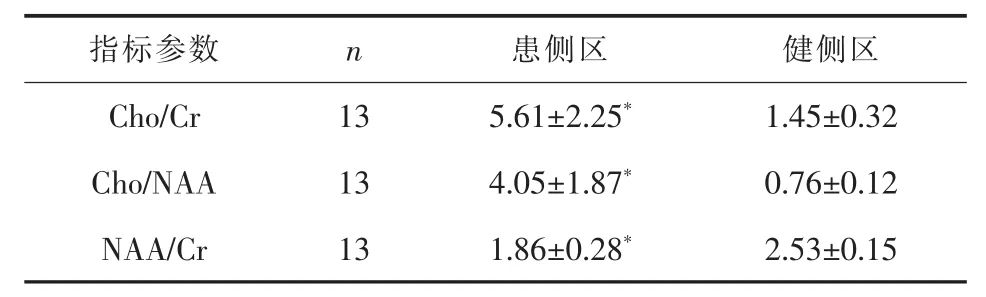
表1 患侧与健侧1H-MRS主要数据比较(±s)
与健侧区比较*P<0.05
指标参数 n 患侧区 健侧区Cho/Cr 13 5.61±2.25* 1.45±0.32 Cho/NAA 13 4.05±1.87* 0.76±0.12 NAA/Cr 13 1.86±0.28* 2.53±0.15
3 讨论
3.1 临床特征 在免疫正常人群中原发性脑淋巴瘤大约90%~95%都是弥漫性大B细胞型,T细胞罕见。本组弥漫性大B细胞型淋巴瘤12例,免疫母细胞型1例。肿瘤细胞多在Virchow-Robin间隙内聚集,呈多层环状向心性排列,并向脑实质浸润,肿瘤内有丰富的网状纤维分布,网状纤维主要为胶原蛋白,水分少[4]。原发性脑淋巴瘤好发于中老年男性,本组年龄(59.2±15.6)岁,男性 8 例(61.5%),基本符合PLB发病性别、年龄分布特点。部分病程较短,本组2例于2个月之内进展迅速,推断可能与淋巴瘤细胞恶性程度及机体免疫功能有关。发病部位多在幕上大脑半球脑室周围区,可能与这些部位血管间隙明显、更适合肿瘤生长有关[5]。本组仅4例(30.7%)发生在侧脑室周围,与样本病例少有关。临床表现多伴有认知障碍及精神行为异常,本组2例发生在颞叶,因“意识障碍”就诊,推测跟淋巴瘤浸润、破坏颞叶情感功能区有关。
3.2 MRI表现与病理对照 原发性脑淋巴瘤起源尚未完全清楚,多数学者认为中枢神经系统内无淋巴组织,肿瘤可能由脑组织血管周围未分化的多潜能干细胞分化而来[6-7]。肿瘤可单发、多发,以单发为主。肿瘤MRI一般序列中T1WI呈稍低或等信号,T2WI呈等、稍高信号,多数病灶信号较均匀,该信号与肿瘤瘤体内丰富的网状纤维及紧密的细胞排列有关[4],网状纤维主要成分为胶原蛋白,含水量很少,同时肿瘤细胞胞质少,含水量亦少,核大。本文中单发 11例(84.6%),多发 2例(15.4%),病灶T1WI多呈稍低或等信号;T2WI多呈等、稍高信号,多数病灶信号均匀,符合PLB发病数量及常规MRI信号特点。

图1 男,38岁。左侧小脑半球淋巴瘤。1A:T1WI呈等信号;1B:T2WI呈等、稍高信号,周围见明显水肿信号(白箭)。
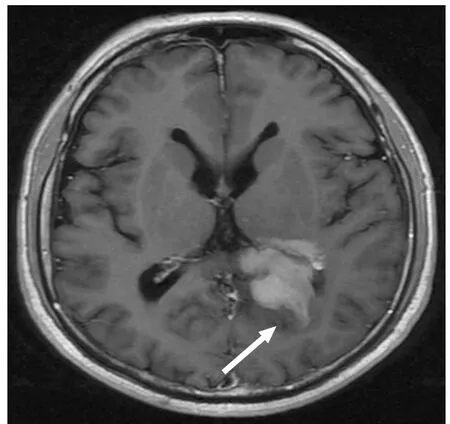
图2 男,62岁,左侧脑室旁淋巴瘤。增强后显示形态不规则(白箭)。
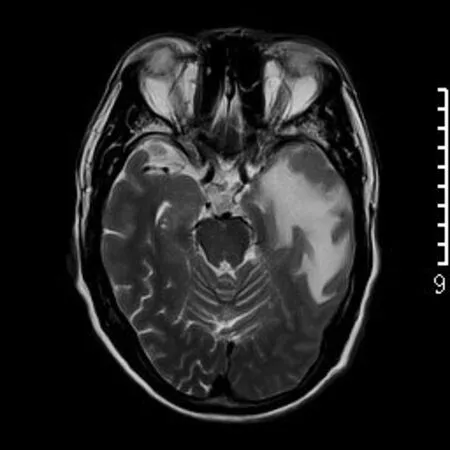
图3 男,59岁,左侧颞叶淋巴瘤周围大片水肿信号,最大宽度为2.9cm。

图4 中线结构旁淋巴瘤。4A:DWI呈高信号;4B:ADC呈低信号。
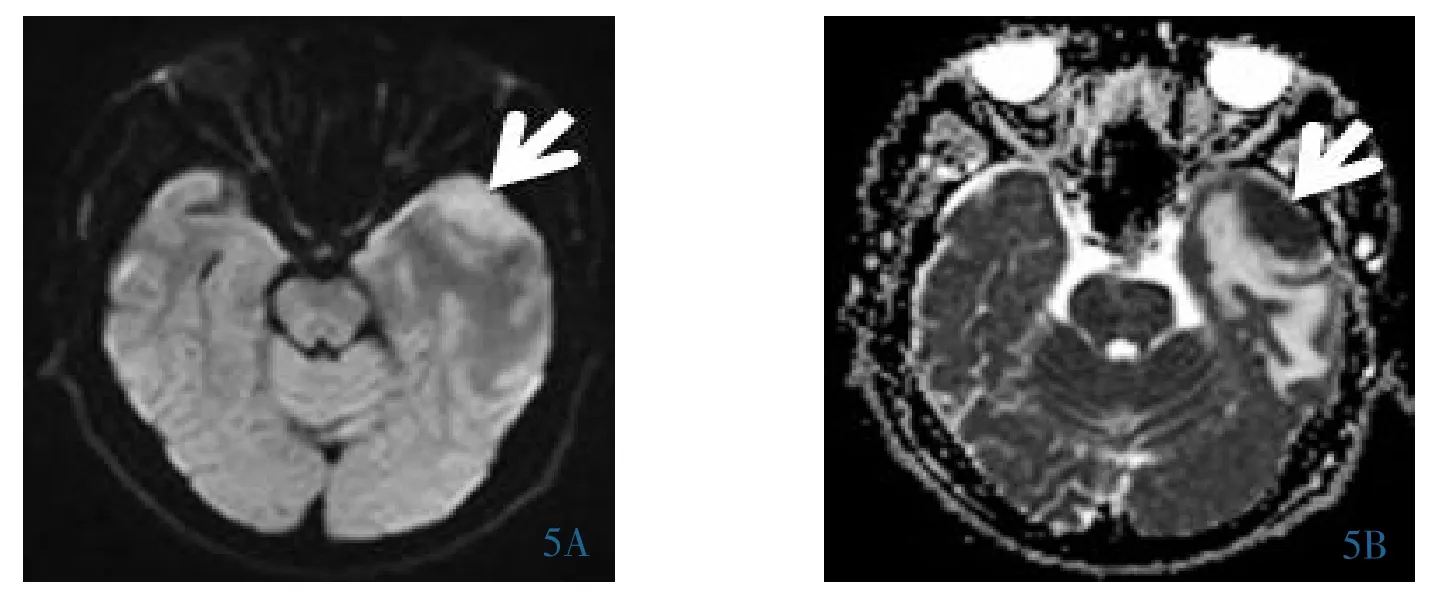
图5 左侧颞叶淋巴瘤。5A:DWI呈略高信号(白箭);5B:ADC呈略低信号。

图6 男,38岁,左侧小脑半球淋巴瘤。6A:增强后横断位及冠状位示病灶呈明显均匀结节状强化;6B:增强后病灶呈“握拳征”。

图7 男,52岁,右侧脑室后角旁淋巴瘤。7A:增强后呈斑片状中度强化;7B:患侧1H-MRS示强化区Cho(P1)峰明显升高,而 Cr(P2)、NAA(P3)峰明显减低,并且可见 Lac(P4)和 Lip(P5)峰;7C:对照组正常脑白质 1H-MRS。
PLB病理表现中典型团块状病灶可见分叶,瘤周水肿可轻可重,无特异性,肿瘤囊变坏死少见,本组8个结节、肿块状病灶可见轻度分叶,分析为肿瘤浸润周边正常脑组织后生长不均衡所致。10例(76.9%)可见2级以上瘤周水肿,推测与以下2个因素有关:(1)肿瘤破坏血脑屏障后浸润正常脑组织以及正常脑血管遭受破坏;(2)正常脑组织因肿瘤原因造成血供不足,导致血管通透性增加,细胞外水分子增多。作者认为PLB周围水肿虽然没有特异性,但仍有重要的鉴别意义。肿瘤有“嗜血管”生长的病理特点,瘤细胞沿血管周围间隙呈“套袖”样浸润生长,易破坏血脑屏障,增强后对比剂渗出到肿瘤细胞间隙,肿瘤多呈明显均匀强化。本组11个病灶呈团块状、结节状明显均匀强化。肿瘤内新生血管少,而且肿瘤供血血管常受压,增强后病灶可见“尖角征”、“握拳征”、“蝶翼征”等,可能与肿瘤破坏血脑屏障使对比剂进入细胞外间隙、肿瘤生长速度不均衡及肿瘤生长过程中受血管阻挡有关[8-9],本组4例小脑病变呈结节状强化,其余病灶均可见“握拳征”、“蝶翼征”等不规则强化征象,分析与淋巴瘤生物学特征密切相关,符合既往研究推断。
DWI是无创性检测活体组织内水分子扩散运动的方法,PBL肿瘤细胞多而密集,其细胞外间隙相对狭窄,同时细胞内水分子粘稠度高,肿瘤内水分子扩散受限,故肿瘤实质DWI多呈高信号,ADC值降低[10]。近年研究[11-13]认为,PBL的 ADC值为(0.57±0.14)×10-3~(1.01±0.16)×10-3mm2/s,本研究所有病灶弥散显示不同程度受限,平均ADC值为(0.58±0.05)×10-3mm2/s,符合既往研究。 DWI表现及ADC值对PBL诊断具有重要意义。
MRS是利用各种磁性原子核的化学位移现象来无创性测得活体组织代谢的化学成分和含量的检查方法。目前常用氢质子磁共振波谱(1H-MRS)技术。临床上常用于脑肿瘤定性诊断。多项研究[3,14]表明,与高级别胶质瘤相比,脑原发性淋巴瘤的无坏死瘤体区域显示出更高的Lip峰和Cho比值(Cho/Cr、Cho/NAA),无坏死瘤体区高耸 Lip 峰的出现对诊断原发性脑淋巴瘤有高度特异性,作者认为这与原发性脑淋巴瘤中的淋巴细胞及浸润的巨噬细胞内含有大量的脂质成分有关。本组所有病例患侧区均见Lip峰升高,Cho/Cr、Cho/NAA明显高于健侧区,NAA/Cr明显低于健侧区,符合PLB细胞代谢及生物组织学特性。
3.3 鉴别诊断 (1)胶质瘤。越高级别的胶质瘤血供越丰富,强化越明显,多呈不均匀或不规则环状强化,瘤体有大量新生血管,生长迅速,瘤体囊变坏死多见,周围水肿范围大,占位效应明显。原发性脑淋巴瘤1H-MRS:无坏死瘤体区出现高耸的Lip峰,具有较高的特异性[3,14]。本组2例术前误诊为高级别胶质瘤,1例发生在颞叶,另1例发生在小脑半球,富血供且弥散受限。分析原因:颅内胶质瘤发病率高,而原发性脑淋巴瘤相对罕见,临床及放射科医生对PLB认识不足,因此当发现颅内富血供肿瘤时,多首先考虑常见的胶质瘤。回顾性对比分析两者MRI增强图像,发现有交叉、类似表现(强化明显、弥散受限),且胶质瘤1H-MRS也可表现为Cho峰升高、NAA峰减低及Lac峰的出现,故单纯分析单个峰高很难将胶质瘤和PLB鉴别。需指出,“病灶未见明显囊变、坏死且强化均匀”这点不符合高级别胶质瘤常见影像特点。(2)转移瘤。当原发性脑淋巴瘤发生于皮层或皮层下多发时需与转移瘤鉴别,前者瘤周水肿轻、占位效应轻,增强后常见“尖角征”,后者多呈环状强化。本组1例老年男性,结肠癌根治术后3年、头晕2个月就诊,行MRI增强检查发现左侧灰白质交界区占位(多发),1H-MRS上Cho峰略增高,误诊为转移瘤。分析原因为“恶性肿瘤手术史”和“瘤周水肿明显及强化明显、均匀”对于两者均可存在,转移瘤常多发,环形强化多见。(3)脑膜瘤:颅内脑外肿瘤,形态规则,与脑膜呈广基底相连,增强后多见“脑膜尾征”。MRS检查常表现为NAA波缺失,出现明显的Ala(丙氨酸)波,而原发性脑淋巴瘤出现明显Lip波。一般脑膜瘤与PLB不难鉴别。本组术前无诊断为脑膜瘤案例。(4)脱髓鞘假瘤:急性期病变所致的脑组织坏死区可出现Lip峰,但均出现在坏死区,脱髓鞘假瘤MRS谷氨酸及谷氨酰胺峰升高有助于鉴别。本组所有病例无诊断为脱髓鞘假瘤病例。(5)淋巴瘤。少有钙化、出血、坏死囊变,增强后多见显著均匀强化,少见环形强化,通常是因为病灶内坏死,常见于免疫缺陷患者,尤其是感染HIV人群。花环状强化也常见于高级别胶质瘤。本组均无免疫功能缺陷病史,病灶未出现环形强化表现。
总之,原发性脑淋巴瘤好发于中老年人,近年来有年轻化现象。如脑内肿瘤尤其发生在非典型部位,经MRI常规检查联合1H-MRS提示肿块呈明显均匀强化,弥散受限,Cho峰升高,Cr、NAA峰降低,Lip峰升高,应考虑到本病可能性大。
