植物内生真菌来源的倍半萜对LPS诱导细胞炎症反应的抑制作用
2020-06-04黄蓉王滟张宪栋杨会祥刘吉开
黄蓉,王滟,张宪栋,杨会祥,刘吉开
(中南民族大学 药学院,民族药学国家级实验教学示范中心,武汉430074)
巨噬细胞在机体受到外来病原微生物入侵时,会分泌多种细胞因子、趋化因子、一氧化氮以及调节炎症相关蛋白而引发炎症和免疫应答.脂多糖(LPS)是革兰氏阴性菌细胞壁主要组成成分,细菌死亡溶解或用人工方法破坏细胞后才释放出来,其毒性成分主要为类脂质[1].巨噬细胞在 LPS 的诱导下,不仅细胞增殖能力和吞噬能力明显增强,还会释放大量的细胞因子和炎症介质,如一氧化氮(NO)、肿瘤坏死因子(TNF-α)、白介素-1β(IL-1β)、白介素-6(IL-6)等,这些介质会对病原微生物的入侵产生抵御作用,过量分泌则会引发炎症反应[2].
植物内生真菌(endophytic fungi)生活在健康植物各组织器官的细胞间隙或细胞内部,是植物微生态系统的重要组成部分,植物内生真菌在与宿主长期协同进化过程中构筑起宿主植物的健康保护屏障,可以产生诸如生物碱类、萜类、蒽醌类、肽类、木质素类等结构新颖且生物功能多样的次生代谢产物[3,4].目前,从药用植物内生真菌中寻找到了多种抗肿瘤、抗炎活性物质,如紫杉醇、紫杉烷、长春新碱、细胞松弛素等[5].萜类化合物是由甲戊二羟酸生物合成途径衍生而来的一类化合物,结构通式为(C5H8)n,常以含氧衍生物的形式存在;结构类型繁多,包括单萜、倍半萜、二萜、三萜、四萜等,生物活性也十分丰富,研究证明萜类化合物在抗炎活性方面有巨大的潜力[6,7].前期研究中,从马铃薯内生真菌Trichotheciumcrotocinigenum次生代谢产物中分离得到了新的倍半萜类化合物TA,结构如图1所示[8,9].本研究以LPS刺激RAW264.7细胞构建炎症反应模型,探究化合物TA对LPS诱导细胞炎症反应的抑制作用.
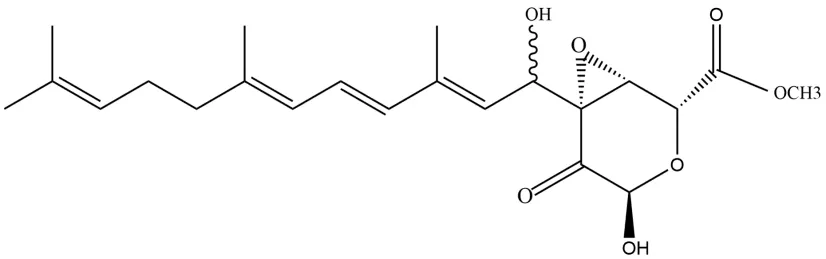
图1 化合物TA结构
1 材料与方法
1.1 材料与仪器
小鼠巨噬细胞株RAW264.7(武汉大学典型培养物保藏中心),脂多糖LPS、DCFH-DA荧光探针粉末(德国Sigma),GAPDH、iNOS兔多抗一抗(武汉三鹰);COX-2兔多抗一抗(武汉爱博泰克),HRP-山羊抗兔IgG(H+L)、NO检测试剂盒、胎牛血清(上海碧云天),ELISA试剂盒(美国BD).二氧化碳培养箱(美国Thermo Scientific),多功能酶标仪(瑞士Tecan Spark),凝胶成像系统(美国Bio-Rad).
1.2 细胞培养与活力检测
取对数生长期 RAW264.7 细胞,以 1×104个/孔接种到 96 孔板,每孔 100 μL,培养24 h后进行分组处理.空白组:加入无血清培养液;给药组:加入2.5、5、10、20、40 μmol/L系列浓度的TA,每孔100 μL,每组3个复孔,孵育24 h.弃掉旧培养基,每孔加入100 μL的0.5 mg/mL的MTT试剂,培养箱培养4 h,弃上清,加入150 μL DMSO溶解紫色结晶,15 min后,酶标仪检测各孔在570 nm处的吸光度.
1.3 细胞中NO含量的测定
取对数生长期 RAW264.7 细胞,以 1×105个/孔接种到 96 孔板,每孔 100 μL,培养24 h后进行分组处理.空白组:加入无血清培养基;模型组:加入LPS(500 ng/mL);给药组:加入LPS和不同浓度的TA(5、10、15、20、30、40 μmol/L),每孔100 μL, 每组3个复孔.孵育18 h,根据 NO 试剂盒说明书采用 Griess 法测定各孔培养上清液中 NO 的含量.
1.4 细胞内活性氧水平检测
取RAW264.7 细胞按上述接种密度接种到黑色避光96孔板中.空白组:加入无血清培养基;LPS模型组:加入500 ng/mL LPS溶液;化合物TA处理组:加入40 μmol/L的TA;化合物TA+LPS处理组:分别加入10、20和40 μmol/L的TA和500 ng/mL LPS溶液.每孔100 μL,每组3个复孔,孵育18 h.用无血清培养基稀释DCFH-DA(1∶1000),使其终浓度为10 μmol/L.去除细胞培养液,每孔加入50 μL的DCFH-DA稀释液,置于培养箱中孵育20 min.PBS洗2次,酶标仪检测细胞内荧光强度.
1.5 酶联免疫法测细胞因子的含量
取RAW264.7 细胞以 1×105个/孔接种到6孔板中,每孔2 mL,培养24 h.细胞分组及处理方法同1.4,孵育 18 h 后,收集上清液,分别按照 TNF-α,IL-1β 酶联免疫试剂盒操作说明测定OD450值.
1.6 蛋白免疫印迹测定蛋白表达
细胞接种,方法同1.5.待培养结束后用RIPA 裂解液在冰上裂解蛋白.离心取上清进行蛋白定量.加入蛋白上样缓冲液,煮沸5 min使蛋白变性,聚丙烯酰胺凝胶(SDS-PAGE)分离蛋白,再将蛋白转至 PVDF 膜上,5% BSA进行封闭,1 h后加入一抗(iNOS、COX-2和 GAPDH),于 4 ℃下孵育过夜.TBST缓冲液洗膜,加辣根过氧化物酶(HRP)标记的二抗孵育1 h后进行 ECL显影.以 GAPDH为内标,定量分析各组细胞中蛋白的表达情况.
1.7 统计学分析
2 结果与分析
2.1 化合物TA对细胞活力的影响
用 MTT 法测定不同浓度的TA对 RAW264.7 细胞活力的影响,结果如图2所示.化合物TA作用浓度在 2.5 ~40 μmol/L范围时,相比空白组,细胞存活率无明显变化,说明该化合物对细胞无毒性.
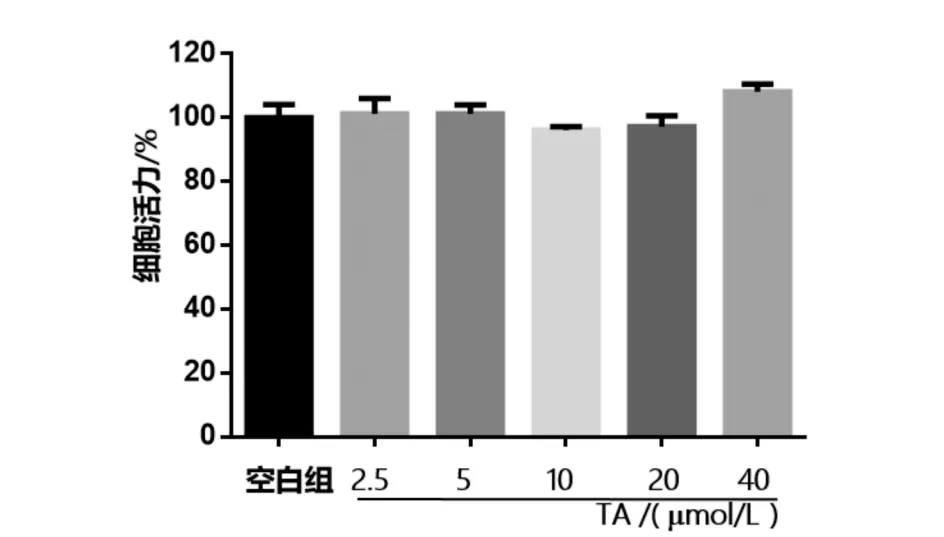
图2 不同浓度TA对RAW264.7细胞活力的影响
2.2 化合物TA对LPS诱导的RAW264.7细胞释放NO的影响
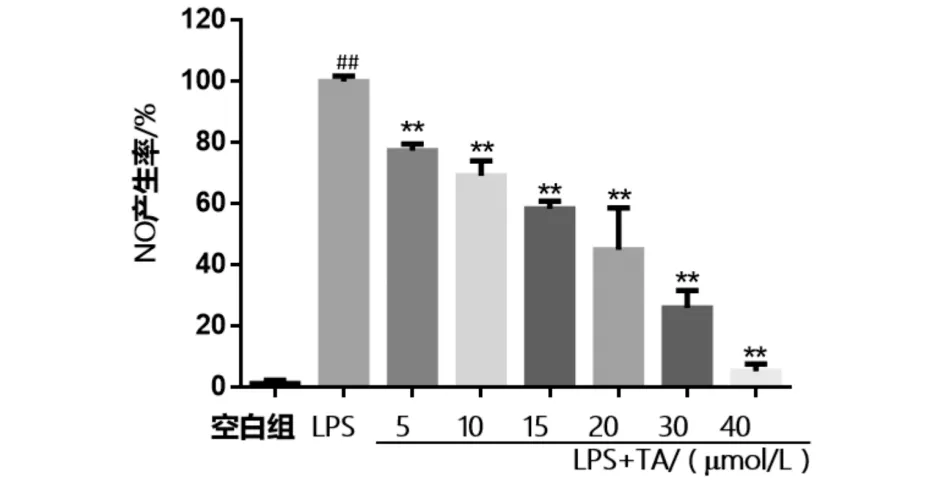
##表示与空白组差异极显著;*表示与LPS组差异显著,**表示与LPS组差异极显著(下同)
LPS刺激RAW264.7细胞后,细胞上清液中的NO释放量较空白组明显增加(P< 0.01),说明LPS诱导的炎症模型建立成功(图3).而加入不同浓度TA的给药组相比LPS模型组均能显著降低上清中NO的含量(P< 0.01),浓度在5 ~40 μmol/L范围内呈一定的剂量依赖性,半抑制浓度IC50值为18.53 ± 0.43 μmol/L,表明该化合物在LPS诱导产生炎症的情况下能有效抑制NO的产生,发挥抗炎作用.
2.3 化合物TA对LPS诱导的RAW264.7细胞中ROS水平的影响
与空白组相比(图4),LPS刺激组ROS水平明显升高(P< 0.01).化合物TA浓度在10 μmol/L时,其ROS表达水平不变;当TA浓度增加到20、40 μmol/L时,ROS水平明显降低(P< 0.01),说明一定浓度的TA可以降低细胞内ROS水平.
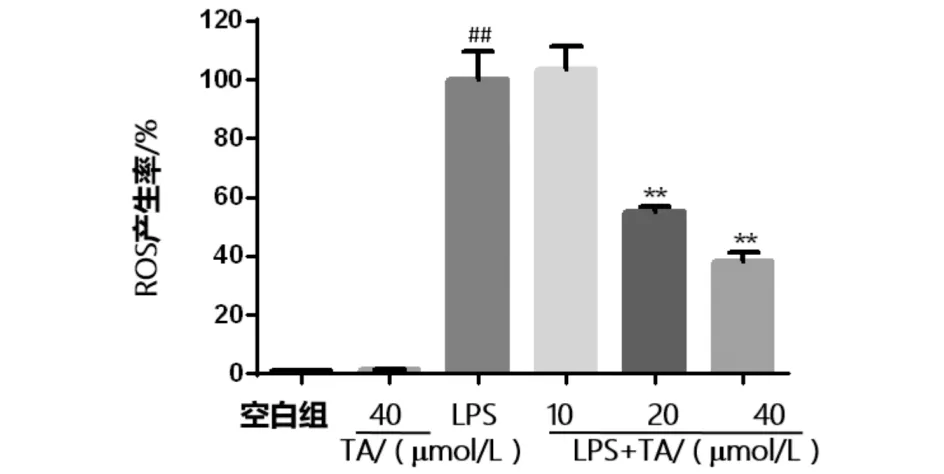
图4 TA对LPS诱导的RAW264.7细胞中ROS水平的影响
2.4 化合物TA对LPS诱导的RAW264.7细胞中的TNF-α、IL-1β含量的影响
在没有LPS刺激时加40 μmol/L TA,炎症细胞因子TNF-α、IL-1β释放量与空白组相比无明显变化,而LPS组细胞上清中的TNF-α、IL-1β含量都明显增多(P< 0.01).与LPS组相比,加药组的TNF-α、IL-1β含量呈现剂量依赖性降低,且20和40 μmol/L时显著降低(P<0.01),说明化合物TA能够通过抑制炎症因子TNF-α、IL-1β的生成,从而发挥抗炎作用(图5).
2.5 化合物TA对LPS诱导下iNOS、COX-2蛋白表达的影响
iNOS(诱导型NO合成酶)是机体活性氮自由基产生的催化酶;COX-2 在正常细胞中表达量很低,但是在被激活的巨噬细胞和其他炎性细胞中表达水平会迅速上升,二者都是反映炎症的重要标志酶[9].用蛋白免疫印迹法检测RAW264.7细胞中iNOS、COX-2蛋白的表达量,结果如图6所示,空白组中iNOS、COX-2 蛋白表达量较低;与空白组相比,LPS组的iNOS、COX-2表达量显著增加(P<0.01);与LPS组相比,给药组的iNOS、COX-2表达量随着TA浓度的增加而减少,20和40 μmol/L时显著降低(P<0.01),表明化合物TA可以通过下调iNOS、COX-2的表达量发挥抗炎效果.

图5 化合物TA对LPS诱导的RAW264.7细胞TNF-α、IL-1β释放量的影响
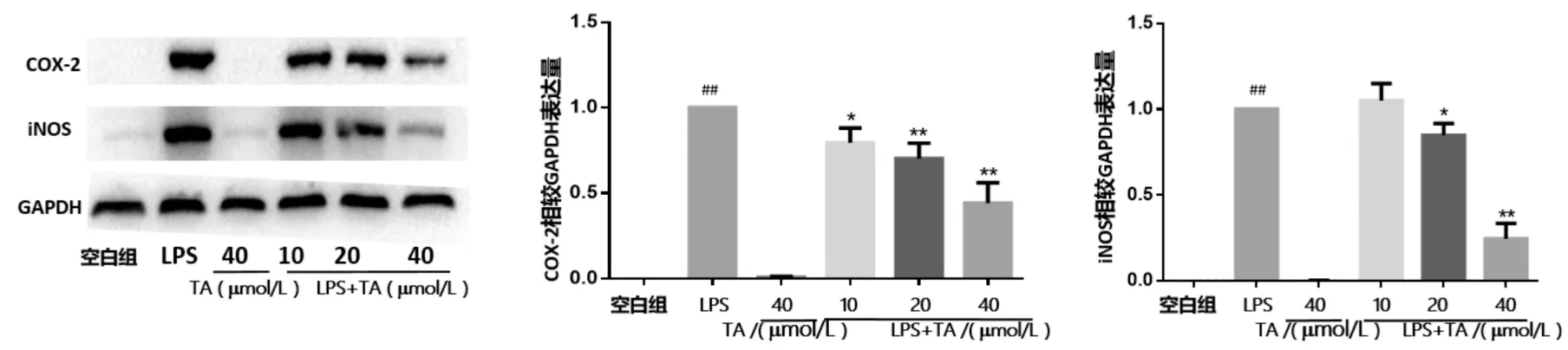
图6 化合物TA对LPS诱导RAW264.7细胞iNOS、COX-2蛋白表达量的影响
3 结语
通过LPS诱导RAW264.7细胞构建体外炎症反应模型,探究了马铃薯内生真菌Trichotheciumcrotocinigenum次生代谢产物中新型倍半萜类化合物TA的抗炎作用.MTT检测试验表明其对细胞无毒性,与LPS模型组相比,可以剂量依赖性地降低细胞上清液中NO,炎症细胞因子TNF-α、IL-1β的释放量,降低细胞内活性氧水平,表现出显著的抗炎活性.中、高浓度的化合物TA可以抑制LPS刺激RAW264.7细胞中的iNOS、COX-2蛋白的表达,说明化合物TA的抗炎机制与iNOS、COX-2蛋白转录水平表达有关.炎症反应的经典信号通路主要包括JAK/STAT、NF-κB和MAPK,且3条信号通路之间存在复杂的交汇作用.因此,从这3条通路出发可对倍半萜类化合物TA的抗炎机制进行更细致深入的研究,为找寻有效抗炎方法提供新思路.
