EGFR、P53、Ki-67在结直肠癌中表达及临床病理学意义
2020-06-02焦俊霞叶晓霞
焦俊霞 叶晓霞
(马鞍山市中心医院病理科,安徽 马鞍山 243000)
结直肠癌是我国常见的消化系统恶性肿瘤之一,发病率位居恶性肿瘤第4位,死亡率居第5位〔1〕。结直肠癌的发生、发展与肠上皮细胞的凋亡、增殖速度密切相关,多种基因、信号蛋白参与了这个过程;其中,表皮生长因子受体(EGFR)、P53基因主要通过调控细胞周期,进而调节细胞的增殖与分化,对肿瘤的发生、进展起重要作用。Ki-67是与细胞增殖密切相关的核抗原,是评估人体各种组织、细胞增殖简单可靠的指标。EGFR、P53、Ki-67均参与了肿瘤细胞的增殖与分化。本研究采用免疫组化法检测结直肠癌组织中EGFR、P53及Ki-67蛋白的表达,并进一步分析其与临床病理特征之间的关系。
1 材料与方法
1.1材料 收集2015年1月至2018年1月马鞍山市中心医院病理科存档的87例结直肠癌手术标本,所有病例手术前未行临床治疗(如放疗、化疗)。同时选取同病例癌旁正常肠黏膜87例作为对照。根据国际抗癌联盟/美国癌症联合会(UICC/AJCC)第8版消化道肿瘤TNM分期系统进行临床病理分期。
1.2试剂与方法 所送检手术标本常规采用4%甲醛溶液充分固定,石蜡包埋后4 μm厚连续切片,并进行苏木素-伊红(HE)染色及免疫组化标记。采用S-P免疫组化法,每例分别检测EGFR (克隆号SP9)、P53(克隆号SP5)、Ki-67(克隆号MIB-1)蛋白的表达,并设立阴性对照。本研究所用抗体及免疫组织化学试剂盒均购于福州迈新生物技术开发公司。
1.3结果判断 EGFR阳性表达定位于细胞膜。其阳性程度判断根据阳性细胞数比例分4级:无阳性细胞(-),<25%(+)、25%~50%(),≥50%(),细胞的染色深浅不作为判断阳性程度的指标。P53和Ki-67阳性表达定位于细胞核。P53阳性程度判读根据染色强度和阳性细胞数评分:1分为淡棕色,2分为棕黄色,3分为棕褐色; 阳性细胞数≤25%为1分,26%~50% 为2分,51%~74%为3分,≥75%为4分; 染色程度评分与阳性细胞数评分相加:0~1分为阴性(-),2~3分为弱阳性(+),4~5分为中度阳性(),6~7分为强阳性()。Ki-67阳性细胞分3个等级:Ⅰ级为阳性细胞数<10%(-),Ⅱ级为10%~50%(+),Ⅲ级为>50%() 。评分过程由2名病理科医生独立完成。
1.4统计学方法 应用SPSS19.0软件进行χ2检验或Fisher的精确检验法、Pearson相关分析。
2 结 果
2.1EGFR、P53和Ki-67在结直肠癌和癌旁组织中的表达 EGFR、P53蛋白在结直肠癌组织中阳性表达率分别为35.6%(31/87)、65.5%(57/87),而癌旁正常肠黏膜组织几乎不表达〔2.3%(2/87)、4.6%(4/87)〕,差异有统计学意义(χ2=31.449、70.908,均P=0.000)。Ki-67蛋白在结直肠癌组织中阳性表达率为95.4%(83/87),而癌旁正常肠黏膜组织内Ki-67蛋白仅在腺体颈部有少量细胞核染色,阳性表达率为4.6%(4/87),差异有统计学意义(χ2=158.703,P=0.000)。EGFR、P53和Ki-67蛋白在结直肠癌组织同时阳性表达26例(29.9%)。见图1,图2。

图1 EGFR、Ki-67、P53在癌旁正常黏膜组织中的表达(免疫组化,×200)
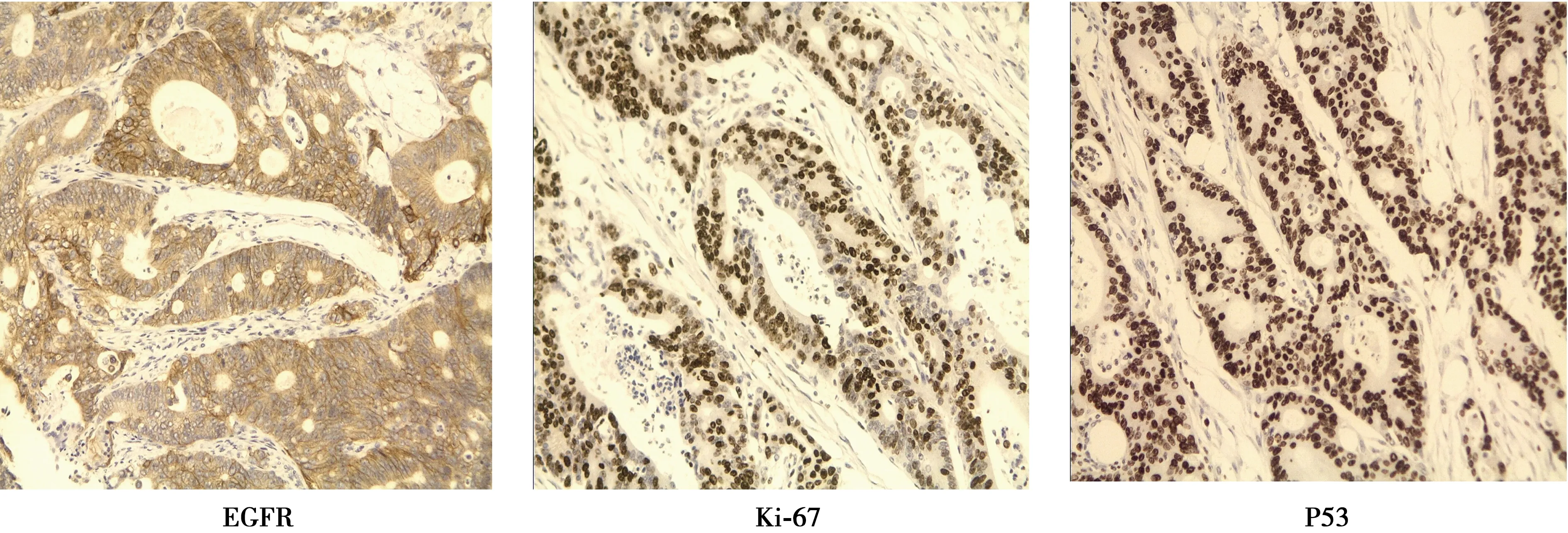
图2 EGFR、Ki-67、P53在结直肠癌中的表达(免疫组化,×400)
2.2EGFR、P53和Ki-67蛋白表达与结直肠癌临床病理特征的关系 EGFR、 P53和Ki-67蛋白阳性表达与肿瘤分化程度、TNM分期及淋巴结有无转移有显著相关性,即随肿瘤进展其阳性表达率增高(P<0.05);与患者年龄、性别、大体类型无相关性(P>0.05)。见表1。
2.3EGFR、P53和Ki-67表达的相关性 在结直肠癌组织中EGFR与P53蛋白表达呈正相关,即随肿瘤进展其阳性表达率增高(r=0.287,P=0.007);Ki-67与EGFR、P53表达无相关性(r=0.163、0.049,P=0.131、0.654)。

表1 EGFR、 P53 和 Ki-67 蛋白阳性表达与临床病理特征的关系(n)
3 讨 论
EGFR为酪氨酸蛋白激酶家族成员之一,属于酪氨酸激酶Ⅰ型受体,当其与配体结合后可活化下游RAS/RAF/MAPK和PI3K/AKT/mTOR通路从而启动信号转导,进而诱导肿瘤细胞增殖、分化和侵袭〔2〕,其过度表达常提示肿瘤患者可能预后差、转移早、生存期短〔3〕,可作为判断结直肠癌进展、预后和转归的指标。本研究结果显示,结直肠癌组织中EGFR表达水平与肿瘤的分化程度、TNM分期及淋巴结转移情况显著相关,与邵好青等〔4〕报道基本一致。近年来关于结直肠癌的治疗,EGFR作为一个重要药物靶点,有两类EGFR拮抗剂获准应用于临床,分别为抗EGFR单克隆抗体(如西妥昔单抗、帕尼单抗)和小分子EGFR酪氨酸激酶抑制剂(如埃罗替尼和吉非替尼)。
P53基因是调控人体细胞增殖与凋亡的重要基因,有野生型和突变型两种分型。野生型P53基因存在于人体正常细胞中,是一个非常重要的抑癌基因。其作用机制为与细胞周期蛋白结合形成复合体,抑制细胞周期依赖性蛋白激酶(CDK)活性,使细胞停滞在G1期或引起细胞程序性死亡〔5〕。野生型P53半衰期短,免疫组织化学难以检测。当机体细胞受到物理、化学因素刺激或自身机体的改变后,野生型P53基因发生自身空间结构改变,转变为癌基因(即突变型P53),失去了抑制CDK活性的功能,失去了调控机体细胞增殖、凋亡和DNA修复的作用,进而失去了抑制肿瘤形成的生物学特性,且进一步促进了机体细胞增殖及恶性转化〔6〕,因此,可将突变型P53作为判断结直肠癌浸润、转移能力的指标之一。由于突变型P53蛋白具有不易水解、半衰期长的特性,目前S-P免疫组化法检测到的均为突变型P53。本研究结果示,P53蛋白表达水平与结直肠癌的分化程度、TNM分期、淋巴结转移显著相关,而癌旁正常黏膜几乎未见P53的阳性表达,与温玉婷等〔7〕报道结果基本相符。P53基因可能成为结直肠癌治疗的另一个重要药物靶点。有学者提出以下理论策略,干预P53与MDM2的相互作用、降解突变型P53蛋白、抑制突变P53下游信号转导通路、RNA干扰突变P53表达、恢复突变P53构象等〔8〕。目前还没有相应靶向药物应用于临床。
Ki-67是由MKI-67基因编码的核蛋白,是一种核基质,为DNA复制提供场所,并参与染色体支架的组成,具有非组蛋白的特点,其功能与细胞有丝分裂密切相关〔9〕,在G1后期出现,在S、 G2期逐渐上升,至M期达到高峰,细胞有丝分裂后迅速减少,在G0期不表达,是表示细胞增殖程度的一项可靠指标。目前,有关Ki-67表达水平与结直肠癌的生物学行为之间的关系尚未达成共识。赵岩等〔10〕研究显示,Ki-67蛋白的表达与结直肠癌TNM分期及淋巴结转移有显著相关性。而李伟等〔11〕研究显示,Ki-67蛋白在直肠癌中的过表达与肿瘤Dukes分期、组织学分化程度等临床病理参数无明显相关性。本研究结果显示,Ki-67在肿瘤细胞中高表达,随肿瘤细胞分化程度降低、TNM分期增高及淋巴结转移,Ki-67的表达指数明显增高。Ki-67表达水平能反映肿瘤细胞的增殖状态,可作为判断结直肠癌生物学行为的一项指标。关于Ki-67蛋白表达与结直肠癌临床病理参数、转移、复发及预后关系的不同报道,可能是由于样本数量、实验评判标准或地域差异性有关,还需要进一步扩大样本量深入探讨。
关于P53、EGFR和Ki-67在结直肠癌中的表达,我国已有单项或两项小样本研究,尚缺乏关于三者同时表达的研究报道。本组研究结果提示三者均参与了肿瘤细胞的无限增殖,随肿瘤进展其阳性表达率增高,三者之间可能存在一定关联。EGFR/PI3K/Akt信号通路可以通过激活CDK4来抑制P21Cipl和P27 Kip2(P21和P27为CDK抑制蛋白)的表达,使其在胞质中堆积而无法与CDK连接,进而促进细胞由G1期向S期进展,促进细胞的增殖和分化及肿瘤的发生、发展〔12〕;突变型P53蛋白失去抑制CDK活性,使细胞肿瘤细胞无限增殖〔6〕。由此推测,EGFR、P53均可通过调节CDK的活性,进一步调控肿瘤细胞的增殖与分化。本研究结果显示,在结直肠癌组织中EGFR与P53表达呈正相关。Ki-67核抗原的表达随细胞增殖周期的变化而变化,半衰期短,不易受生长因子诱导,直接反映肿瘤细胞的增殖活性。本研究结果显示,在结直肠癌组织中Ki-67与EGFR、P53的表达无相关性。近年来,有关恶性肿瘤的精准医疗及个性化治疗的提出,单靶点分子靶向药物广泛应用于临床治疗,如抗EGFR拮抗剂(如西妥昔单抗、贝伐珠单抗等)的应用,晚期结直肠癌患者的生存期得到了显著改善,但也存在一些弊端,在RAS基因突变后抗EGFR类药物的疗效不佳〔13〕。由于在肿瘤发生及发展过程中,有许多基因参与,信号通路之间相互关联,因此多个基因的联合检测将成为下一步的研究重点。本研究联合检测P53、EGFR和Ki-67有利于对结直肠癌进展、预后、新辅助及辅助化疗的效果进行评估,并为结直肠癌的个性化治疗及分子靶向治疗提供科学依据。
