胶质母细胞瘤中circPITX1表达、功能及临床意义
2020-06-02陆正刘建刚
陆正 刘建刚
(1南通大学附属海安医院神经外科,江苏 海安 226600;2苏州大学第一附属医院神经外科)
胶质母细胞瘤(GBM)是一种高级别胶质瘤,是人类最致命的癌症之一〔1,2〕。尽管手术、放疗和化疗等多种治疗手段得到了长足发展,GBM患者的预后仍然很差,5年生存率不足5%〔3,4〕。GBM的发生和进展是一个复杂的过程,涉及多种分子和表观遗传学的变化〔5〕。因此,寻找与GBM发生发展相关的新的生物标志物将对了解GBM的疾病进程及评价疾病预后有很大帮助。环状RNA(circRNA)是一类内源性RNA,不同于线性RNA,它的结构为一个共价闭合的连续环,而且往往比线性mRNA更加稳定〔6,7〕,以各种各样的方式对基因表达起着调控作用。研究表明,circRNA在多种肿瘤中异常表达,可作参与各种肿瘤生物学进程〔8~10〕。
到目前为止,在GBM中有关circRNA的研究仍然很少。本研究使用circRNA高通量测序技术发现了一些在GBM中异常表达的circRNAs,同时选取表达差异最大的circRNA-hsa_circ_0074027进行研究,将其命名为circPITX1,并在GBM中验证其表达、探寻其生物学功能及临床意义。
1 材料和方法
1.1患者和组织样本 GBM组织及相应正常脑组织(NBTs)共42对取自于南通大学附属海安医院进行手术的患者。本研究经医院研究伦理委员会批准,且患者均签署知情同意书,标本均经病理证实。
1.2circRNA测序 用TRIzol试剂(Invitrogen,USA)提取3对GBM组织和相应正常脑组织的总RNA。用RNase R试剂(Epicentre Technologies,USA)消化RNA,去除线性RNA,丰富circRNA。在Illumina HeSeq 2000平台(Illumina,USA)上进行测序分析。测序结果用Cluster3.0软件(University of Tokyo,Human Genome Center)进行分析。
1.3细胞培养及转染 人GBM细胞系U251、U87、A172、LN229及正常人星形胶质细胞系NHA均来自美国ATCC公司。细胞均在DMEM培养基(Gibco,USA)中培养,辅以10%胎牛血清(Gibco)。所有细胞系在37℃,含5% CO2的湿润环境中培养。采用Lipofectamine 3000试剂(Invitrogen)将circPITX1 siRNA转染入U251和LN229细胞;circPITX1 siRNA的靶序列为GCGUGCUAAGCACCUGGCGCA。
1.4RNA提取和qRT-PCR 用Trizol试剂(invitrogen)从GBM组织及细胞株中提取总RNA。逆转录试剂盒(Takara,日本)将RNA反转录为cDNA。qRT-PCR实验使用SYBR Green Real-time PCR Master Mix(Takara),并在Roche LightCycler 480实时PCR系统(Apple BioSosies)上进行。用2-ΔΔCt法计算circPITX1相对表达量,以GAPDH为内参。引物序列如下:circPITX1-正义链:5'-CCATAGTCCGAGCGTGCTAA-3',circPITX1-反义链:5'-G-TCTGTCTTAAAGCGACAGCG-3';GAPDH正义链:5'-TATGATGATATCAAGAGGGTAAGT-3',GAPDH反义链:5'-TGTATCCAAACTCATTGTCATAC-3'。
1.5细胞增殖及迁移能力测定 使用特异性siRNA在GBM细胞中沉默circPITX1(circPITX1 siRNA组),未沉默circPITX1为NC组,进行体外细胞功能实验。在U251和LN229细胞中转染circPITX1 siRNA测定细胞的增殖及迁移能力。用CCK-8试剂盒(beyotime,中国)测定细胞增殖活性。将U251和LN229细胞接种于96孔板中,密度为2×103/孔。在不同时间点,在每孔中分别加入100 μl无血清培养基和10 μl CCK-8溶液。然后将培养板在37℃下孵育1 h。在分光光度计上测量450 nm处的吸光度。细胞迁移能力采用划痕实验来评估。细胞在6孔培养板中培养至90%融合,用无菌的10 μl微量移液管尖端轻轻地划伤附着的细胞,在单层细胞中形成一个划痕(时间0 h)。随后,用无血清培养基孵育细胞24 h,用显微镜拍摄细胞迁移情况。
1.6统计学分析 统计学分析运用SPSS20.0软件进行t检验或单因素方差分析比较组间差异;生存分析采用Kaplan-Meier法统计,单因素及多因素分析采用Cox比例风险回归模型。
2 结 果
2.1GBM组织中circRNA表达谱分析 9个circRNA表达明显上调,8个circRNA表达明显下调(差异倍数>2,P<0.05,图1)。其中hsa_circ_0074027即circPITX1表达明显上调,且差异倍数最大(差异倍数=8.34,图1)。
2.2circPITX1在GBM组织和细胞系中高表达 GBM组织中circPITX1的表达量(2.608±1.207)明显高于正常脑组织NBTs(1.279±0.704,P<0.05)。U251、U87、A172、LN229细胞系及NHA细胞系中circPITX1的表达分别为(2.593±0.065)、(1.790±0.111)、(2.377±0.070)、(2.793±0.169)、(0.997±0.085)。GBM细胞系中circPITX1的表达同样上调(P<0.05)。证实circPITX1在GBM组织和细胞系中高表达。
2.3circPITX1水平与GBM患者临床病理因素的相关性 根据用circPITX1相对表达量的中位数将42例GBM患者分为circPITX1高表达组(n=21)和circPITX1低表达组(n=21),通过与患者临床病理因素进行比较发现,circPITX1的表达与肿瘤直径和远处转移相关(P<0.05)。见表1。表明circPITX1的表达量能够提示GBM的进展情况。
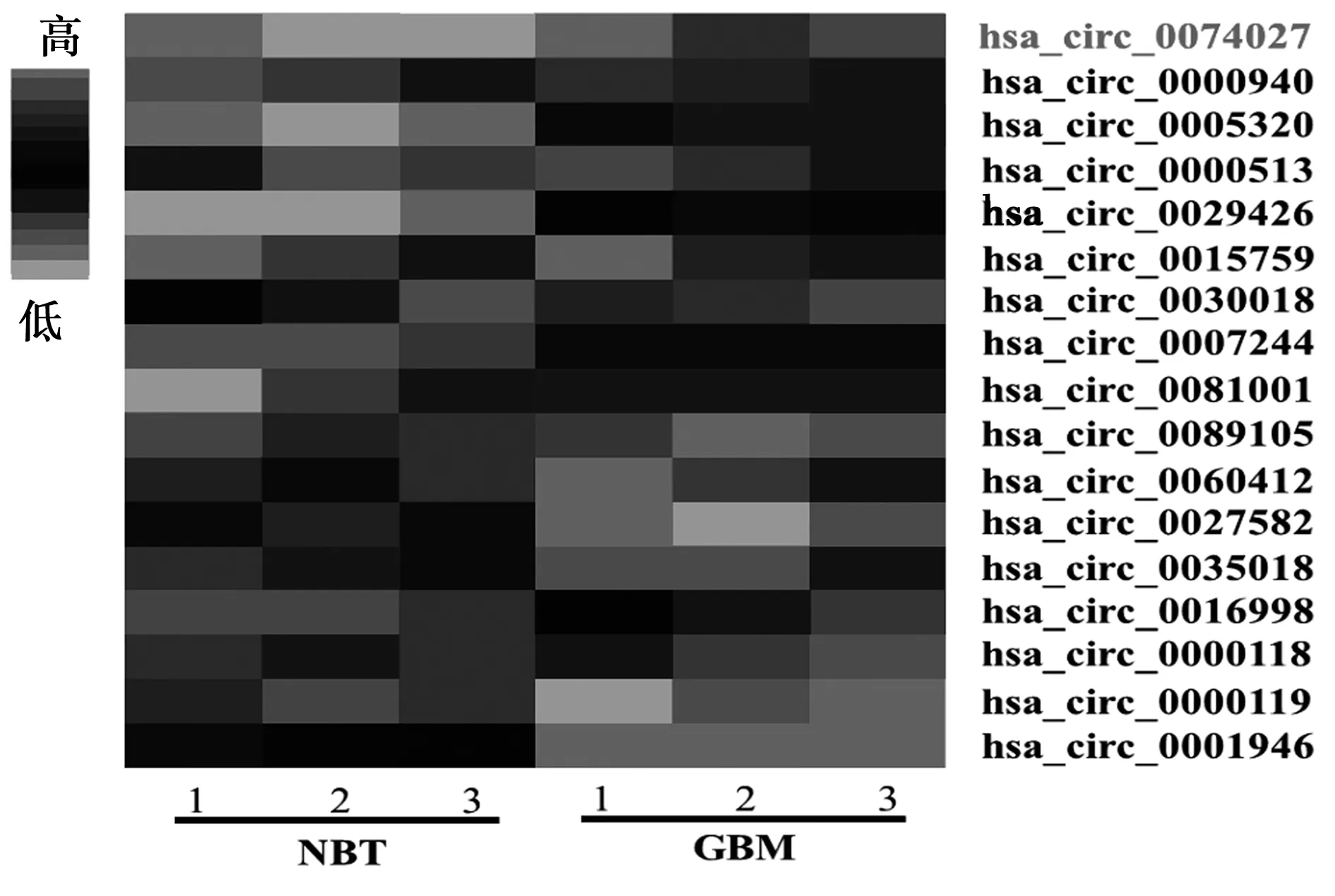
图1 GBM组织中circRNA表达谱
表1 circPITX1表达与GBM患者临床病理因素关系(n)

临床因素ncircPITX1高表达组circPITX1低表达组P值性别 男 女25171291380.753年龄 ≤60岁 >60岁30121471650.494肿瘤直径 ≤5 cm >5 cm18245161380.013术前KPS(分) ≤70 >7016264171290.121IDH1突变 是5230.634 否371918肿瘤家族史 是8350.432 否341816远处转移 是171430.001 否25718
KPS:卡氏评分
2.4circPITX1水平与GBM患者预后的关系 如图2所示, Kaplan-Meier生存分析结果表明,circPITX1高表达组GBM患者的总体生存时间明显低于circPITX1低表达组(P<0.05)。因此, circPITX1的表达可作为预测GBM患者预后的生物学标志物。
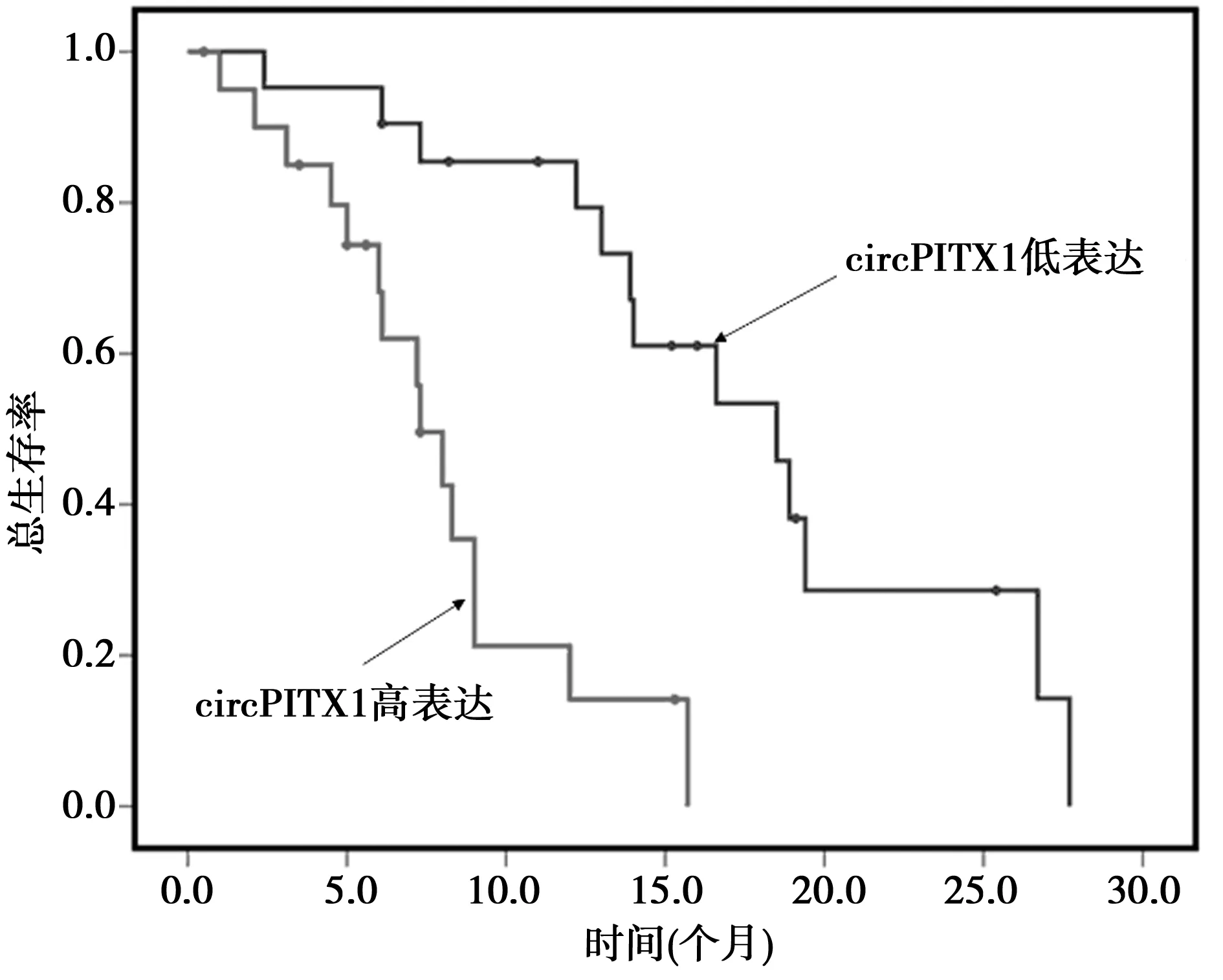
图2 circPITX1高表达组与低表达组GBM 患者的总体生存情况对比
2.5circPITX1水平是影响GBM患者预后的独立危险因素 如表2所示,COX单因素分析表明术前KPS、远处转移和circPITX1水平是影响GBM患者预后的危险因素。而COX多因素分析表明,术前KPS和circPITX1是影响GBM患者预后的独立危险因素。此结果表明circPITX1水平是影响GBM患者预后的独立危险因素。
2.6circPITX1促进GBM细胞增殖和迁移 circPITX1促进GBM细胞增殖和迁移(P<0.05),见表3、4,图3。
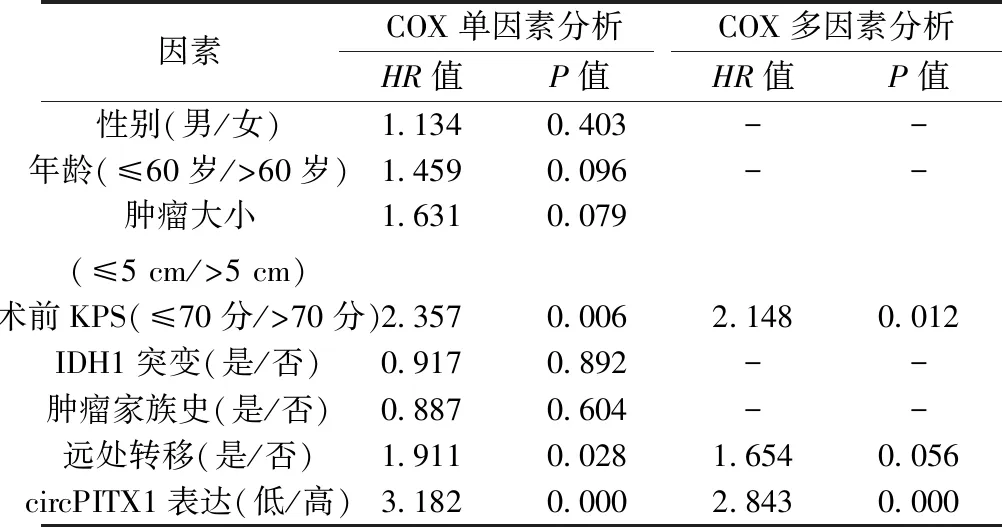
表2 影响GBM患者总体生存的单因素及多因素分析
表3 两组circPITX1表达及迁移活性比较
与NC组比较:1)P<0.05;下表同
表4 两组培养不同时间细胞增殖情况比较
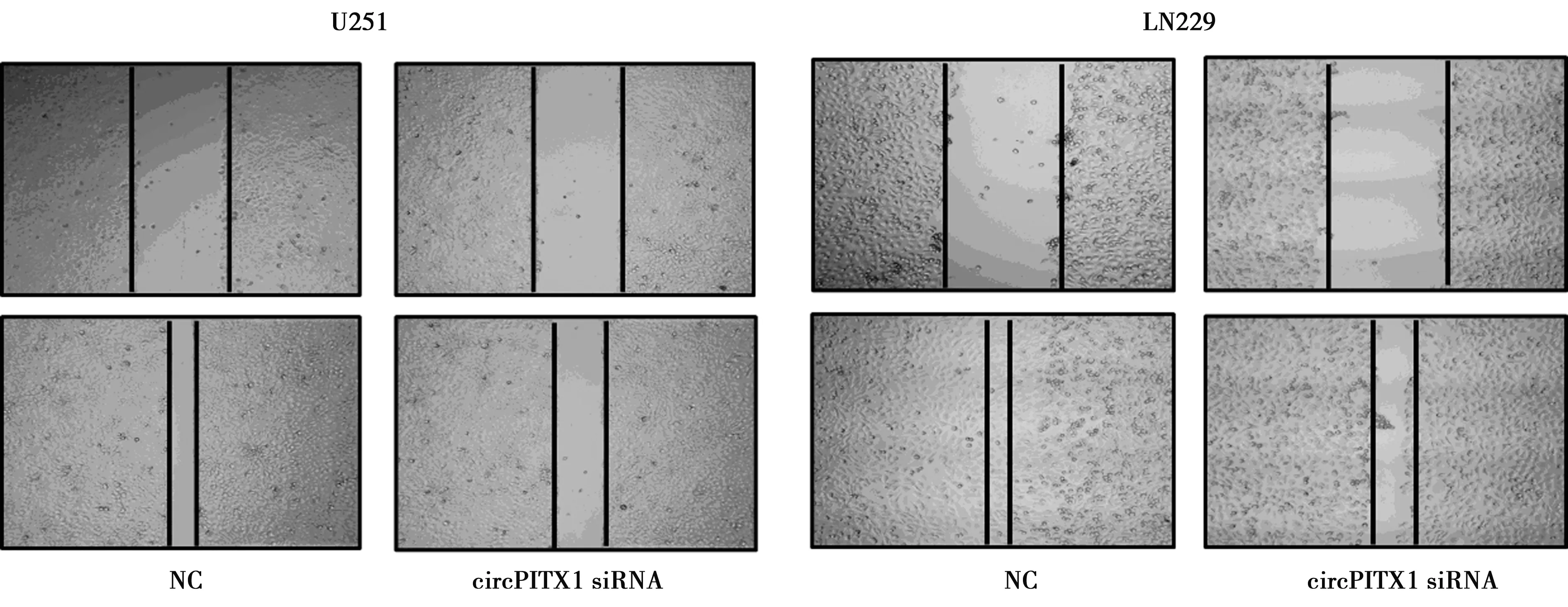
图3 circPITX1 siRNA对U251和LN229细胞迁移的影响
3 讨 论
随着高通量测序技术的发展,越来越多的非编码RNA被发现在肿瘤中异常表达。而circRNA作为新兴分子,在近年来越来越受到关注。而且,研究辨明circRNA的异常表达在多种肿瘤的发生和进程中发挥重要作用。Cheng等〔11〕通过检测肺鳞状细胞癌中circRNA的表达谱发现circTP63表达上调,其上调与肺鳞状细胞癌患者肿瘤大小和TNM分期有关,且circTP63在体内外都能促进细胞增殖;Jiao等〔12〕通过微阵列芯片发现hsa-circ-0000745在宫颈癌中高表达,并通过减少E-cadherin的表达,增强了细胞的增殖、迁移和侵袭能力。
在GBM中,也有有关circRNA的相关研究,但很少。Xia等〔13〕的研究表明circ-AKT3在GBM组织中的表达降低,其编码一种174个氨基酸,能够降低GBM细胞的增殖能力、抗辐射能力和体内致瘤性;Lu等〔14〕报道circ_0001730通过mir-326/WNT7b轴激活wnt/β-catenin通路促进GBM细胞的生长和侵袭;Li等〔15〕通过检测circRNA表达谱发现circ_0001946 在GBM细胞中表达降低,且证实circ_0001946 /miR-671-5p/CDR1通路对GBM的发生发展具有调节作用。因此,circRNAs可能通过多种方式参与了GBM的生物学进程,并在这些过程中可以作为生物学标志物提示GBM的疾病进程。
本研究结果表明,circPITX1在GBM组织和细胞中高表达并可促进GBM细胞增殖和迁移,其表达量可作为提示GBM的进展情况及预测GBM患者预后的生物学标志物,而具体的机制仍有待探究。
