实时二维剪切波弹性成像评价急性肝衰竭大鼠肝脏硬度
2020-06-02王兴华土继政郭西源
杜 洋,王兴华*,土继政,韩 梅,郝 磊,郭西源,梁 华
(1.山西医科大学医学影像学系,山西 太原 030001;2.山西医科大学第二医院超声科,山西 太原 030001)
急性肝衰竭(acute liver failure, ALF)主要表现为严重的原发性肝脏损害,无基础肝病史,病情进展快,死亡率高达50%以上,一直以来是临床诊治的难点,受到广泛关注[1-2]。因此,开发新的诊疗方法成为亟待解决的关键问题。剪切波弹性成像(shear wave elastography, SWE)是一种量化组织成像模式,可定量测量肝组织硬度。本研究采用硫代乙酰胺(thioacetamide, TAA)诱导建立ALF大鼠模型,之后以实时二维剪切波弹性成像(two-dimensional shear wave elastography, 2D-SWE)获取肝组织弹性特征,并测量肝脏硬度值(liver stiffness measurement, LSM),分析2D-SWE对于检测ALF及预防性用药治疗后评估的价值。
1 材料与方法
1.1 实验动物及造模方法 无特定病原体(specific pathogen free, SPF)级雄性SD大鼠28只,体质量220~250 g,由山西医科大学动物实验中心提供。随机分为4组,即对照组(8只)、模型组(8只)、乳果糖组(6只)和美常安组(6只)。参考文献[3]造模方法,于实验第1~8天对乳果糖组和美常安组大鼠分别予以乳果糖[7 ml /(kg·d)]和美常安[100 mg /(kg·d)]稀释后灌胃,对照组和模型组予以等量生理盐水;实验第6、7天,模型组、乳果糖组和美常安组均腹腔注射TAA[200 mg /(kg·d)],对照组注射等量生理盐水。TAA由上海凛恩科技发展有限公司提供,乳果糖口服溶液和美常安由北京韩美药品有限公司提供。
1.2 肌电图检查 采用DISA Keypoint肌电诊断仪,测量脑干听觉诱发电位(brainstem auditory evoked potential, BAEP)。实验第8天监测BAEP Ⅰ波的潜伏期及发生率,每项监测指标重复测量2次以上;以对照组BAEP Ⅰ波潜伏期±1.96s作为正常值,超过此值即诊断为轻微肝性脑病[3](minimal hepatic encephalopathy, MHE)。
1.3 超声检查 使用GE Logiq E9彩色多普勒超声诊断仪,9L线阵探头,频率9 MHz,具备2D-SWE技术。麻醉大鼠后于前胸及腹壁备皮并保定,行常规超声扫查。使探头与扫查部位垂直并固定,避开肝内管道结构,选择超声诊断仪Elasto硬键,启动Shear Wave,待图像稳定后冻结,选取肝左叶距离体表深度1.0 cm处0.2 cm2的ROI,重复测量10次,记录LSM最大值、最小值和平均值。
1.4 血清学检测 实验第9天,麻醉大鼠后经腹主动脉无菌采血,行血清学检测,检测指标包括血清谷丙转氨酶、总胆红素、白蛋白及血氨。
1.5 病理学检查 采血后处死大鼠,取肝左叶1 cm×1 cm×1 cm肝组织,使取材部位尽量与ROI取样部位保持一致;以10%甲醛溶液固定,石蜡包埋、切片,HE染色。
1.6 统计学分析 采用SPSS 21.0统计分析软件。若连续性资料符合正态分布,以±s表示,采用t检验或方差分析,组间比较采用LDS-t检验;否则用中位数和四分位间距描述,以Mann-WhitneyU检验进行分析。计数资料以频数表示,采用χ2检验分析,2组间比较采用Bonferroni校正的χ2检验。采用组内相关系数(intraclass correlation coefficient, ICC)检验LSM的一致性,ICC<0.40一致性较差,0.40~0.75一致性一般,>0.75一致性良好。构建ROC曲线,计算AUC。P<0.05为差异有统计学意义。
2 结果
2.1 造模结果 实验第8天,模型组1只大鼠因药物注射过量和/或个体耐药性差死亡,7只存活;其余3组大鼠均存活。
2.2 肌电图检测结果 BAEP正常值为1.26 s。MHE发生率:模型组为85.71%(6/7),乳果糖组、美常安组均为16.67%(1/6)。
2.3 血清学结果 4组血清学资料见表1。
2.4 大鼠肝脏病理 对照组大鼠肝脏病理示正常肝组织,光镜下肝小叶结构完整,肝索呈放射状排列在中央静脉周围。模型组大鼠肝组织肉眼观普遍肿大,光镜下表现为肝小叶结构显示不清,肝细胞水肿、变性坏死伴门管区炎细胞浸润,肝窦受压变窄或消失,肝中央静脉淤血。乳果糖组和美常安组主要表现为肝细胞脂肪变性及气球样变,炎症坏死较模型组减轻,肝窦扩张,部分可见点状坏死,灶状坏死不明显,肝中央静脉淤血。4组均未见明显肝纤维化(图1)。
表1 4组大鼠血清学资料比较(±s)

表1 4组大鼠血清学资料比较(±s)
组别谷丙转氨酶(U/L)总胆红素(μmol/L)白蛋白(g/L)血氨(mmol/L)对照组(n=8)56.99±8.446.13±1.6534.52±1.8034.18±11.93模型组(n=7)135.66±13.74*15.14±3.28*29.98±0.99*109.27±8.42*乳果糖组(n=6)113.39±14.19*#10.47±5.10*#30.81±2.11*63.49±8.95*#美常安组(n=6)121.09±12.16*#11.04±1.31*#30.88±1.34*61.67±4.83*#F值61.25410.51511.92984.481P值<0.01<0.01<0.01<0.01
注:*:与对照组比较P<0.05;#:与模型组比较P<0.05

图1 4组大鼠肝组织病理表现(HE,×200) A.对照组表现为正常肝组织; B.模型组表现为以中央静脉为中心的肝细胞坏死; C、D.乳果糖组和美常安组表现为脂肪变性及气球样变,炎症坏死程度较模型组轻微
2.5 LSM一致性结果 2D-SWE测量LSM(10次)的ICC=0.96,一致性良好。
2.6 诊断效能 根据模型组LSM最大值、最小值和平均值所构建的ROC曲线中,最大值和平均值的AUC相等,均为0.768(表2、图2);模型组LSM平均值高于对照组(P<0.05,表3)。以8.44 kPa为截断值,敏感度和特异度分别为100%和62.50%。
2.7 组间LSM平均值比较 对照组、模型组、乳果糖组及美常安组LSM平均值分别为(8.71±2.65)kPa、(11.86±2.74)kPa、(7.52±1.26)kPa和(7.57±0.76)kPa,模型组明显高于其他3组(P均<0.05),见图3。

表2 模型组大鼠LSM值的诊断效能

表3 对照组和模型组大鼠LSM值比较(kPa)
3 讨论
ALF为临床常见的严重肝病症候群。大鼠ALF模型的建立为临床探索ALF病因和发病机制以及判

图2 模型组大鼠LSM最大值、最小值、平均值的ROC曲线
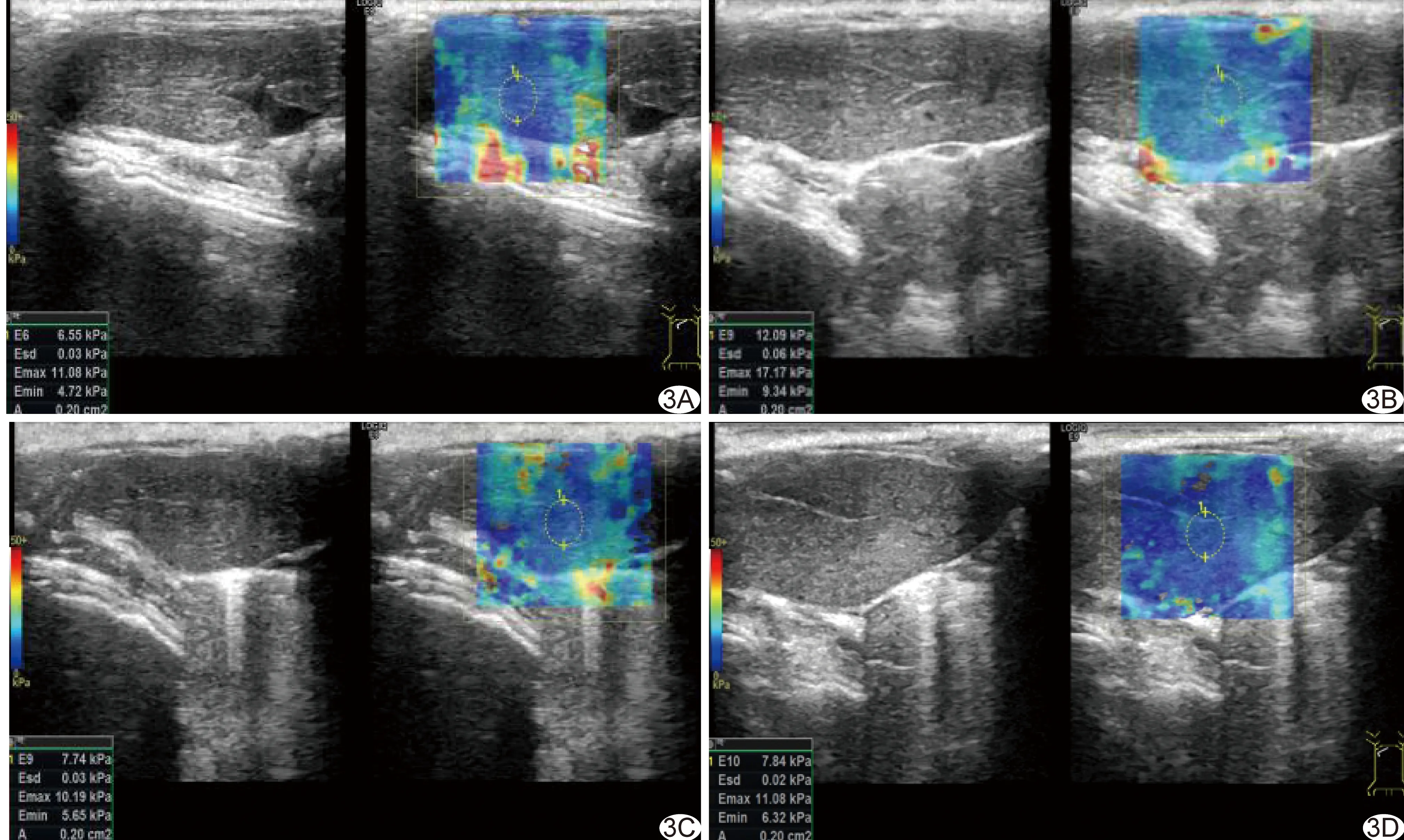
图3 肝脏弹性测量图 A.对照组,LSM=6.55 kPa; B.模型组,LSM=12.09 kPa; C.乳果糖组,LSM=7.74 kPa; D.美常安组,LSM=7.84 kPa
断疗效等提供了重要工具[1-2]。目前国内外主要通过注射肝毒性物质和手术两种方式建立ALF动物模型。TAA常用于制作ALF和肝纤维化模型,剂量以一次性腹腔注射TAA 200 mg/kg体质量为佳[4]。本实验通过腹腔注射TAA建立大鼠ALF模型,大鼠血清学检测结果和肝组织病理表现提示模型组大鼠肝功能受损及肝细胞坏死,BAEP监测结果提示存在MHE,即制备ALF大鼠模型成功。早发现及对症治疗对改善ALF预后和提高生存率具有重要意义。本实验采用微生态疗法预防性治疗ALF。乳果糖是指南公认的经典治疗药物,美常安是一种微生态制剂,两种药物均可改善ALF预后[5-6],但缺乏评价疗效的方法。
SWE是一种可以将组织量化的成像模式,通过定量测量肝组织获得肝脏硬度值,为无创成像技术,已被多个指南推荐为诊断肝脏疾病的重要方法[7-8],主要用于肝纤维化分期及肝硬化[9-10],在ALF中应用较少。LSM与炎症和/或坏死程度密切相关,炎症和/或坏死越严重,则LSM越高。2D-SWE具有能量场稳定、信息量大、测量准确、重复性好等优点。金洁玚等[11]将312例慢性肝衰竭和ALF患者分成好转组和恶化组,2D-SWE检测结果表明恶化组LSM高于好转组,提示2D-SWE评估慢性肝衰竭和ALF患者预后的准确率较高,LSM高于39.2 kPa时预后较差,反之预后较好,动态连续检测对预后评估也有一定价值。
本实验采用2D-SWE测量LSM,定量评估组织硬度[12],扫查时避免加压探头,以肘部作为支点,以提高测量的稳定性,发现硬度图无明显颜色变化且近场无红黄杂色竖条样压力伪像提示图像可采用。测量结果显示,模型组LSM高于对照组,预测ALF的截断值为8.44 kPa时,AUC、敏感度和特异度分别为0.768、100%和62.50%,具有较高的准确率,提示测定LSM早期检测在ALF中具有潜在应用价值。本实验同时对ALF大鼠预防性用药的效果进行评估,发现包括乳果糖组和美常安组在内的2个治疗组的LSM平均值均较模型组降低,而与对照组LSM平均值接近;肝组织炎症坏死程度也较模型组明显减轻,表现为肝细胞水肿、变性,细胞核被压缩,细胞密度减低,可见少量炎症反应,表明2D-SWE测量LSM对于评估用药后治疗效果具有一定价值。
ALF肝脏硬度增加可能与肝细胞水肿、变性及炎症坏死有关。研究[13-14]表明炎症程度、血流灌注压力、脂肪浸润程度及细胞密度会影响肝脏硬度。本团队前期研究[15]发现炎症坏死可能是组织硬度增加的重要因素之一。根据本实验中ALF的病理改变,炎症坏死可能是影响模型组大鼠LSM的最主要因素。
本研究的不足之处:①为动物实验研究;②以声触诊组织量化技术进行弹性成像时,取样框与病理取材部位不可能完全一致。
综上所述,ALF大鼠LSF增高;2D-SWE测量LSM对检出ALF及评估预防性用药效果具有潜在价值。
