基于T1WI及IDEAL-T2WI影像组学模型鉴别腮腺多形性腺瘤和腺淋巴瘤
2020-06-02周宇堃甄俊平边文瑾樊知昌
周宇堃,甄俊平,靳 波,边文瑾,杨 洁,樊知昌
(1.山西医科大学医学影像学系,山西 太原 030001;2.山西医科大学第二医院磁共振室,山西 太原 030001)
多形性腺瘤(pleomorphic adenoma, PA)和腺淋巴瘤(adenolymphoma, AL)是最常见的起源于腮腺的良性肿瘤,分别约占良性肿瘤的80%和10%[1],术前准确诊断鉴别二者对选择手术方式和确定切除范围非常重要[2]。常规序列MRI判断腮腺肿瘤的价值有限。PA常呈T1WI低信号、T2WI不均匀信号,软骨黏液样基质于T2WI呈高信号,上皮组织细胞成分密集时T2WI呈低信号;AL呈T1WI低信号,若含蛋白质或胶体成分,也可呈稍高信号,而T2WI多呈低或等混杂信号[3]。研究[4]发现DWI有助于鉴别诊断腮腺肿瘤,但不典型ADC值存在明显重叠,导致其鉴别困难。影像组学可分析肉眼无法观测的影像特征[5],有助于鉴别诊断肿瘤、预测治疗效果及评估预后等[6]。本研究观察T1WI和IDEAL-T2WI影像组学特征及机器学习模型鉴别诊断PA与AL的价值。
1 资料与方法
1.1 一般资料 回顾性分析2017年7月—2019年8月于山西医科大学第二医院就诊的腮腺肿瘤患者。纳入标准:①经手术病理证实为原发性PA或AL;②术前在本院接受腮腺常规MR检查;③既往无穿刺及放射化学治疗史;④无影响图像分析的明显伪影。共纳入58例患者,男35例,女23例,年龄23~79岁,平均(50.9±14.8)岁。其中33例PA,男10例,女23例,年龄23~70岁,平均(43.7±14.1)岁;25例AL,均为男性,年龄45~79岁,平均(61.2±9.1)岁。
1.2 仪器与方法 采用GE 750W 3.0T MR扫描仪,头颈联合线圈,采集轴位T1WI(TR 567 ms,TE 11.4 ms)及IDEAL-T2WI(TR 3 000 ms,TE 66 ms),层厚5 mm,层间距1 mm,FOV 220 mm×220 mm,矩阵256×160;冠状位T1WI(TR 485 ms,TE 12.1 ms)及IDEAL-T2WI(TR 3 397 ms,TE 67.3 ms),层厚4 mm,层间距1 mm,FOV 220 mm×220 mm,矩阵256×256。将数据以DICOM格式存入光盘。
1.3 图像分割和特征提取 将图像导入放射组学云平台(慧影医疗科技有限公司,北京),由2名影像科医师协商确定腮腺肿瘤边界后,分别在轴位T1WI及IDEAL-T2WI上沿距病灶边缘2 mm区域逐层手动勾画ROI,获得三维容积感兴趣区(volume of interest, VOI)。于放射组学云平台提取、计算VOI内的1 409个特征,即①一阶灰度直方图特征;②二阶纹理特征:包括灰度共生矩阵(gray level co-occurrence matrix, GLCM)、灰度区域大小矩阵(gray level size zone matrix, GLSZM)、灰度相关矩阵(gray level dependence matrix, GLDM)、灰度游程矩阵(gray level run length matrix, GLRLM)及邻域灰度差分矩阵(neighbouring gray tone difference matrix, NGTDM)特征;③三阶特征:对一阶灰度直方图特征、GLCM、GLSZM、GLDM、GLRLM和NGTDM经过对数、指数、梯度、平方、平方根及小波变换(包含LLL、LLH、LHL、HLL、HHH、HHL、HLH和LHH 8种信号)后加入计算。
1.4 降维分析和模型构建 采用放射组学云平台对特征进行降维分析。首先采用方差阈值法,选取阈值为0.80,保留方差大于0.80的特征;再以单变量特征选择法中的SelectKBest,用方差分析衡量特征和分类结果的关系,选择P<0.05的特征。最后通过最小绝对收缩和选择算法(least absolute shrinkage and selection operator, Lasso)筛选各个特征在最佳alpha时的coefficient(系数),选出最有价值的特征。通过放射组学云平台建立随机森林及逻辑回归2种机器学习模型,随机设置训练集占病例数据集的80%(n=46),测试集占20%(n=12),利用测试集对模型进行验证。
2 结果
2.1 PA与AL的影像组学特征 运用放射组学云平台对特征进行提取、降维,针对T1WI、IDEAL-T2WI及IDEAL-T2WI联合T1WI分别得到6、9及12个有效特征(图1)。
2.2 预测模型鉴别诊断 PA与AL 随机森林及逻辑回归2种机器学习模型的诊断效能见表1、2。测试集中基于IDEAL-T2WI联合T1WI建立的随机森林模型的鉴别诊断效能最高,AUC为0.87,95%CI(0.59,1.00),准确率为0.83(图2);基于IDEAL-T2WI联合T1WI建立的逻辑回归模型的AUC为0.83,95%CI(0.51,1.00),准确率为0.71(图3)。
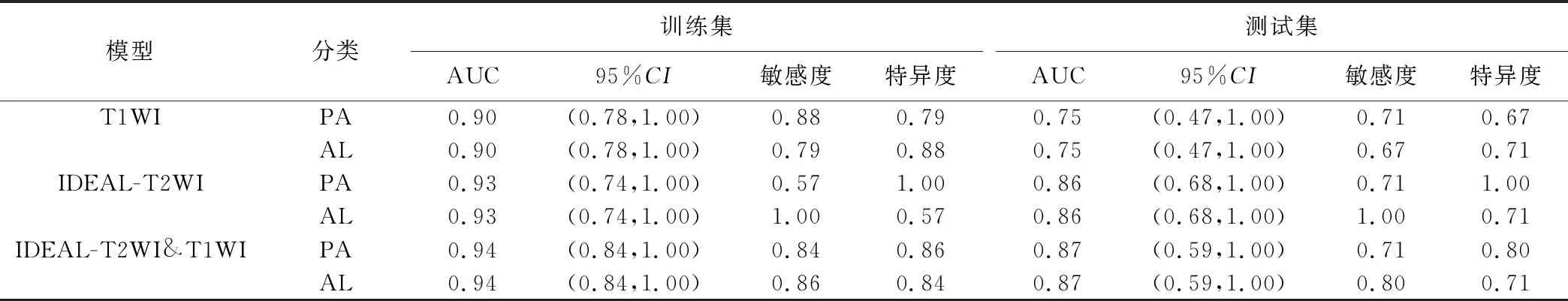
表1 随机森林模型的诊断效能
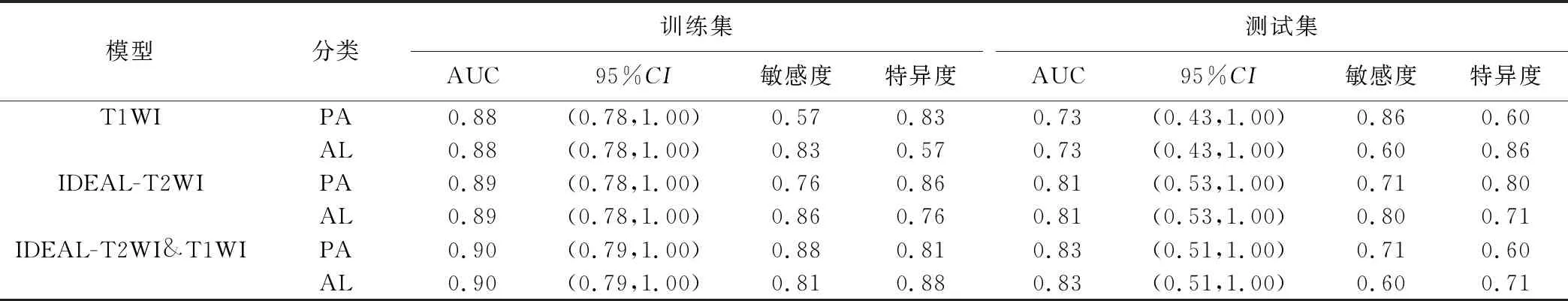
表2 逻辑回归模型的诊断效能

图1 图像特征及相关系数 A.T1WI; B.IDEAL-T2WI; C.IDEAL-T2WI联合T1WI
3 讨论
DCE-MRI联合DWI多参数组合对鉴别腮腺肿瘤具有一定意义,时间-信号强度曲线和细胞外体积分数组合的准确率为0.75,其次是时间-信号强度曲线和ADC值组合,准确率为0.70[7]。根据PA的MRI特征(包括形态、边界、T2WI信号、包膜、强化特点、ADC值)建立评分系统诊断PA的敏感度为64.86%,特异度为94.00%,准确率为81.64%,但仍有部分PA影像学表现不典型,与其他肿瘤存在一定重叠,需要进一步检查定性[8]。
影像组学是指从CT、MRI、PET/CT或超声等图像中提取大量影像学特征,并进行高通量定量数据分析,采用一系列精准数据综合评价肿瘤在空间、时间上的异质性[9]。基于MRI的影像组学对鉴别PA与AL有重要价值。MA等[10]从29例PA和13例AL中提取6种ADC直方图参数,发现PA的ADCmean、ADCmedian、ADC10、ADC90明显高于AL,而二者偏度和峰度无明显差异,以ADC10鉴别PA与AL最为准确。ZHANG等[11]发现ADCminimum、ADCmaximum、ADCmean、ADC10、ADC50、ADC90、ADC99、变异度及偏度在PA与AL之间存在差异,其中ADCmean、ADC50、偏度判别能力较高。此外,有学者[12]采用基于T2WI的全域直方图分析比较鉴别PA与AL的价值,发现PA的平均值和第10、50、90、99百分位数明显高于AL,第50、90百分位数鉴别的准确率更高。以上研究均基于一阶直方图特征,而一阶直方图特征是较为初级的影像组学特征,纹理特征及三阶特征则是中较为高级的影像组学特征。本研究自33例PA和25例AL病灶的每个VOI中提取1 409个影像组学特征,其中包括一阶直方图特征、纹理特征及三阶特征,扩充了影像组学特征,同时增加了成像序列,可更全面地覆盖肿瘤特征。
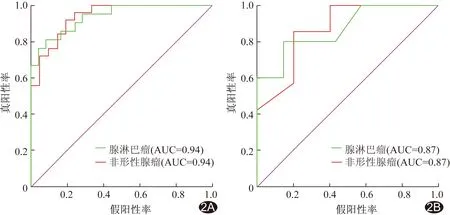
图2 随机森林模型中IDEAL-T2WI联合T1WI构建模型的ROC曲线 A.训练集; B.测试集

图3 逻辑回归模型中IDEAL-T2WI联合T1WI构建模型的ROC曲线 A.训练集; B.测试集
本研究从T1WI、IDEAL-T2WI及IDEAL-T2WI联合T1WI中分别得到6、9及12个有效特征,其中自IDEAL-T2WI联合T1WI得到的12个特征(包括5个T1WI特征和7个IDEAL-T2WI特征)与鉴别诊断PA和AL最为相关。上述5个T1WI特征分为3类:3个一阶统计特征,包括峰度、熵、第90百分位数,以及纹理特征及小波特征各1个,分别为NGTDM及wavelet-LLH;7个IDEAL-T2WI特征包括熵和中位数2个一阶统计特征,1个纹理分析特征GLDM以及4个经wavelet-LLH小波变换后的特征。峰度是反映肿瘤空间异质性总体特征的重要参数,用于描述像素分布形态的陡缓程度[13]。本研究中峰度呈正值,提示与正态分布相比,病灶像素的分布较尖锐。熵反映肿瘤内部结构复杂程度和不均质度。PA含有黏液样组织、软骨样组织和上皮细胞等,而AL主要由腺体及囊性成分构成,其内含有黏液及胶冻样物质[14];二者复杂程度及不均质度不同,故其熵有一定差异。一阶统计特征中第n百分位数的差异反映不同肿瘤间瘤体组织成分及瘤体内部构成或分布的异质性[15]。T1WI的第90百分位数描述高信号像素,T1WI 上PA呈低信号,AL若含蛋白质或胶体成分可呈高信号,第90百分位数有助于鉴别诊断。中位数即第50百分位数用于描述偏态分布的集中位置,本研究中PA和AL在IDEAL-T2WI的第50百分位数存在差异,与高鑫等[12]的结果一致。NGTDM及GLDM反映PA和AL肿瘤区域的体素或强度的空间排列信息,NGTDM衡量灰度值与邻域内平均灰度值之间的差异,而GLDM通过统计各灰度值与邻域体素上的相关性来描述纹理[16]。小波特征通过改变图像中高频与低频信号的比率而携带更大信息量,更能体现病变的异质性[17]。
研究[18]证实以影像组学特征与机器学习方法相结合构建的影像组学模型可提高非侵入性诊断的准确率,对临床决策具有指导意义。本研究运用T1WI及IDEAL-T2WI影像组学特征,结合机器学习方法,构建随机森林及逻辑回归模型术前预测PA与AL,结果显示基于IDEAL-T2WI联合T1WI构建模型的AUC最高,其次为基于IDEAL-T2WI、T1WI构建的模型,提示IDEAL-T2WI具有较高组织分辨率,能够较好地显示肿瘤异质性,与T1WI联合诊断和鉴别PA与AL的效能最高。本研究中基于IDEAL-T2WI联合T1WI建立随机森林模型的准确率为0.83,相比既往研究[7-8]有一定提高。随机森林是基于统计学习理论的组合分类智能算法,与线性回归分析和逻辑回归分析相比具有较高的准确率及容忍度,其最大优势在于可预测多变量数据,分析复杂的非线性关系[19]。本研究结果显示随机森林模型的AUC高于逻辑回归模型,表明随机森林模型比逻辑回归模型具有更高诊断效能,有助于鉴别诊断PA与AL。
本研究的不足:①单中心研究,且样本量较小,需要扩大样本量进行多中心研究,以改进模型的效能;②样本中接受DWI及增强扫描例数较少,故仅对T1WI及IDEAL-T2WI进行分析,后续将观察DWI及增强MRI影像组学鉴别诊断PA与AL的价值;③仅运用2种机器学习模型,增加机器学习模型的类型有助于提高鉴别能力。
综上所述,基于T1WI及IDEAL-T2WI影像组学特征及机器学习模型对鉴别诊断腮腺PA及AL具有一定价值,有助于术前明确诊断。
