甲状腺乳头状癌合并滤泡癌10例临床病理分析
2020-06-01陈一峰郑泽荣林进吉王怡璇苏春阳杜冰汝
陈一峰,郑泽荣,林进吉,王怡璇,杨 梅,苏春阳,杜冰汝
近年我国甲状腺癌的发病率显著上升,其中甲状腺乳头状癌(papillary thyroid carcinoma, PTC)增长尤为迅速。滤泡癌(follicular carcinoma, FC)是显示滤泡细胞分化并缺少乳头状癌特征性核的甲状腺恶性肿瘤,影像学检查常表现为单一性结节。本文回顾性分析10例PTC合并FC,探讨其临床病理特征及免疫表型并复习相关文献,旨在提高临床与病理医师对其发病机制及预后的认识水平。
1 材料与方法
1.1 材料收集2013年1月~2018年12月福建医科大学附属泉州第一医院病理科存档的10例PTC合并FC(表1),所有病理切片均由两位高级职称病理医师独立阅片后明确诊断,临床资料来自医院电子病例系统,其中女性7例、男性3例,年龄28~70岁,平均50.7岁。10例FC均为单发,瘤体最小者最大径为1.0 cm,最大者最大径8.0 cm,PTC单发者5例,多发者5例,瘤体最小者最大径为0.2 cm,最大者最大径2.2 cm,≤1.0 cm者8例。例4和例8行中央组淋巴结清扫。例9于2018年3月1日同时行胸腔镜下食管癌根治术(经颈胸腹)。本实验均获患者知情同意。
1.2 方法标本均经10%中性福尔马林固定,全封闭自动脱水机脱水,石蜡包埋,4 μm厚连续切片,分别行HE染色及免疫组化EliVision法染色。一抗CK19、Galectin-3、Ki-67、HMBE-1、BRAF V600E、CD56、CD31、CD34,均购自福州迈新公司,EliVision和DAB显色试剂盒购自Roche公司。设立阳性对照,应用PBS代替一抗作为空白对照,DAB显色,中性树胶封固,镜下观察。
2 结果
2.1 眼观10例甲状腺手术切除标本,灰褐、红褐、暗褐色的结节饱满甚至呈外翻状,单个,有包膜且厚薄不均,有的包膜外可见与主瘤性状相似的微小结节,质地偏软,最大径1.0~8.0 cm,例8大结节中灶性区域(最大径约0.5 cm)发白、质地比周围硬;灰白色结节质地较硬,单个或多个,多无明显包膜,境界尚清或周围呈毛刺状,最大径0.2~2 cm,同一标本各个不同的结节分别按亚号编号、取材。
2.2 镜检10例肉眼可见的质地较硬结节,在低倍镜下可见具有纤维血管轴心的乳头状、拉长或不规则形的滤泡,间质纤维化(图1),高倍镜下可见表面被覆瘤细胞卵圆形,核排列拥挤,呈假复层状、毛玻璃样(图2),可见小的清晰核仁,部分细胞核内可见包涵体及核沟(图3),6例中可见砂砾体。10例中合并结节性甲状腺肿1例(例5),桥本甲状腺炎2例(例4、7),淋巴细胞性甲状腺炎1例(例2),中央组淋巴结PTC转移者1例(例5)。肉眼可见质地较软单发结节由不同分化程度的滤泡构成,有较厚包膜,未见乳头状结构,癌细胞核致密深染,肿瘤局灶穿越原有包膜水平线之外(图4)或广泛性穿透包膜,广泛浸润型3例(例1、5、6),余为微小浸润型,10例血管腔内可见瘤栓(图5)或未见瘤栓,均为有限血管浸润型(≤4个血管),背景中未见结节性甲状腺肿、桥本甲状腺炎和淋巴细胞性甲状腺炎。10例FC和PTC混合癌中:两者出自同一病灶者2例(例6、8);两者位于同一甲状腺腺叶、彼此孤立者3例(例3、9、10);两者分别位于不同腺叶或者分别位于一侧腺叶和峡部者3例(例1、4、7);例2、5则是两者位于同一腺叶,外加PTC位于另一侧叶或峡部。例9还合并食管胸下段髓质型鳞状细胞癌(图6),病理分期:PT2N2Mx,临床分期:ⅢA期。

表1 甲状腺乳头状癌合并滤泡癌的临床病理资料
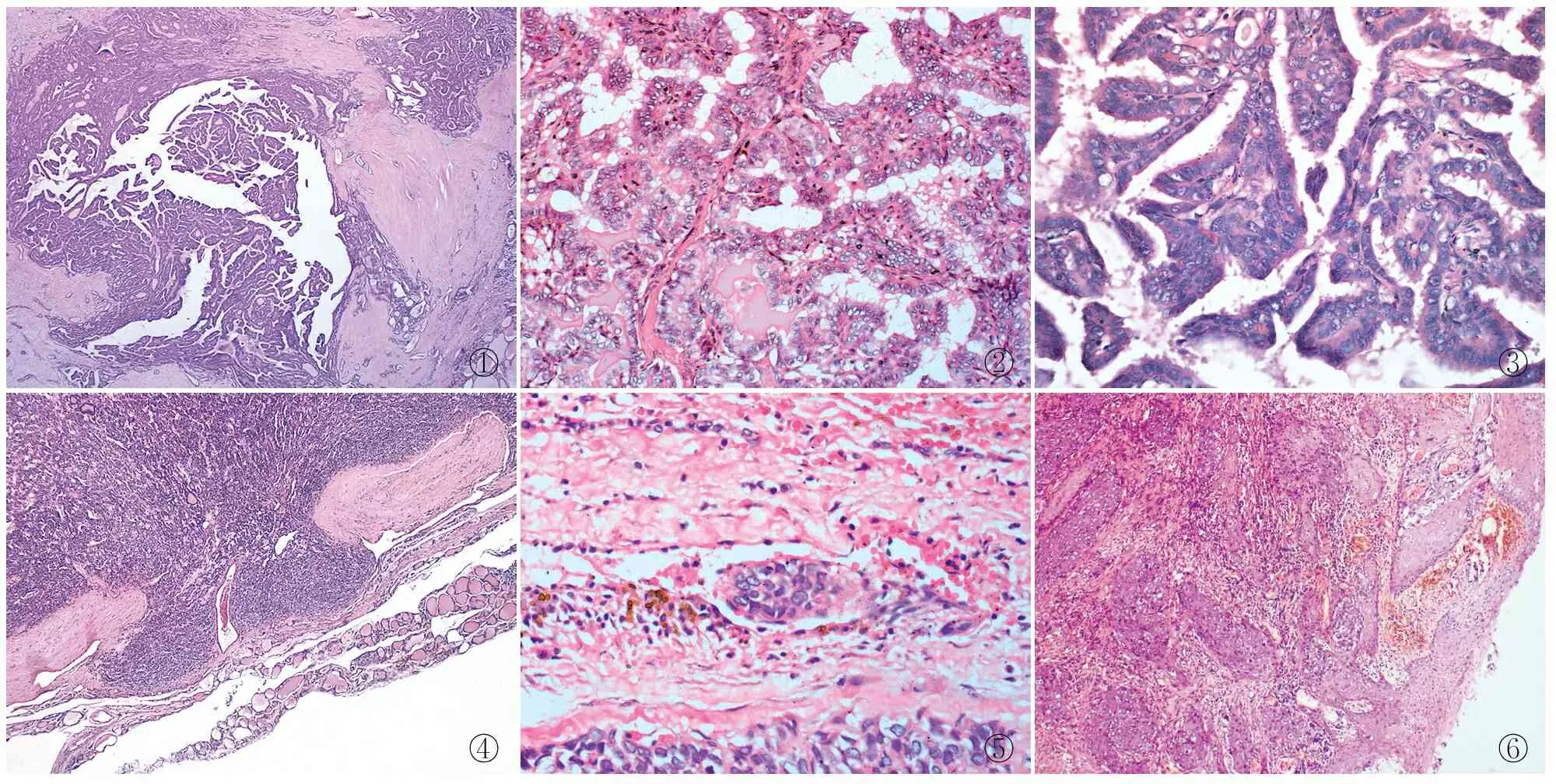
①②③④⑤⑥
图1具有纤维血管轴心的乳头状、拉长或不规则形的滤泡,间质纤维化图2毛玻璃样核拥挤排列图3毛玻璃样核、核沟,可见小核仁图4肿瘤局灶穿越原有包膜水平线之外图5包膜中血管腔内瘤栓图6癌巢与食管被覆鳞状上皮有延续,周围间质反应,提示合并鳞状细胞癌
2.3 免疫表型PTC癌细胞CK19(10/10,细胞膜、细胞质染色)、Galectin-3(8/10,细胞质染色)、HMBE-1(6/10,细胞膜、细胞质染色)和BRAF V600E(6/10,细胞质染色)均阳性,CD56均阴性,CD31、CD34定位于细胞质,Ki-67定位于细胞核。CD31、CD34用于显示脉管内皮,协助判断有无脉管癌栓,10例FC的包膜中及包膜外脉管癌栓均≤4个。
3 讨论
PTC和FC均为甲状腺滤泡细胞来源的恶性肿瘤,两者的发病率占甲状腺癌的95%以上,但是两者同时混合发生临床较少见,国内文献报道4例[1-2]。本组10例中5例PTC病灶呈多灶性分布(5/10),≤1.0 cm者多数(8/10),与FC病灶在甲状腺同侧腺叶、异侧腺叶或峡部合并存在,这就要求病理医师取材时,不能满足于单一结节的肉眼识别,需仔细检查每一剖面以防遗漏微小癌。与之相反,FC病灶的体积较大,单灶,最小病灶的最大径为1.0 cm(1/10),余均>1 cm(9/10),肉眼可见瘤体。5例多灶PTC中仅限于单侧或峡部者3例,散在分布于双侧或单侧外加峡部者2例,Bansal等[3]通过BRAF、NRAS、HRAS、KRAS基因点突变和RET/PTC1、RET/PTC3基因重排检测,证实PTC各个癌灶间基因突变情况各异者占62%,同时具有上述6个相同分子事件或皆无突变者占38%,提示至少60%多灶性PTC是多中心起源。多癌灶性与复发、局部、远处转移有关[4],RET/PTC基因重排可能引起甲状腺癌的多灶性,有研究指出无伴随疾病的PTC组内RET/PTC阳性重排患者有更高的肿瘤多灶性危险性[5],与单侧多灶PTC相比,受到淋巴引流交通支的影响,双侧多灶中央区淋巴结转移风险更大[6]。本组PTC周围伴淋巴细胞性甲状腺炎、桥本甲状腺炎和结节性甲状腺肿者4例(4/10),而FC周围未见合并甲状腺良性病变,Myshunina等[7]研究指出伴慢性淋巴细胞甲状腺炎甲状腺癌的癌灶常较小、多发、包膜外受累及远处转移率较低,PTC的颈侧淋巴结转移率较低,FC的复发率较低,但PTC的Ⅵ区淋巴结转移率和复发率、PTC和FC的肿瘤分期、病死率与不伴甲状腺炎者相似。然而有学者认为桥本甲状腺炎患者血清TSH水平升高的促发作用等造成PTC Ⅵ区淋巴结转移率明显增高[8],因此手术切除伴淋巴细胞性甲状腺炎或桥本甲状腺炎PTC的范围存在争议。作者认为在患者知情同意下,行患侧中央组淋巴结清扫不失为明智的选择。对于Ⅵ区淋巴结阳性患者需高度警惕颈侧淋巴结转移的可能性,必要时可考虑行预防性择区淋巴结清扫[9]。桥本甲状腺炎可能是PTC的癌前病变,PTC癌周淋巴细胞浸润可能导致桥本甲状腺炎的发生[10]。
本组10例PTC癌细胞中CK19均阳性,8例Galectin-3阳性,6例HMBE-1阳性,6例BRAF V600E阳性,10例CD56阴性,对于诊断PTC有较好的辅助作用。FC的病理诊断必需见到肿瘤侵透包膜和(或)包膜中、外脉管癌栓,CD31、CD34抗体用于显示脉管内皮,尤其对分辨肿瘤挤压脉管或是在脉管内有较大的帮助,本组10例FC的包膜中及包膜外脉管癌栓均≤4个。PTC和FC同时并存的现象临床少见,经Pubmed网站检索,仅发现个案报道[11-13],其中Cracolici等[12]应用二代测序检测技术首次报道1例PTC癌灶BRAF V600E基因突变,同时存在FC原发灶和骨转移灶NRAS Q61R突变,提示即使同一器官在不同的分子机制调控下能恶性转化不同的细胞克隆,最终形成不同类型的肿瘤。本组例9是混合癌(PTC、FC、食管鳞状细胞癌),与Dong等[13]的报道相似,客观提示了基因致瘤机制的复杂性。