亚低温联合促红细胞生成素检测对缺氧缺血性脑病新生儿血清炎性因子和脑组织损伤标志物的影响
2020-06-01杨昭君朱法荣
杨昭君,朱法荣
新生儿缺氧缺血性脑病(HIE)是患儿在围生期窒息引起的脑组织部分或完全缺氧、脑血流减少或暂停,导致的患儿脑部受损,该病易引起患儿出现各种神经系统疾病甚至死亡[1]。据报道,全球新生儿HIE发生率为0.1%~0.3%,占新生儿死亡的22%[2];我国新生儿HIE发生率为0.3%~0.6%,高于全球发病水平,死亡率为15%~20%,而25%~30%存活患儿伴有脑瘫、智力低下、癫痫等疾病[3]。因此,有效控制HIE患儿死亡及预防后遗症发生是HIE治疗的关键。高压氧治疗和亚低温治疗是临床常用的两种物理治疗方法,但是高压氧压力和时间等指标若控制不当,则可能对患儿的视网膜发育造成损害[4]。亚低温治疗对新生儿HIE是一种安全有效的方法,但仍有40%以上接受亚低温治疗的新生儿发生中度或重度神经功能缺损甚至死亡,尚需更深入的研究来提高亚低温治疗新生儿HIE的临床疗效[5-6]。促红细胞生成素(EPO)是一种影响红细胞生成的细胞因子,能够促进血管生成,对脑损伤神经具有一定的保护作用,可促进神经发育,但临床上关于亚低温联合EPO对新生儿HIE疗效、血清炎性因子及脑组织损伤标志物影响的研究较少。本研究观察亚低温治疗联合EPO对新生儿HIE的临床疗效、细胞因子和脑组织损伤指标的影响,为临床治疗提供理论依据。
1 资料与方法
1.1 研究对象 选取2014年1月—2017年1月收治的新生儿HIE 136例,按照随机数字表法分为观察组(68例)和对照组(68例)。纳入标准:所有患儿均符合2005年中华医学会儿科学会新生儿组修订的新生儿HIE诊断标准[7];胎龄≥35周,且出生体重≥2 kg;出生后6 h内,存在神经性脑病的临床表现;患儿家属知情同意。排除标准:严重颅内出血或颅骨骨折者;先天性异常或遗传代谢性疾病者;严重感染性疾病者;母亲具有吸毒史者;放弃治疗者。两组患儿的胎龄、性别、出生体重、Apgar评分、临床分度和分娩方式等方面比较,差异无统计学意义 (P>0.05)。
1.2 方法 对照组患儿在常规治疗的基础上,给予亚低温治疗;观察组给予亚低温联合EPO治疗。患儿出生6 h内,应用德国Allon体温调节系统进行亚低温治疗,给患儿放置低温垫,根据患儿体温设定初始温度,每10 min测定1次肛温,使患儿肛温在1 h内达到(33.5±0.5)℃,维持72 h后自然复温,如果6 h后患儿体温仍未恢复至36 ℃,则用远红外辐射进行复温。EPO治疗,每次300 U/ kg,2 d 1次,连续治疗6次,首次采用皮下注射,以后改为静脉注射。
1.3 样本采集及检测 在治疗前后,分别采集患儿静脉血5 mL,按照3 000 r/min速度离心10 min,吸取上清液,检测细胞因子血清炎性因子白介素-10(IL-10)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和脑组织损伤指标血清S100β蛋白、髓鞘碱性蛋白(MBP)、神经元特异性烯醇化酶(NSE)水平的变化情况。血清IL-6、IL-10、TNF-α、NSE、MBP和S100β蛋白水平采用Elisa法,检测所有指标严格按照相应试剂盒说明书进行操作。
1.4 疗效评定标准[8]根据患儿治疗后症状、体征及神经评分法(NBNA)评分评定。 显效:治疗后神经系统症状及相关体征完全消失,NBNA评分≥35分;有效:治疗后临床症状及体征有所改善,NBNA评分≥30分;无效:治疗后临床症状体征未改善或者加重,NBNA评分<30分。
1.5 不良反应 观察两组患儿治疗期间不良反应情况。

2 结 果
2.1 两组临床疗效比较 治疗后观察组临床疗效高于对照组,差异有统计学意义(χ2=4.755,P=0.029)。详见表1。

表1 两组临床疗效比较 单位: 例(%)
2.2 两组血清炎性因子水平比较 治疗前,两组血清IL-6、IL-10和TNF-α水平比较,差异无统计学意义(P>0.05)。治疗后,两组血清IL-6、IL-10和TNF-α水平较治疗前均明显下降(P<0.05),而且观察组血清IL-6、IL-10和TNF-α水平明显低于对照组(P<0.05)。详见表2。
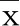
表2 两组血清炎性因子水平比较(±s)
2.3 两组脑组织损伤指标比较 治疗前,两组血清NSE、MBP和S100β水平比较,差异无统计学意义(P>0.05)。治疗后,两组血清NSE、MBP和S100β水平较治疗前均明显下降(P<0.05),而且观察组血清NSE、MBP和S100β水平明显低于对照组(P<0.05)。详见表3。
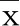
表3 两组脑组织损伤指标比较(±s)
2.4 两组不良反应 两组患儿治疗期间未见明显的不良反应。
3 讨 论
HIE发病机制较为复杂,具体机制尚不明确,但有研究认为该病的发生与急性炎症反应密切相关,并且受到多种细胞因子、神经调节物质的影响,引起患儿脑组织病理性损害[9]。当缺血性损伤发生时,机体释放多种细胞因子和趋化因子,引起炎症反应,造成炎性因子向脑损伤部位迁移,进一步加剧神经元细胞损伤。
在HIE早期或急性期,血清IL-10水平会升高。IL-10作为抗炎性因子,能抑制小胶质细胞和白细胞分泌TNF-α等细胞因子,并能抑制白细胞聚集和趋化因子产生,降低缺血后大脑迟发性损伤[10]。脑损伤早期TNF-α水平迅速上升,引起血脑屏障损伤或开放,诱发IL-6等细胞因子释放,加速炎症反应,导致脑细胞凋亡,从而加重脑损伤[11]。NSE是一种糖酵解酶,存在于神经元、神经内分泌细胞和少突胶质细胞内,当患儿发生缺氧缺血性脑损伤时,引起脑部能量明显降低和各种不良神经反应,导致神经元坏死及神经末梢崩解,细胞质中NSE进入血液和脑脊液中,使得NSE大量释放[12-13]。MBP作为一种碱性蛋白主要存在于少突神经胶质和髓鞘组织,正常情况下血清含量很少,当脑组织缺氧缺血累及髓鞘时,引起髓鞘碱性蛋白释放入脑脊液中;血脑屏障破坏或通透性发生改变,引起血清MBP水平大幅升高[14]。S100β蛋白由两个β单位组成的二聚体,主要存在星形胶质细胞和神经膜细胞中,由于血-脑屏障的作用,血液中S100β蛋白水平极低,当脑组织受到损伤时,血-脑屏障被破坏,脑脊液中S100β蛋白进入血液循环,致使血液中S100β蛋白水平上升[15-16]。
本研究发现,治疗后观察组临床有效率明显高于对照组(88.24% 与73.53%,P<0.05);两组血清IL-6、IL-10、TNF-α、NSE、MBP和S100β水平明显低于治疗前(P<0.05);观察组血清IL-6、IL-10、TNF-α、NSE、MBP和S100β水平明显低于对照组(P<0.05),说明亚低温联合促红细胞生成素通过抑制HIE患儿的炎症反应,降低脑组织损伤,提高临床疗效。这是由于患儿体温每降低1 ℃,脑部代谢率便可降低6.7%,当患儿体温降到33 ℃左右时,脑细胞耗氧量便可降低约33.33%,从而有效地减少机体脑细胞能量耗损,抑制氧化应激反应,减少氧自由基生成,减轻脑组织缺氧缺血状态,延缓神经细胞凋亡的发生,并抑制IL-6、IL-10、TNF-α等炎性因子的释放,缓解炎性损伤,保护神经细胞的功能[17]。EPO作为一种糖蛋白,可通过受损的血-脑屏障改善神经元的损伤,并通过刺激脑血流自主调节作用,增加脑内谷胱甘肽过氧化物酶的活性来抑制脑神经细胞氧化应激的损害,从而减少脑组织炎症细胞的聚集,发挥抗炎症反应;同时还可抑制谷氨酸介导的神经毒性作用,抑制炎症反应降低水肿性脑损伤;EPO能直接调节神经元祖细胞和干细胞的增殖与分化,促进神经祖细胞的产生,增加神经前体细胞生成,发挥对神经元和神经胶质细胞再生和修复的作用[18-20]。
综上所述,亚低温联合EPO治疗HIE患儿的效果优于亚低温单独应用。但本研究仍存在一定的局限性,研究样本量较少,未观察治疗后不同时间点HIE患儿细胞因子和脑组织损伤标志物的变化情况及脑脊液中的水平。因此,尚需在以后的研究中进一步完善。
