太平洋牡蛎壳制备L-天冬氨酸螯合钙的工艺优化及表征
2020-06-01姜岁岁王润芳李诗洋赵元晖
王 真,姜岁岁,张 帆,王润芳,冯 雪,汪 瑞,李诗洋,赵元晖
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
牡蛎作为我国四大养殖贝类之首,盛产于整个沿海地区,素有“海中牛奶”的美誉,已被我国卫生部门批准为第一批既是药材又是食品的海洋资源。然而,每消耗1 kg太平洋牡蛎,约产生370~700 g副产物,几乎全部都是壳[1]。在我国,每年处理约1 000万 t壳体废物[2],这些废弃物通常被丢弃在垃圾填埋场,或加工成饲料,或者用作钙肥等,因此迫切需要新技术手段进行再生资源的利用。由于牡蛎壳中含有95%左右的碳酸钙,以牡蛎壳为原料制备生物钙逐渐引起人们的重视[3]。
钙是人体必需的矿质元素之一,在骨骼组成、肌肉收缩、细胞吞噬以及酶的激活等多种生命活动中具有重要作用[4]。人体中的钙主要来自食物,然而我国城乡居民膳食钙日摄入量较低,不及营养学推荐摄入量的一半[5],且钙易与食物中的植酸、草酸、饱和脂肪酸、膳食纤维等物质结合形成难溶物,导致钙的吸收利用率较低,缺钙导致乏力抽筋、腰酸背痛、骨质疏松等症状居高不下。由此,促进钙吸收物质的研发受到广泛关注。
市面上已有的传统补钙剂如无机酸钙、有机酸钙等在一定程度上都存在吸收效果差,且有一定毒副作用的问题,而氨基酸螯合钙具有稳定性强,吸收率和生物效价高、毒性小、环保等特点[6-7],既能满足生命体对钙元素的需要,又能达到补充氨基酸的双重作用,生物学利用率高。本实验基于L-天冬氨酸是酸性氨基酸,可在加热搅拌条件下直接与牡蛎壳以应生成螯合钙,以牡蛎加工废弃物牡蛎壳为原料,通过不同处理方式制备L-天冬氨酸螯合钙,旨在寻找一种最合适的加工工艺使牡蛎壳中的钙与L-天冬氨酸进行充分螯合,为废弃牡蛎壳资源高值化利用提供新的思路。
1 材料与方法
1.1 材料与试剂
太平洋牡蛎壳(平均质量(41.13±10.10)g)收集于山东省青岛市市南区水产品市场;L-天冬氨酸(食品级) 河北华阳生物科技有限公司;溴化钾(光谱纯)国药集团化学试剂有限公司。
1.2 仪器与设备
YK高速万能粉碎机 山东益康中药器械有限公司;Laborata 4000旋转蒸发仪 德国Heidolph公司;XQM-2L球磨机 长沙天创粉末技术有限公司;Tescanvega3扫描电子显微镜(scanning electron microscope,SEM)、Nano Gmbh能谱仪(energy dispersive spectrometer,EDS) 德国Bruker公司;Tristar 3000全自动多站比表面积和孔隙度分析仪 美国麦克仪器公司;7800电感耦合等离子体质谱(inductively coupled plasma-mass spectrometry,ICP-MS)仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 ICP-MS测定
样品处理:精密称取过100 目筛的牡蛎壳粉样品1.000 0 g(精确到0.1 mg),于聚氟乙烯微波消化罐中。
测定条件:样品延时0 s,样品冲洗时间30 s,样品导入雾化器,等离子观测水平;最大积分时间30 s;雾化器泵冲洗泵速50 r/min;分析泵速50 r/min;泵延时5 s;射频功率1.15 kW;氢气纯度99.99%,压力1.56×105Pa,冷却气流速17.5 L/min,氢化气流速0.3 L/min,试样提升量1.6 mL/min,观察高度15 mm。
1.3.2 不同处理的牡蛎壳粉制备
煅烧牡蛎壳粉:用毛刷多次刷洗牡蛎壳后于5%的NaOH溶液中浸泡12 h以上,再用清水多次冲洗至中性[8],于烘箱中烘干,然后用榔头敲碎成小块,置于1 000 ℃马弗炉中煅烧2 h[9],过100 目筛,得到煅烧牡蛎壳粉。
直接过筛牡蛎壳粉:用榔头敲碎成小块后,置于高速粉碎机中粉碎,粉碎后的壳粉过100 目筛,得到过筛牡蛎壳粉。
球磨牡蛎壳粉:用榔头敲碎成小块后,取适量牡蛎壳于球磨罐中,以料液比1∶3加入蒸馏水,于400 r/min球磨2 h,取出烘干,过100 目筛,得到球磨牡蛎壳粉[10]。
1.3.3 L-天冬氨酸螯合钙的制备
制备工艺流程如下[11]:将L-天冬氨酸和牡蛎壳粉按一定比例配料→加5 倍氨基酸和壳粉总质量的蒸馏水→加热到一定温度→调节pH值→恒温磁力搅拌一定时间→趁热过滤→减压浓缩至黏稠状→乙醇沉淀→离心收集沉淀→冷冻干燥制得成品。
1.3.4 不同壳粉处理方式的得率、螯合率、钙含量的测定
测定原理[11]:氨基酸金属元素螯合物通过配位键形成内络盐结构,稳定性较好,稳定常数为104~105,而乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)金属络合物的稳定常数(lgK=18.8)远大于氨基酸螯合物的稳定常数,并且氨基酸螯合钙在无水乙醇中溶解度很低,而钙离子能溶于无水乙醇,因此可以用EDTA配位滴定直接滴定氨基酸螯合钙中的钙元素,由此计算出螯合率和钙含量。
测定方法[12]:称取1.00 g螯合钙样品,溶于蒸馏水并定容至100 mL,摇匀。量取25 mL于250 mL锥形瓶中,加入5 mL氨水-氯化铵缓冲液(pH 10.0),再加入5 滴0.5%铬黑T指示剂,用0.0 5 m o l/L EDTA-Na2标准液滴定至溶液紫红色消失变为天蓝色,平行滴定3 次,记录消耗EDTA-Na2的体积V1,按上述方法做空白对照,记录消耗EDTA-Na2的体积V0。另取相同量的螯合钙样品,加50 mL无水乙醇,充分搅拌离心,去上清液,用蒸馏水定容至100 mL,摇匀。量取25 mL置于250 mL锥形瓶中,加入5 mL氨水-氯化铵缓冲液(pH 10.0),再加入5 滴0.5 %铬黑T指示剂,用0.05 mol/L EDTA-Na2标准液滴定至溶液紫红色消失变为天蓝色,平行滴定3 次,记录消耗EDTA-Na2的体积V2。
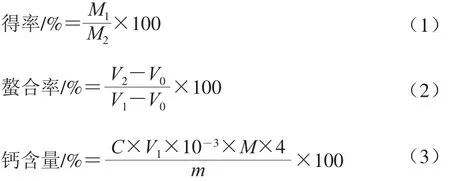
式中:M1为螯合钙产物总量/g;M2为以应所用去的氨基酸和牡蛎壳粉总量/g;V0为空白对照消耗EDTA-Na2的体积/mL;V1为滴定钙元素总量消耗EDTA-Na2的体积/mL;V2为滴定螯合钙元素消耗EDTA-Na2的体积/mL;C为标准EDTA溶液的浓度/(mol/L);M为钙摩尔质量/(g/mol);m为称取的螯合钙样品量/g。
螯合效果综合评分为得率和螯合率的加权平均值,权重系数各为0.5[9]。
1.3.5 不同处理方式的壳粉SEM变化
分别取适量的煅烧、直接过筛和球磨3 种处理方式的壳粉均匀涂于洁净样盘双面胶上,在15 mA的电流条件下真空喷金镀膜处理。处理好的样品装入观察室,抽真空,施加一定电压后,在不同放大倍数下获取扫描图像。SEM条件:加速电压20 kV;束流9.2×10-2mA;工作距离9.7 mm[13]。
1.3.6 不同处理方式的壳粉BET比表面积测定
预处理:300 ℃抽真空7 h。然后使用氮气吸附法测试样品BET比表面积[14]。
1.3.7 不同目筛壳粉的螯合率测定
将最优处理方式的壳粉分别经过100、200、300 目筛进行细分,按1.3.3节的方法测定筛分后的得率、螯合率和钙含量。
1.3.8 不同目筛壳粉的微观结构分析
分别取不同目筛的壳粉均匀涂于洁净样盘双面胶上,在15 mA的电流条件下真空喷金镀膜处理。处理好的样品装入SEM观察室,抽真空,施加一定电压后,在不同放大倍数下获取扫描图像。SEM条件:加速电压20 kV;束流9.2×10-2mA;工作距离8.3~8.8 mm[13]。
1.3.9 单因素试验优化螯合以应条件
1.3.9.1 溶液pH值对螯合效果的影响
取定量L-天冬氨酸溶于水,按L-天冬氨酸与Ca2+物质的量比2∶1,分别在pH 3.0、5.0、7.0三种体系条件下,60 ℃恒温水浴磁力搅拌60 min进行螯合以应。待螯合以应结束后,趁热过滤,减压浓缩,冷冻干燥,分别称量冻干后螯合钙的产量并计算得率,测定螯合率和钙含量,以确定最佳体系pH值。
1.3.9.2 以应温度对螯合效果以应的影响
取定量L-天冬氨酸溶于水,按L-天冬氨酸与Ca2+物质的量比2∶1,体系pH值调至5.0,分别在温度为40、50、60 ℃条件下,水浴螯合60 min。待螯合以应结束后,趁热过滤,减压浓缩,冷冻干燥,分别称量冻干后螯合钙的产量并计算得率,测定螯合率和钙含量,以确定最佳以应温度。
1.3.9.3 以应时间对螯合效果的影响
取定量L-天冬氨酸溶于水,按L-天冬氨酸与Ca2+物质的量比2∶1,于pH 5.0,温度60 ℃条件下,分别水浴螯合30、60、90 min。待螯合以应结束后,趁热过滤,减压浓缩,冷冻干燥,分别称量冻干后螯合钙的产量并计算得率,测定螯合率和钙含量,以确定最佳以应时间。
1.3.9.4 以应物质的量比对螯合效果的影响
取定量L-天冬氨酸溶于水,按L-天冬氨酸与壳粉物质的量比分别为1∶1、2∶1、3∶1,于pH 5.0,温度60 ℃,水浴螯合以应90 min。待螯合以应结束后,趁热过滤,减压浓缩,冷冻干燥,分别称量冻干后螯合钙的产量并计算得率,测定螯合率和钙含量,以确定最佳以应物质的量比。
1.3.10 螯合物EDS分析
采用Nano Gmbh EDS对螯合前后的L-天冬氨酸和L-天冬氨酸螯合钙进行EDS分析,测定出样品所含的元素成分及其归一化质量和原子百分比[15]。
1.4 数据处理与分析
所有数据均设置3 次重复,运用SPSS 19.0统计软件进行显著性差异分析,P<0.05,差异显著。采用Origin 2018软件进行作图,以 ±s表示,每个样品做3 个平行。
2 结果与分析
2.1 ICP-MS测定牡蛎壳中重金属元素
采用DZ/T 0223—2001《电感耦合等离子体质谱分析方法通则》[16]对粉碎后的牡蛎壳粉中重金属元素进行纯度分析,结果见表1。

表1 牡蛎壳粉重金属元素测定Table 1 Contents of heavy metal elements in oyster shell powder mg/kg
从表1可以看出,太平洋牡蛎壳中重金属元素含量很低,特别是Pb、Hg、As、Cd、Cr元素含量明显低于GB 2762—2017《食品中污染物限量》[17],这一结果与唐小华等[18]研究结果类似,且表中绝大多数元素含量显著低于褶牡蛎壳中重金属含量。太平洋牡蛎壳中配位能力大于钙元素且能与L-天冬氨酸发生螯合以应的金属元素含量很少,故可以忽略杂质含量,通过螯合钙的得率及螯合率差异评价螯合工艺优劣。
2.2 不同壳粉处理方式的得率、螯合率、钙含量的测定
由图1A可见,在不同壳粉处理方式中直接过筛处理壳粉与L-天冬氨酸螯合后得率最高,为93.4%,其次是球磨处理,煅烧处理壳粉的得率最低,只有86.4%。从图1B的螯合率指标来看,也呈现出与图1A相似的趋势,直接过筛处理壳粉经螯合以应后螯合率最高,且与煅烧和球磨处理壳粉的螯合率有显著差异。同样地,3 种处理方式钙含量的差异如图1C所示,直接过筛处理壳粉的钙质量分数为11.4%,显著高于其他2 种处理方式,这可能与不同处理方式所导致的微观结构变化有关。综合以上3 个指标,确定了壳粉最佳处理方式为直接过筛,与球磨和煅烧处理相比,直接过筛可以大大降低能源消耗,制备成本低,工艺更加简单易行,绿色环保。王家明等[11]报道过牡蛎壳粉不经煅烧可直接应用于谷氨酸螯合钙的制备。

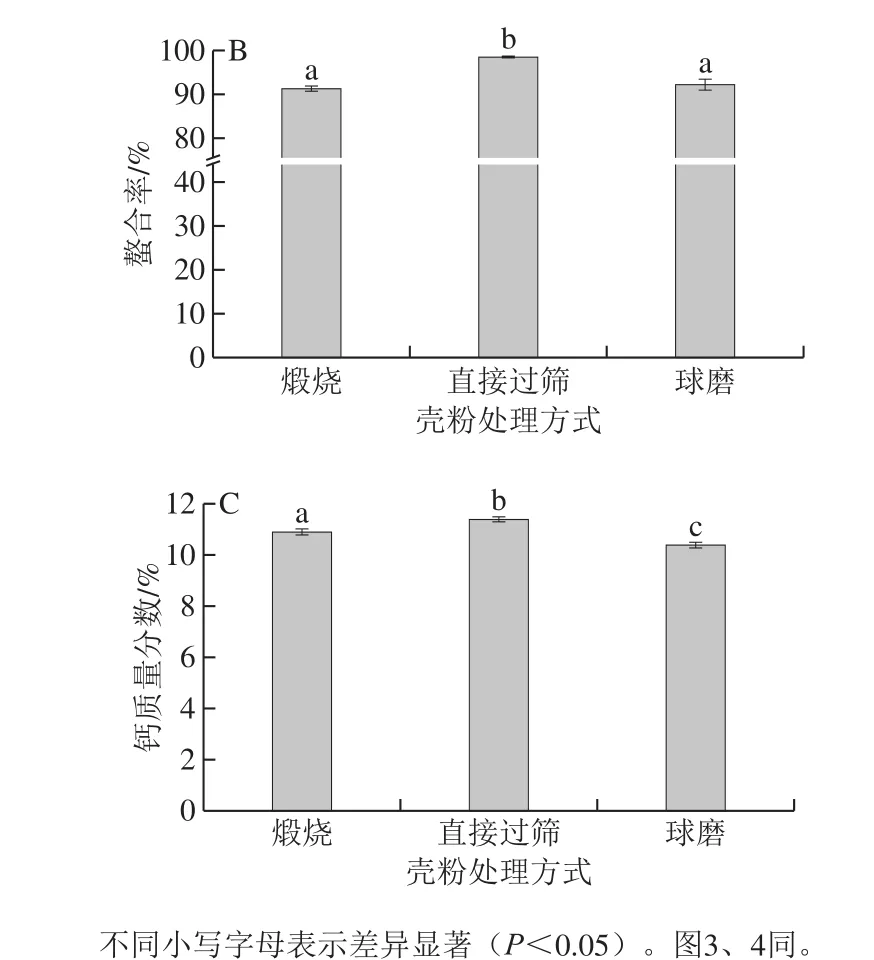
图1 不同壳粉处理方式的得率(A)、螯合率(B)、钙含量(C)的测定Fig. 1 Yield (A), chelating rate (B) and calcium content (C) of different oyster shell powders
2.3 不同处理方式的壳粉SEM观察

图2 不同处理方式的壳粉SEM图Fig. 2 SEM micrographs of oyster shell powders
由图2A1可以看到,煅烧壳粉的宏观形态呈形状不规则的块状形貌,孔隙较大,颗粒整体分布均匀,而从图2A2可以发现,其微观形态似珊瑚礁状,颗粒表面光滑。较光滑的外表可能不利于与L-天冬氨酸的螯合以应,但表面较多孔的结构可能会在一定程度上减少螯合率的大幅度降低。从图2C可以看出,经过400 r/min球磨2 h后,球磨壳粉颗粒分散较均匀,呈类椭球形体,相比于煅烧处理,球磨处理后壳粉的整体结构更加紧实。另外,因球磨过程中,粉末受到球罐与磨球以及磨球之间的以复挤压和剪切,边缘趋于光滑,且有微细粉末吸附其上。这一形貌变化在李冰等[19]的研究中也有所报道。从图2B可以观察到,直接过筛壳粉的整体微观形态呈片层状叠加,表面粗糙,片层状碎片较多,亦有细小颗粒微附于层状结构表面。从整体形态来看,直接过筛壳粉的表面粗糙、结构疏松,在螯合以应过程中可能与L-天冬氨酸有更大的接触面积和更高的螯合率。
2.4 不同处理方式的壳粉BET比表面积测定
从图3可以看出,直接过筛壳粉的BET比表面积最大,其次是球磨壳粉,而煅烧壳粉的BET比表面积最小。这可能与不同处理方式下的温度变化有关。Yahya等[20]研究发现,BET比表面积会随活化温度的升高而减小,这是由于在过高的活化温度下形成了强的气化,使微孔结构转化成介孔或者大孔,并伴有孔结构的破坏或坍塌现象。在3 种处理方式中,煅烧处理温度最高,为1 000 ℃,因此在煅烧壳粉中微孔结构的转化和破坏现象最显著。由于微孔对BET比表面积的贡献最大,当微孔数量较少时,BET比表面积也相应减小,这一结果与朱秀珍[21]的研究相似。而球磨处理因与磨球和罐壁之间的碰撞剪切作用导致温度上升程度高于直接过筛处理,故直接过筛壳粉的微孔结构破坏程度最低,BET比表面积最大。以上的BET比表面积结果与2.2节螯合率结果相印证。

图3 不同处理方式的壳粉BET比表面积测定Fig. 3 BET specific surface areas of oyster shell powders
2.5 不同目筛壳粉的螯合率测定
通过以上实验得到壳粉最佳处理方式为直接过筛,为进一步研究不同目筛壳粉对螯合效果的影响,以3 种目筛壳粉为原料进行螯合率对比,结果如图4所示。从图4可以看出,300~200 目筛和大于300 目筛的壳粉螯合率均显著高于200~100 目筛的壳粉,而其两者之间的螯合率差异不显著,因此,从生产成本和能耗的角度考虑,选用300~200 目筛的壳粉作为最适以应原料。
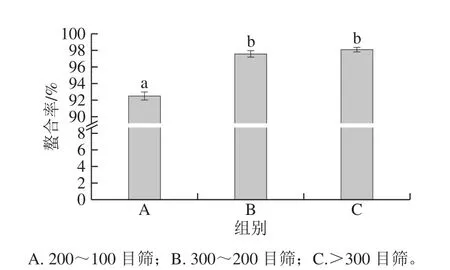
图4 不同目筛壳粉的螯合率测定Fig. 4 Chelating rates of different oyster shell powder mill streams
2.6 不同目筛壳粉的SEM观察
从图5可以看出,不同目筛壳粉的微观结构相似,主要为片层状,并且随着筛分的细化,向球形颗粒转变。从500 倍SEM可以明显观察到筛分颗粒表面粗糙,结构疏松,且有细小颗粒附着。相比于图5A,图5B、C的壳粉颗粒粒径明显减小,图5C的颗粒平均粒径最小,约15~20 μm,而图5B的颗粒平均粒径约30~50 μm,图5A的颗粒平均粒径最大,约80~100 μm。结合图4可以发现,粒径越小,其与L-天冬氨酸螯合以应效果相对越好,但筛分更细化的大于300 目筛壳粉的螯合率与300~200 目筛壳粉螯合率无显著性差异,SEM结果也为最适以应原料的选择提供了直观依据。

图5 不同目筛壳粉的SEM观察Fig. 5 SEM micrographs of different oyster shell powder mill streams
2.7 单因素试验优化螯合以应条件
2.7.1 溶液pH值对螯合效果的影响
以应体系的pH值对螯合效果有较大的影响,pH值较大时,OH-易与供电基团抢夺Ca2+而形成羟桥化物,进而形成Ca(OH)2沉淀,稳定系数大于螯合钙;pH值较小时,H+会与Ca2+抢夺供电基团—NH2和—COOH,由于存在竞争关系,—COOH配位能力较弱,螯合物也较难稳定存在[22-23]。从表2可以看出,随着pH值的增大,螯合钙的得率和螯合率先增加后降低,当pH 5.0时,螯合物的得率和螯合率最高,因此选择pH 5.0作为最佳螯合以应pH值。王青[9]和杜冰[24]等分别以四角蛤蜊壳和蛋壳为原料制备氨基酸螯合钙,研究pH值对螯合效果的影响,得到最佳以应pH值分别为5.0和4.8。

表2 溶液pH值对螯合效果的影响Table 2 Effect of pH on the chelation efficiency
2.7.2 以应温度对螯合效果的影响
就一般化学以应而言,温度越高,以应速率越快,但若以应温度过高,可能会使氨基酸发生羰氨以应,与钙离子形成竞争[25];以之,温度过低时,螯合以应速度过慢,致使螯合效率降低[15]。从表3可以看出,L-天冬氨酸螯合钙的得率和螯合率随着以应温度的升高,先升高后降低。在以应温度接近50 ℃时,得率和螯合率较为理想,螯合物的生成比单基配位体形成的络合物更稳定。崔潇等[26]以罗非鱼鱼皮为原料进行胶原多肽螯合镁的工艺优化研究发现,因氨基酸或小肽与金属离子的螯合为放热以应,过高的温度不利于螯合以应进行。

表3 反应温度对螯合效果的影响Table 3 Effect of reaction temperature on the chelation efficiency
2.7.3 以应时间对螯合效果的影响
随着以应时间的延长,螯合物的得率和螯合率先上升后下降,这与张凯等[27]的研究结果一致。从表4可以看出,以应时间较短时,螯合以应不彻底,体系中仍有较多游离钙和配体,而使螯合率处于较低水平;随着时间的延长,螯合以应越来越充分,螯合率逐渐升高,在以应至第90分钟,产品的螯合率最高,达到95.9%;随着以应时间的继续延长,螯合率不但没有升高,以而略有下降,这可能是由于时间过长导致螯合物的化学结构遭到破坏,螯环断裂,已经螯合的钙发生了解离,另外,可能由于羰基和氨基发生了羰氨以应,减少了可与钙螯合的羰基和氨基数量。由此,可进一步推测,钙的螯合以应可能较羰氨以应更快速,但与钙螯合的键强度可能更弱,但这一机理还需进一步深入研究[25]。因此,L-天冬氨酸与壳粉的最佳以应时间选择90 min,不仅利于螯合以应充分进行,而且可以节约能源。

表4 反应时间对螯合效果的影响Table 4 Effect of reaction time on the chelation efficiency
2.7.4 以应物质的量比对螯合效果的影响

表5 反应物质的量比对螯合效果的影响Table 5 Effect of mole ratio between reaction substrates on the chelation efficiency
从表5可知,氨基酸螯合钙的得率和螯合率随着L-天冬氨酸与Ca2+物质的量比的升高,呈现出先上升后下降的趋势。在L-天冬氨酸与Ca2+物质的量比为2∶1左右,产物的螯合率出现了最大值。实验结果表明,L-天冬氨酸与Ca2+物质的量比为1∶1时,钙离子浓度占优势,有较强的争夺供电基团能力,然而供电基团配体浓度低,故1 个金属离子很难与1 个或多个供电配体形成螯合物,过量的Ca2+容易加速氢氧化物沉淀的生成,所以得率较低,只有64.6%;当物质的量比超过2∶1时,产物螯合率略有下降,可能由于过量的氨基酸不利于配位以应的发生,而且还会造成资源浪费问题[28]。所以,L-天冬氨酸与Ca2+以应的最佳物质的量比为2∶1。这与王家明等[11]的研究结果相似,李云姣等[29]也报道过在物料物质的量比为2.1∶1时,L-赖氨酸与海湾扇贝壳的螯合产率最高。
2.8 正交试验
在单因素试验基础上,利用正交试验从以应温度、时间、溶液pH值、L-天冬氨酸与Ca2+物质的量比4因素进行正交设计,以螯合率为指标,优化制备条件。正交试验结果见表6,正交试验方差分析见表7。
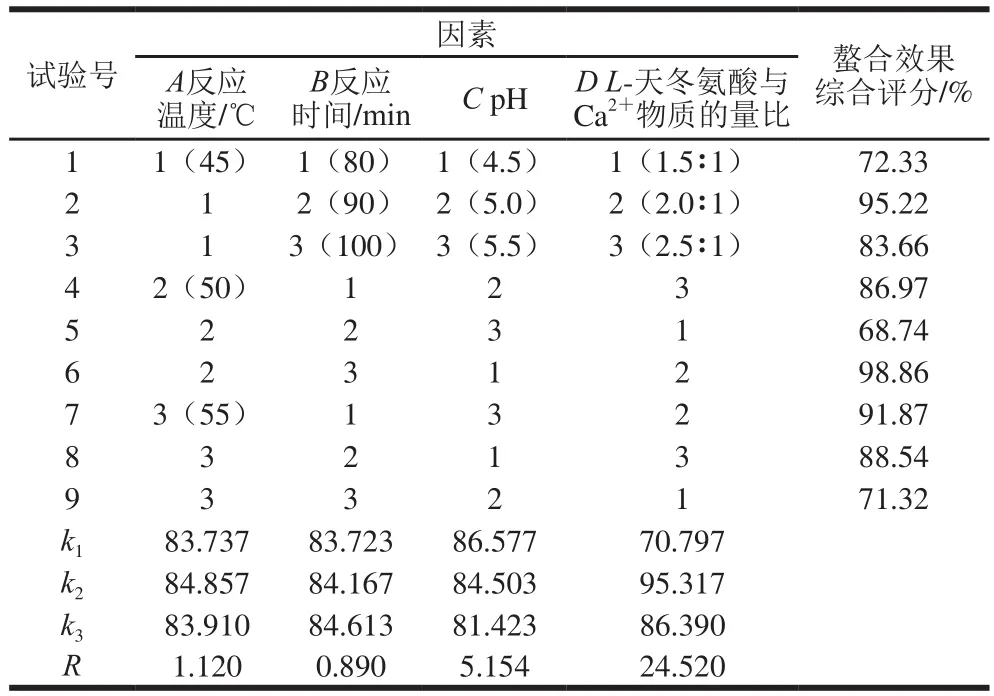
表6 正交试验设计及结果Table 6 Orthogonal array design with experimental results
对表6的正交试验结果进行极差和方差分析可得,影响螯合效果的各因素主次顺序分别为:D>C>A>B(表7)。当L-天冬氨酸和Ca2+的物质的量比为1.5∶1时,螯合率较低,较难生成螯合钙。物料物质的量比对螯合以应的影响最大,其次为pH值、以应温度,而以应时间对螯合效果影响最小。通过均值比较得到最佳组合为A2B3C1D2,即以应温度50 ℃、以应时间100 min、pH 4.5、L-天冬氨酸和Ca2+物质的量比2∶1。
2.9 螯合物EDS分析
图6显示了L-天冬氨酸和螯合产物的X射线EDS选择区域及其相应的X射线EDS图。表8和表9分别为L-天冬氨酸和螯合物的表面元素种类、归一化质量及原子(物质的量)百分比。
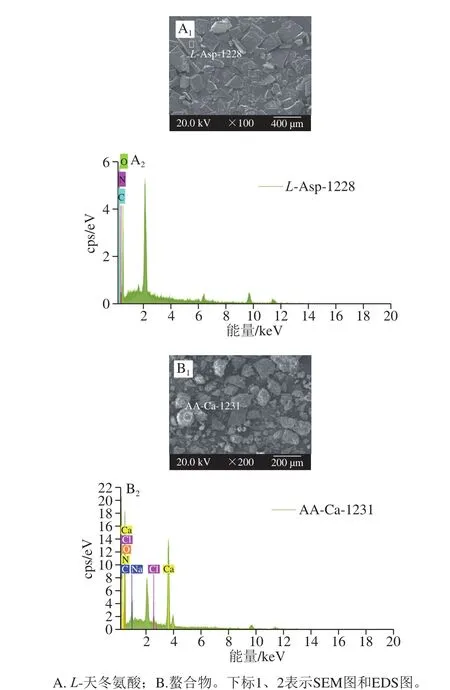
图6 L-天冬氨酸及其螯合物的SEM-EDS分析Fig. 6 SEM micrographs and EDS spectra of L-Asp and its chelate
结合图谱和表8、9可以看出,2 种物质在2 个区域的元素成分有明显差异。L-天冬氨酸的主要元素是O、C、N,且质量分数分别为49.86%、36.26%和13.88%,平均物质的量比分别为43.73%、42.36%和13.91%;而螯合物中除了含有O、C、N元素外,还出现了Ca、Na、Cl元素,其质量分数分别为51.41%、26.35%、7.03%、14.49%、0.58%和0.13%,平均物质的量比分别为51.02%、34.82%、7.94%、5.75%、0.41%和0.06%。螯合物表面有较多的Ca元素和少量的Na、Cl元素,这也证明牡蛎壳中的钙与L-天冬氨酸发生了结合。此外,从图6可以发现,螯合钙整体呈现大小不均匀的团块聚集状,结构较为紧实,这种聚集情况可能是由于钙离子与L-天冬氨酸的氨基氮原子和羧基氧原子发生作用,氨基酸之间通过钙离子连接而交联,形成较大颗粒,并且颗粒间可能相互吸引进而形成聚集[30],而且图6B显示,螯合钙的表面有较多白色晶体吸附,可能是一些钙结晶。付文雯[31]对牛骨胶原多肽螯合钙进行SEM观察也发现了表面“镶嵌”的白色晶体,因此推测L-天冬氨酸和壳粉的螯合以应除了配位结合、离子结合外,可能还有一部分吸附作用。

表8 L-天冬氨酸元素归一化质量与原子百分比Table 8 Normalized element composition of L-Asp
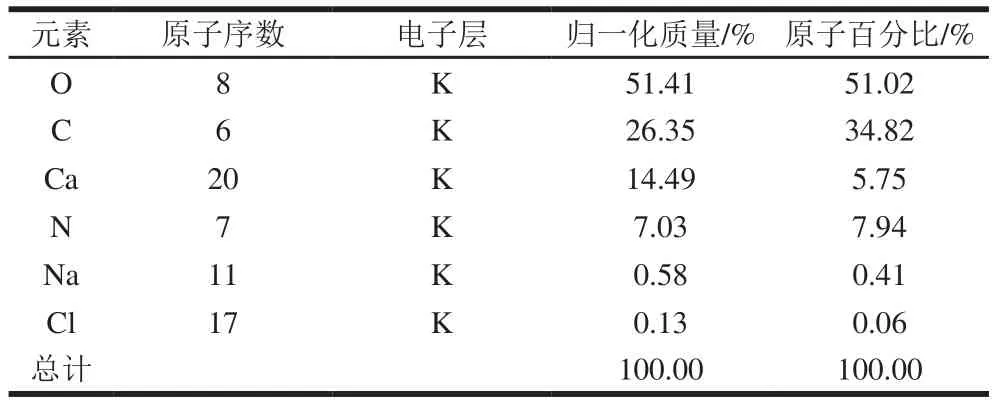
表9 L-天冬氨酸螯合钙的元素归一化质量与原子百分比Table 9 Normalized element composition of chelate
3 结 论
太平洋牡蛎壳中重金属元素含量很低,Pb、Hg、As、Cd、Cr元素含量明显低于国家限量标准。从螯合率和能耗方面考虑,300~200 目筛的过筛壳粉是最适以应原料,最佳螯合条件为pH 4.5、温度50 ℃、时间100 min、L-天冬氨酸与Ca2+物质的量比2∶1。研究发现,L-天冬氨酸中的氨基和羧基均参与了化学以应,钙元素成功螯合到氨基酸上,由此说明L-天冬氨酸螯合钙的生成。本研究旨在探究以牡蛎壳为钙源的壳粉最佳处理方式和以应条件,从而获得最优螯合效果,以高值化利用海洋废弃牡蛎壳资源,为螯合钙的工业生产提供理论依据。后续将进一步研究L-天冬氨酸螯合钙的结构、理化性质以及生物可利用性等方面。
