近江牡蛎多糖的结构鉴定及免疫调节能力分析
2020-06-01杨大俏王锦旭李来好杨贤庆马海霞岑剑伟王悦齐
杨大俏,王锦旭,李来好,杨贤庆,马海霞,岑剑伟,王悦齐
(1.中国水产科学研究院南海水产研究所,农业农村部水产品加工重点实验室,广东 广州 510300;2.上海海洋大学食品学院,上海 201306;3.韩山师范学院食品工程与生物科技学院,广东 潮州 521041)
近江牡蛎(Crassostrea rivularis)是瓣鳃纲牡蛎目牡蛎科海洋双壳类软体动物,是我国四大养殖贝类之一,在广东、广西、福建、山东、浙江等沿海地区有大量人工养殖[1]。其肉质鲜美,营养丰富,含有丰富的蛋白质[2]和碳水化合物,因其锌含量极高,富含铁、钙等元素,素有“海洋牛奶”[3]的称号,中医学认为,牡蛎重镇安神,滋阳补阴,软坚散结,收敛固涩,对惊悸失眠、劳神伤脾、阳痿、腰痛、崩漏等症有一定疗效。
多糖是由10 个以上单糖通过糖苷键联结在一起的大分子,广泛存在于动物、植物、微生物和真菌中,具有提高机体免疫力[4]、抗肿瘤[5-6]、抗氧化[7]、抗病毒[8]、抗衰老[9]等生物活性。前人对牡蛎多糖的研究集中于牡蛎多糖的提取、活性研究及简单结构分析,结果表明,太平洋牡蛎多糖主要由葡萄糖[10]组成,是以→4)-α-D-Glc-(1→为主链,含→3,4)-β-DGlc-(1→)支链的D-吡喃型葡聚糖,分子质量为1 299 kDa[11]。另外针对近江牡蛎多糖提取工艺及活性研究,结果表明,水提醇沉法制备粗多糖得率达9.72%[12],近江牡蛎多糖具有增强免疫功能[13]及抗肿瘤[14]的活性。目前有关近江牡蛎多糖的结构分析及活性研究较少,且多集中于粗多糖的体外抗氧化实验[15-16],关于近江牡蛎多糖的超滤膜分离纯化、结构鉴定及纯化多糖的免疫调节还鲜有报道。为高值化利用近江牡蛎资源,本课题对近江牡蛎粗多糖进行纯化,得到3 种近江牡蛎纯化多糖。采用液相色谱分析法、傅里叶变换红外光谱法、高碘酸氧化法及Smith降解法研究近江牡蛎多糖的结构;噻唑兰法、中性红实验、利用试剂盒检测细胞因子的分泌及mRNA的表达,用于研究近江牡蛎多糖的免疫调节能力。以期为近江牡蛎多糖生物活性作用机制与分子结构间的关系和近江牡蛎多糖的应用提供有用信息和数据支持。
1 材料与方法
1.1 材料与试剂
近江牡蛎全脏器(-20 ℃冷冻保藏) 广东省台山市农贸市场;Alcalase酶(210 AU/mg)、胰蛋白酶(≥250 U/mg) 广州齐云生物技术有限公司;离子交换填料DEAE纤维素DE-52、Sephadex G-100葡聚糖凝胶 北京Biotopped科技有限公司;1,9-二甲基亚甲基蓝、葡聚糖、氨基葡萄糖、11 种单糖、D-葡萄糖醛酸等标准品、磷酸缓冲液、DMEM高糖培养基溶液、胰蛋白酶、胎牛血清、链霉素、青霉素、脂多糖(lipopolysaccharide,LPS)、噻唑兰 美国Sigma公司;乙腈(色谱纯) 上海安谱实验科技股份有限公司;小鼠巨噬细胞系RAW264.7 中国科学院上海生命科学研究院细胞资源中心;中性红、肿瘤坏死因子TNF-α、白介素IL-6、白介素IL-1βELISA试剂盒、一氧化氮检测试剂盒、FastStart Universal SYBR Green Master试剂盒、Transcriptor cDNA Synth Kit逆转录试剂盒、6 孔/96 孔细胞培养板、透气细胞培养瓶、无菌离心管华宇欣生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Sunrise-basic Tacan吸光酶标仪 瑞士Tecan公司;FlowMem0021-HP三联高压平板膜设备 厦门福美科技有限公司;LC-20AD高效液相色谱仪、IRAffinity-1红外光谱仪、GC-2010气相色谱仪 日本岛津公司;S1000聚合酶链式以应(polymerase chain reaction,PCR)仪美国Bio-Rad公司;Mastercycler realplex实时荧光定量PCR仪 德国Eppendorf公司;NanoDrop 2000超微量紫外分光光度计 美国Thermo公司。
1.3 方法
1.3.1 近江牡蛎多糖的制备与纯化过程
近江牡蛎全脏器→匀浆→均质10 min→热水浸提→调pH 8.0→酶解→煮沸灭酶→离心(9 000 r/min,10 min)→上清液调pH 7.0→0.22 μm滤膜除杂→200 kDa膜分离→收集滤过液→滤过液经8 kDa膜分离[17]→收集8 kDa截留液→冻干得粗多糖CRRS-B[18]→样品溶解→DEAE-52阴离子交换柱层析→蒸馏水洗脱→收集组分→乙酸钠洗脱→收集组分→氯化钠洗脱→收集组分→透析→冷冻干燥→得近江牡蛎纯化多糖CRP-1、CRP-2、CRP-3。
1.3.2 近江牡蛎多糖分子质量和纯度测定
采用高效凝胶渗透色谱法[19]测定近江牡蛎多糖组分CRRS-B的分子质量分布,流动相为0.2 mol/L硫酸钠溶液,检测器为示差折光检测器,柱温30 ℃,进样体积20 μL,流速0.7 mL/min,色谱柱为Tosoh Biosep®G4000SWXL(7.8 mm×300 mm,5 μm),分别用流动相配制成质量浓度为0.5 mg/mL的不同分子质量的标准样品溶液:平均分子质量为1 000、5 000、10 000、50 000、150 000、410 000、670 000 Da的葡聚糖按照一定比例混合后,多糖样品配制为0.5 mg/mL,用孔径为0.22 μm微孔滤膜过滤后进高效液相色谱仪,用峰面积归一法计算粗多糖分子质量的分布情况。
将冻干后的多糖样品CRRS-B以蒸馏水溶解配制成10 mg/mL,上DEAE-52纤维素柱,分别以蒸馏水、0.1 mol/L乙酸钠、0.5 mol/L乙酸钠、0.01 mol/L氯化钠、0.1 mol/L氯化钠、1 mol/L氯化钠梯度洗脱,以苯酚-硫酸法[20]测定洗脱溶液吸光度,收集洗脱组分,将各洗脱组分透析除盐。将各洗脱组分分别上Sephadex G-100葡聚糖凝胶柱,以蒸馏水洗脱,绘制洗脱曲线。
1.3.3 近江牡蛎多糖理化性质测定
采用苯酚-硫酸法测定纯化多糖(CRP-1、CRP-2及CRP-3)中总糖含量;采用1,9-二甲基亚甲基蓝[21]测定纯化多糖中酸性糖含量;采用尹珊珊等[22]的方法测定甲基戊糖含量;采用硫酸-咔唑法[23]测定己糖醛酸含量;采用明胶-氯化钡比浊法[24-25]测定硫酸基含量;采用Wanger法[26]测定氨基己糖含量。
1.3.4 近江牡蛎多糖单糖组成分析
样品水解及标准品的衍生化方法参照陈燕文等[27]的方法,采用液相色谱法测定样品中多糖组成。液相色谱条件:Gracesmart C18色谱柱(250 mm×4.6 mm,5 μm);流动相A为100 mmol/L磷酸钠缓冲溶液,流动相B为乙腈;检测波长250 nm;柱温30 ℃;流速1 mL/min;进样量5 μL;程序洗脱:0~10 min,85% A;10~30 min,85%~83% A;30~35 min,8 3%~8 0% A;35~36 min,80%~60% A;36~40 min,60%~85% A。
1.3.5 近江牡蛎多糖傅里叶变换红外光谱分析
多糖样品2 mg与100 mg溴化钾混合研细后,在4 000~400 cm-1波数范围内进行傅里叶变换红外光谱扫描[19]。
1.3.6 高碘酸氧化和Smith降解
参照文献[28]的方法,记录高碘酸钠消耗量、甲酸生成量,将经过高碘酸氧化及Smith降解的溶液水解、乙酰化后利用气相色谱及Rtx-1701毛细管柱(30 m×0.32 mm,0.25 μm)进行醇类化合物定性测定。
1.3.7 近江牡蛎多糖对小鼠巨噬细胞免疫调节活性的测定
利用噻唑兰法[29-30]检测近江牡蛎多糖对小鼠巨噬细胞存活率的影响;中性红实验[30-31]检测近江牡蛎多糖对小鼠巨噬细胞吞噬活性的影响;利用试剂盒检测近江牡蛎多糖对小鼠巨噬细胞一氧化氮及细胞因子(TNF-α、IL-6和IL-1β)的影响;利用逆转录试剂盒检测近江牡蛎多糖对巨噬细胞mRNA表达的影响。
1.4 数据处理
以上实验均经过3 次重复操作,数值以 ±s表示。采用IBM SPSS Statistics 20.0对数据进行统计分析,运用单因素方差分析其显著性。
2 结果与分析
2.1 近江牡蛎纯化多糖的分子质量测定

图1 不同分子质量葡聚糖标准品拟合曲线(a)及近江牡蛎多糖的分子质量分布(b)Fig. 1 Fitting curve of glucan standards with different molecular masses (a) and molecular mass distribution of polysaccharides (b) from C. rivularis
由图1可知,近江牡蛎粗多糖经过凝胶渗透色谱分析得3 个峰的分子质量分别为124.5、67.0 kDa和8.3 kDa,使用DEAE-52将其分离,依次使用蒸馏水、0.1 mol/L乙酸钠、0.5 mol/L乙酸钠、0.01 mol/L氯化钠、0.1 mol/L氯化钠、1 mol/L氯化钠洗脱,结果见图2。得到水洗组分CRP-1,0.5 mol/L乙酸钠洗组分CRP-2,0.01 mol/L氯化钠洗组分CRP-3。由图3可知,3 种组分分别经Sephadex G-100检验得到对称的洗脱曲线,与高效凝胶渗透色谱法相互验证,表明近江牡蛎纯化多糖CRP-1、CRP-2、CRP-3为纯度较好的分子质量分别为124.5、67.0 kDa和8.3 kDa的单一组分多糖。

图2 近江牡蛎多糖的梯度洗脱曲线Fig. 2 Gradient elution curve of polysaccharides from C. rivularis by DEAE-52 column chromatography
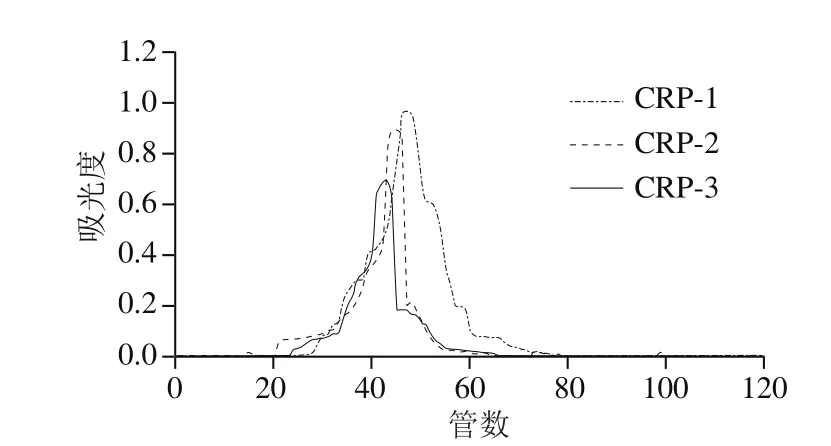
图3 CRP-1~3的Sephadex G-100的洗脱曲线Fig. 3 Elution curves of CRP-1-3 by Sephadex G-100 column chromatography
2.2 近江牡蛎纯化多糖理化性质分析
苯酚-硫酸法测得葡萄糖标准曲线为y=7.468 2x-0.004 7,R2=0.999 0,测得CRP-1、CRP-2、CRP-3的总糖质量分数分别为(32.40±0.89)%、(78.50±1.90)%、(73.46±2.19)%。1,9-二甲基亚甲基蓝法测得酸性糖标准曲线为y=1.257 8x+0.002 2,R2=0.999 0,测得结果中显示CRP-1、CRP-2、CRP-3的酸性糖质量分数分别为(0.28±0.01)%、(2.12±0.36)%、(2.74±0.46)%。采用文献[22]的方法测得甲基戊糖标准曲线为y=0.150 8x+0.215 1,R2=0.999 6,其质量分数分别为0%、(9.36±0.62)%、(7.55±0.22)%。硫酸-咔唑法测得己糖醛酸标准曲线为y=0.007 5x+0.096 9,R2=0.999 3,测得结果显示CRP-1、CRP-2、CRP-3的己糖醛酸质量分数分别为(2.29±0.11)%、(16.14±0.63)%、(23.85±0.51)%。明胶-氯化钡比浊法测得硫酸基标准曲线为y=0.473 8x+0.025 5,R2=0.990 9,测得其质量分数分别为(1.60±0.08)%、(26.50±1.67)%、(27.02±3.39)%。Wanger法测得氨基己糖标准曲线为y=0.035 2x-0.001,R2=0.990 8,测得CRP-1、CRP-2、CRP-3的氨基己糖质量分数分别为(18.62±0.55)%、(71.65±9.49)%、(41.04±7.17)%。
2.3 近江牡蛎纯化多糖的单糖组成
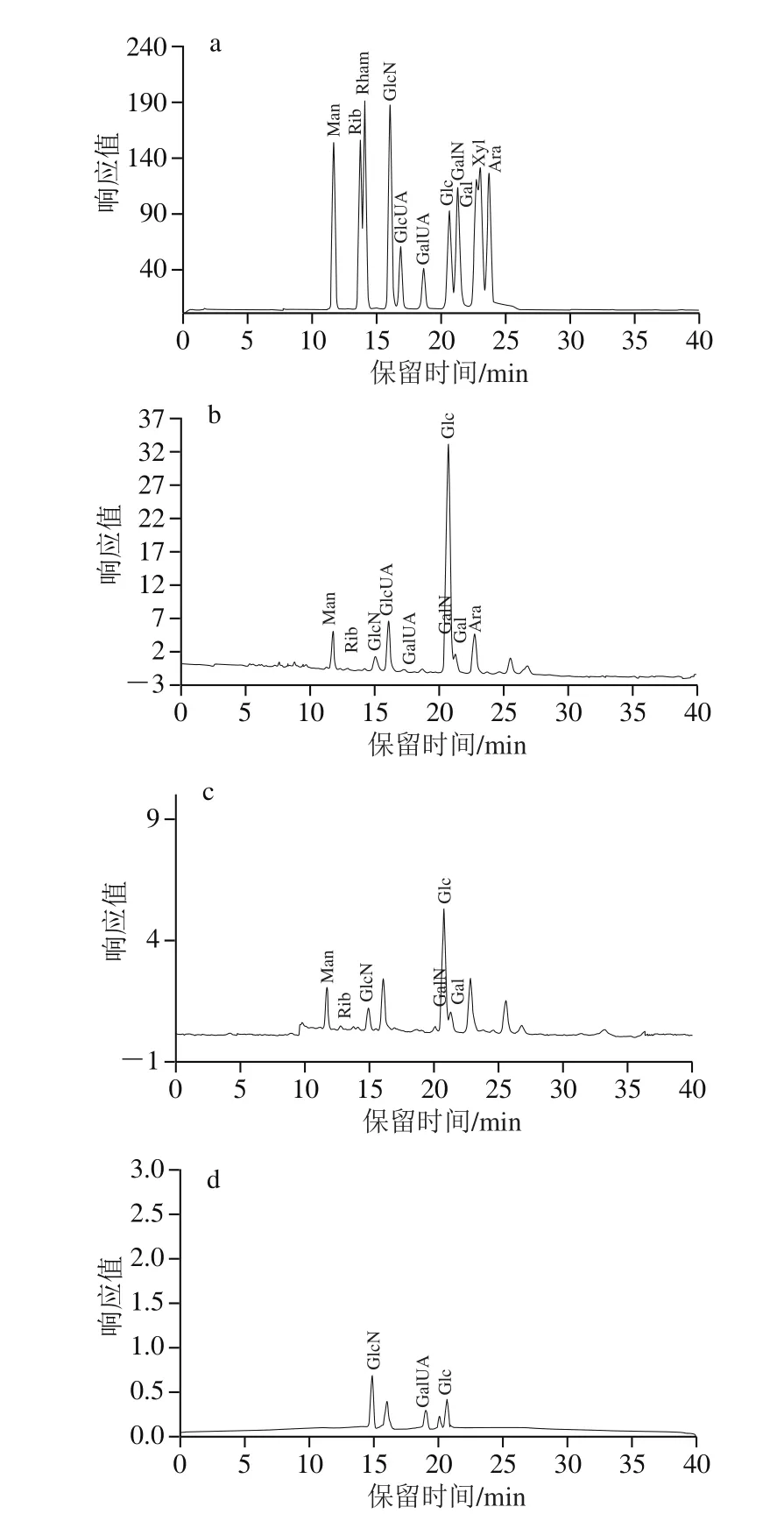
图4 单糖标准品和CRP-1~3的单糖高效液相色谱图Fig. 4 High performance liquid chromatograms of standard monosaccharides and monosaccharides derived from CRP-1 through 3
通过对多糖水解及其衍生化产物的测定,可以得出单糖组成和物质的量比。多糖经水解、衍生化,液相色谱测定,与标准品的出峰时间相互对比,即可得到样品中的单糖组成和物质的量比。如图4所示,与标准品色谱图对比可知,近江牡蛎多糖CRP-1主要由甘露糖、核糖、氨基葡萄糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、氨基半乳糖、半乳糖、阿拉伯糖组成,9 种单糖的物质的量比为5.55∶0.32∶9.08∶0.47∶0.66:48.13∶3.57∶8.53∶0.30,其中葡萄糖、氨基葡萄糖、半乳糖、甘露糖、氨基半乳糖含量之和达74.86%,葡萄糖含量最高。CRP-2主要由甘露糖、核糖、氨基葡萄糖、葡萄糖、氨基半乳糖、半乳糖组成,6 种单糖的物质的量比为7.79∶0.41∶12.69∶32.08∶4.98∶15.92,葡萄糖、半乳糖、氨基葡萄糖、甘露糖、氨基半乳糖的含量之和达73.87%,其中氨基葡萄糖及氨基半乳糖含量高达17.67%。CRP-3主要由氨基葡萄糖、半乳糖醛酸、葡萄糖组成,3 种单糖的物质的量比为8.91∶5.71∶10.15,醛酸所占比例达到23.05%。
2.4 近江牡蛎多糖的傅里叶变换红外光谱分析

图5 CRP-1~3的傅里叶变换红外光谱图Fig. 5 Fourier transform infrared spectra of CRP-1 through 3
从图5a可以看出,3 442.94 cm-1的强吸收峰为—OH键的伸缩振动吸收,2 958.8 cm-1为—CH3基团的以对称伸缩振动,2 924.09 cm-1出现C—H强伸缩振动峰,2 852.72 cm-1的—CH2的对称伸缩振动峰,2 360.87 cm-1为C—H弯曲振动,其中,3 442.94 cm-1及2 924.09 cm-1为糖类化合物的特征峰。1 641.42 cm-1为—CHO的C=O的伸缩振动,1 458.18 cm-1为—CH3基团的以对称弯曲振动峰,1 413.82 cm-1为C—O对称振动,10 31.92 cm-1为吡喃糖环的C=O伸缩振动。表明CRP-1为多醛基吡喃环糖苷的多糖化合物。
从图5b可以看出,3 439.08 cm-1为—OH键的强伸缩振动,3 290.56 cm-1为—NH2的以对称伸缩振动峰,3 184.48 cm-1为—OH与—COOH的二聚体OH的伸缩振动,2 983.88 cm-1为芳环与不饱和碳的伸缩振动,2 362.80 cm-1为—CH弯曲振动,1 400~1 200 cm-1的吸收峰为C—H的变角振动吸收峰,其中,3 439.08 cm-1及C—H变角振动峰为糖类化合物的特征峰。1 701.22 cm-1的吸收峰为酮基的C=O键的伸缩振动峰,1 683.86 cm-1处的吸收峰为—CH2—CO—NH—等酰胺的C=O伸缩振动峰,1 641.42 cm-1是顺式或乙烯基的C=C伸缩振动峰,1 415.75 cm-1吸收峰是C—O对称振动峰,1 051.20 cm-1及1 020.34 cm-1是C—O伸缩振动峰,644.22 cm-1掩盖吸收峰是—OH摇摆振动峰,644.22 cm-1为—C≡CH键的弯曲振动峰的基频峰,1 238.56 cm-1为其弯曲振动倍频峰。表明CRP-2为多酮基不饱和多糖化合物。
从图5c可以看出,3 446.79 cm-1为—OH键的强伸缩振动,3 288.63 cm-1为—NH2的以对称伸缩振动峰,3 176.76 cm-1为—OH与—COOH的二聚体OH的伸缩振动,3 014.74 cm-1为芳环与不饱和碳的伸缩振动,2 360.87 cm-1为—CH弯曲振动,1 400~1 200 cm-1的吸收峰为C—H的变角振动吸收峰,其中,3 446.79 cm-1及2 360.87 cm-1为C—H变角振动峰是糖类化合物的特征峰。1 703.14 cm-1的吸收峰为酮基的C=O键的伸缩振动峰,1 687.71 cm-1的吸收峰为—CH2—CO—NH—等酰胺的C=O的伸缩振动峰,1 639.49 cm-1为顺式或乙烯基的C=C的伸缩振动峰,1 413.38 cm-1吸收峰为—COOH的弯曲及伸缩振动峰,1 051.20 cm-1及1 020.34 cm-1为C—O伸缩振动峰,642.30 cm-1为—C≡CH键的弯曲振动峰的基频峰。表明CRP-3为多酮基含羧基多不饱和多糖化合物。
2.5 近江牡蛎多糖的高碘酸氧化和Smith降解
近江牡蛎多糖CRP-1~3经高碘酸氧化120 h后达到稳定,吸光度分别为0.148、0.027、0.092,通过标准曲线y=0.053x-0.055 9(R2=0.991 8)计算,可知消耗高碘酸的量分别为0.19、0.08、0.14 mmol;用0.01 mol/L氢氧化钠溶液滴定,得到甲酸生成量分别为0.041、0.037、0.043 mmol。近江牡蛎多糖CRP-1~3经高碘酸氧化后生成甲酸,说明含有1→6位糖苷键或非还原末端(1→),高碘酸的消耗量大于甲酸生成量的2 倍,说明含有只消耗高碘酸而不产生甲酸的糖苷键,如1→2、1→4、1→2,4、1→4,6位糖苷键及不消耗高碘酸也不产生甲酸的1→3位糖苷键,根据甲酸消耗量推测CRP-1中1→6位或1→位连接的糖苷键为0.082 mol,以1→2位或1→4位键合的糖基为0.108 mol;CRP-2中1→6位或1→位连接的糖苷键为0.074 mol,以1→2位或1→4位键合的糖基为0.006 mol;CRP-3中1→6位或1→位连接的糖苷键为0.086 mol,以1→2位或1→4位键合的糖基为0.094 mol。
样品经过高碘酸氧化后,生成多糖醛,进一步经过Smith降解,多糖醛还原成醇类化合物,根据不同生成物质判断糖苷键连接方式,其中1→2位糖苷键还原,生成甘油;1→4位糖苷键还原,生成赤藓醇和乙二醇;1→6位糖苷键还原,生成甘油和乙二醇;1→3位糖苷键不被氧化降解。将利用气相色谱-质谱联用对还原出的醇类化合物进行定性,结果如图6所示,得知CRP-1被还原出甘油、乙二醇及赤藓醇,CRP-2被还原出甘油、赤藓醇、乙二醇,CRP-3被还原出甘油及赤藓醇,说明CRP-3中无1→4位及1→6位糖苷键。

图6 醇类化合物标准品及近江牡蛎多糖Smith降解后的气相色谱图Fig. 6 Gas chromatograms of alcohol standards and Smith degradation products of CRP-1, 2 and 3
2.6 近江牡蛎多糖对小鼠巨噬细胞的免疫调节活性
2.6.1 近江牡蛎多糖对细胞存活率的影响
为排除所用试样对小鼠巨噬细胞有药理毒害作用的因素,故以细胞存活率实验检验其细胞毒性及给药浓度。如图7所示,各质量浓度的近江牡蛎粗多糖及500 μg/mL的纯化多糖与RAW264.7共同培养24 h,与对照组相比,细胞存活率无明显差异,判断近江牡蛎多糖不抑制巨噬细胞的正常生长作用(P>0.05),因此近江牡蛎多糖可用于后续的实验研究。
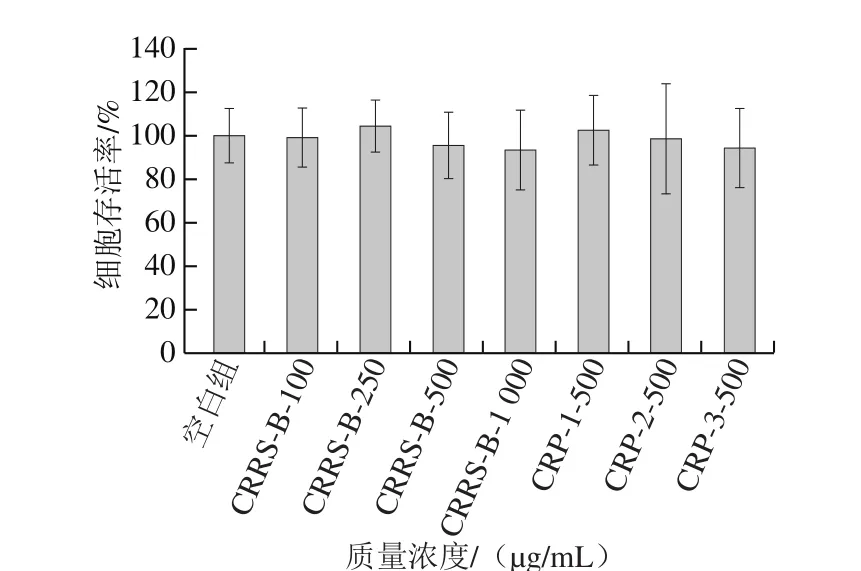
图7 不同质量浓度近江牡蛎粗多糖CRRS-B和500 μg/mL CRP-1~3对RAW264.7细胞存活率的影响Fig. 7 Effects of different concentrations of CRRS-B and CRPs-1 through 3 at 500 μg/mL on survival rate of RAW264.7 cells
2.6.2 近江牡蛎多糖对小鼠巨噬细胞吞噬能力的影响
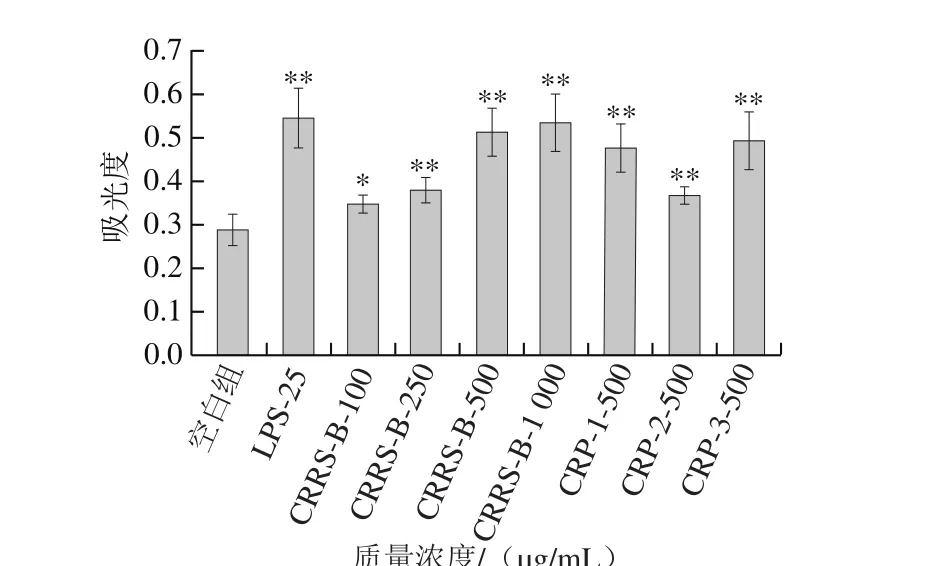
图8 不同质量浓度近江牡蛎粗多糖CRRS-B和近江牡蛎纯化多糖(500 μg/mL)CRP-1~3对RAW264.7吞噬中性红的影响Fig. 8 Effects of different concentrations of CRRS-B and CRPs-1 through 3 (500 μg/mL) on neutral red phagocytosis of RAW264.7 cells
吞噬细胞的主要功能是吞噬病原体等异物[32],为了研究近江牡蛎多糖对巨噬细胞吞噬能力的影响,检测经试样培养的RAW264.7对中性红试剂的吞噬功能。如图8所示,与空白组相比,CRRS-B、CRP-1~3和LPS,均能使巨噬细胞的吞噬能力显著增强(P<0.05),在同一质量浓度下,近江牡蛎纯化多糖对小鼠吞噬细胞中性红吞噬能力的影响力排序为CRP-3>CRP-1>CRP-2。
2.6.3 近江牡蛎多糖对效应因子和细胞因子分泌的影响2.6.3.1 近江牡蛎纯化多糖对NO的影响
病原体、细胞碎片或外来异物刺激巨噬细胞产生效应因子,进一步刺激其他免疫细胞的生成,以构成机体免疫系统,其中NO是巨噬细胞产生的主要效应分子和活性介质,激活淋巴球等其他免疫细胞而在非特异性免疫应答中发挥主要细胞效应[33-34]。如图9所示,近江牡蛎多糖CRP-1、CRP-2及CRP-3能够显著增强小鼠巨噬细胞NO的生成能力(P<0.01),且CRP-3>CRP-1>CRP-2。

图9 近江牡蛎纯化多糖CRP-1~3(500 μg/mL)对RAW264.7 NO生成的影响Fig. 9 Effects of CRPs-1 through 3 (500 μg/mL) on NO production of RAW264.7 cells
2.6.3.2 近江牡蛎纯化多糖对TNF-α、IL-6和IL-1β的影响
为了研究近江牡蛎多糖对小鼠巨噬细胞分泌细胞因子TNF-α、IL-6和IL-1β的影响,采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒方法检测细胞因子TNF-α、IL-6和IL-1β的分泌。如图10所示,与空白组相比,经近江牡蛎多糖CRP-1、CRP-3和LPS处理组分泌的TNF-α、IL-6和IL-1β显著提高(P<0.01),CRP-2能够增强小鼠巨噬细胞因子TNF-α、IL-6和IL-1β的分泌(P<0.05),且CRP-3>CRP-1>CRP-2,表明近江牡蛎多糖能够显著诱导巨噬细胞生成TNF-α、IL-6和IL-1β,增强机体免疫应答能力。
2.6.4 近江牡蛎多糖对mRNA表达的影响
巨噬细胞分泌NO、TNF-α、IL-6和IL-1β等效应因子和细胞因子,可有效激活其他免疫细胞,细胞因子的合成主要受相应的一氧化氮合酶iNOS、TNF-α、IL-6和IL-1β等相关基因的调控,为了进一步确认近江牡蛎多糖对小鼠巨噬细胞NO生成和细胞因子分泌的影响,采用RT-PCR试剂盒法检测近江牡蛎多糖对iNOS、TNF-α、IL-6和IL-1βmRNA相对表达的影响。
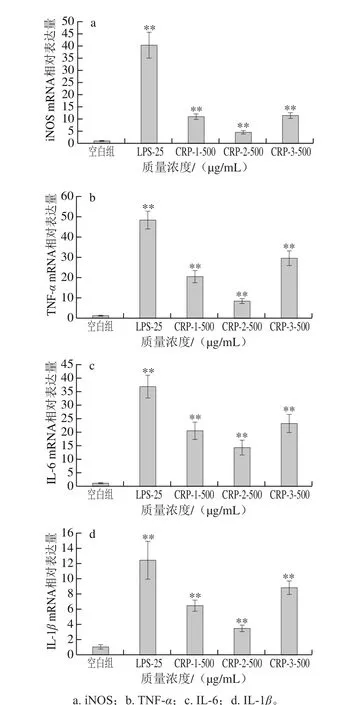
图11 近江牡蛎纯化多糖CRP-1~3(500 μg/mL)对RAW264.7 mRNA表达的影响Fig. 11 Effects of CRPs-1 through 3 (500 μg/mL) on mRNA expression levels of iNOS and cytokines in RAW264.7 cells
如图11所示,经CRP-1~3和LPS处理后,RAW264.7中iNOS、TNF-α、IL-6和IL-1β mRNA表达均被显著上调(P<0.01),CRP-3>CRP-1>CRP-2,证明近江牡蛎多糖能够通过诱导小鼠巨噬细胞上调相关基因的表达,生成效应因子NO和分泌细胞因子,从而激活免疫应答。
3 结 论
CRP-1的总糖质量分数为(32.40±0.89)%,分子质量为124.5 kDa,是组分均一的多糖,由甘露糖、核糖、氨基葡萄糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、氨基半乳糖、半乳糖、阿拉伯糖组成,9 种单糖的物质的量比为5.55∶0.32∶9.08∶0.47∶0.66∶48.13∶3.57∶8.53∶0.30。CRP-2的总糖质量分数为(78.50±1.90)%,分子质量为67.0 kDa,是由甘露糖、核糖、氨基葡萄糖、葡萄糖、氨基半乳糖、半乳糖组成,6 种单糖的物质的量比为7.79∶0.41∶12.69∶32.08∶4.98∶15.92。CRP-3的总糖质量分数为(73.46±2.19)%,分子质量为8.3 kDa,是由氨基葡萄糖、半乳糖醛酸、葡萄糖组成,3 种单糖的物质的量比为8.91∶5.71∶10.15。傅里叶变换红外光谱分析结果显示,CRP-1为多醛基吡喃环糖苷的多糖化合物;CRP-2为多酮基不饱和多糖化合物;CRP-3为多酮基含羧基多不饱和多糖化合物。
以小鼠巨噬细胞系RAW264.7为模型,证明近江牡蛎多糖CRP-1~3能够增强巨噬细胞中性红的吞噬能力,具有免疫调节活性;且近江牡蛎纯化多糖CRP-1~3能够显著增强小鼠巨噬细胞效应因子NO和细胞因子TNF-α、IL-6和IL-1β的分泌,上调mRNA表达iNOS、TNF-α、IL-6和IL-1β等细胞因子并诱导NO、TNF-α、IL-6、IL-1β等细胞因子的分泌,近江牡蛎纯化多糖对小鼠巨噬细胞的免疫调节活性大小为CRP-3>CRP-1>CRP-2。
本实验采用分级膜分离联产制备近江牡蛎多糖及近江牡蛎多肽,并对近江牡蛎多糖进行分子质量测定、DEAE-52纯化、单糖组成分析、傅里叶变换红外光谱测定、糖苷键类型测定及免疫活性测定,结果表明联产制备出的近江牡蛎多糖具有制备价值。
4 讨 论
CRP-3的氨基葡萄糖和半乳糖醛酸的相对含量远高于CRP-1和CRP-2,其酸性糖含量和己糖醛酸含量较高,且其分子质量最小,因而CRP-3的免疫调节能力最高,此结论进一步验证了胡雪琼等[13]对近江牡蛎糖胺聚糖的研究;对于CRP-1及CRP-2而言,两者的主要差别为CRP-2的氨基葡萄糖和氨基半乳糖远高于CRP-1,推断吞噬能力大小为CRP-1>CRP-2,由不同单糖组成差异导致,具体影响机制有待进一步研究。
