奇亚籽皮多糖对乳状液聚集稳定性的影响
2020-06-01刘婷婷赵文婷刘鸿铖张闪闪陈玥彤王大为
刘婷婷,赵文婷,刘鸿铖,张闪闪,陈玥彤,王大为,
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.农业农村部食用菌加工技术集成科研基地,吉林 长春 130118;3.吉林省粮食精深加工与高效利用工程研究中心,吉林 长春 130118;4.吉林省粮食精深加工与副产物高效利用技术创新重点实验室,吉林 长春 130118)
奇亚籽是唇形科芡欧鼠尾草的种子,原产于墨西哥南部和危地马拉北部[1]。奇亚籽由种皮、胚乳和胚组成,种皮遇水膨胀,表面附着一层透明黏液质,这层黏液质称为奇亚籽皮多糖[2]。奇亚籽皮多糖是一种高分子质量的阴离子杂多糖[3],具有高持水性[4]、高黏度[5]以及增稠作用[6]。相关研究表明,奇亚籽皮多糖可以用作脂肪替代品以减少面包和蛋糕中的脂肪含量[7]。此外,Timilsena等[8]报道奇亚籽皮多糖还可以使油-水界面的表面张力显著降低,其乳化特性和表面活性与阿拉伯胶、瓜尔胶等常见多糖相当。
乳化剂广泛应用于食品加工中,具有提高产品均一稳定性、流动性等重要作用。随着人们生活水平的提高以及对健康的日益重视,安全无风险天然植物多糖乳化剂的开发极具前景。Porfiri等[9]从脱脂大豆粉中获得大豆多糖样品,发现其作为O/W型乳化剂应用潜力很大。Li Junjun等[10]提取了沙蒿多糖,证明其具有乳化性,利用木聚糖酶处理后,水解产物表现出更好的乳化稳定性。Garti等[11]实验表明低分子质量的马齿苋多糖,可形成直径小于2 μm的水包油型乳化剂,有着较好的乳化稳定性。目前,天然植物多糖乳化剂已成功应用于饮料、冰淇淋和调味品等产品中。例如,阿拉伯胶是公认的香精包埋材料,形成的香精乳液黏度低、气味清淡,在制备工艺和贮藏过程中能够阻止香精氧化[12];添加可溶性大豆多糖作为清爽型酸乳饮料中的稳定剂,可以乳化香精、协调口感[13]。奇亚籽皮多糖具备乳化剂的潜质,是一种潜在的天然植物多糖乳化剂[14]。国内外研究主要集中于奇亚籽皮多糖的分子构型、构象以及生物活性,关于其乳化性及乳化稳定性的研究目前鲜见报道。
在本研究中,通过热水浸提法提取奇亚籽皮多糖,研究不同质量浓度(1、5、10、15、20 mg/mL)的奇亚籽皮多糖表观黏度、持水力、持油力以及在O/W乳状液中的乳化性和乳化稳定性,通过激光粒度分析仪、多重光散射稳定性分析仪、光学法微流变仪和流变仪考察不同质量浓度的奇亚籽皮多糖对乳状液的粒度分布、乳化稳定性、表观黏度及微流变特性的影响,基于Tubiscan软件对数据进行处理分析,得到乳化稳定性较强的奇亚籽皮多糖乳状液,为寻找天然植物多糖乳化剂并将其应用于食品行业中提供参考和理论依据。
1 材料与方法
1.1 材料与试剂
奇亚籽购自杭州绿之宝食品有限公司,经碾压粉碎后过60 目筛网得到奇亚籽皮;玉米油 市售;葡聚糖标准品 瑞典Pharmacia公司;溴化钾、无水乙醇、三氯甲烷、正丁醇(均为分析纯) 北京化工厂。
1.2 仪器与设备
Alpha1-4LDplus真空冷冻干燥机 德国Marin Christ公司;IR Prestige-2傅里叶红外光谱仪 日本岛津公司;UV210紫外-可见分光光度计 美国Unico公司;1515型高效液相色谱仪 美国Waters公司;Malvern Mastersizer 3000E激光粒度分析仪 英国马尔文仪器有限公司;Turbiscan AGS多重光散射稳定性分析仪、Rheolaser Master微流变仪 法国Formulaction仪器公司;DiscoveryHR-1流变仪 美国TA公司。
1.3 方法
1.3.1 奇亚籽皮多糖的提取
称取适量的奇亚籽皮,按料液比1∶90(g/mL)加入蒸馏水浸泡过夜,然后置于水浴锅中加热至80 ℃浸提2 h,离心(3 800 r/min,20 min),收集上清液并在旋转蒸发器上减压浓缩,浓缩液除蛋白(Sevag试剂:三氯甲烷-正丁醇(4∶1,V/V),振荡30 min),加入3 倍体积的95%乙醇沉淀,4 ℃冷藏过夜,而后3 800 r/min离心15 min,收集沉淀物,真空冷冻干燥一定时间,粉碎研磨即得奇亚籽皮多糖。
1.3.2 奇亚籽皮多糖的纯度测定
通过紫外分光光度计在190~400 nm波长范围内扫描奇亚籽皮多糖,以蒸馏水代替多糖溶液作为对照。检测奇亚籽皮多糖中是否存在核酸及蛋白质。
1.3.3 奇亚籽皮多糖的红外光谱扫描
称取2 mg奇亚籽皮多糖与200 mg烘干至质量恒定的KBr研磨均匀,压片,利用红外光谱仪在4 000~400 cm-1波数范围内进行扫描。
1.3.4 奇亚籽皮多糖的平均分子质量
将2.0 mg/mL的奇亚籽皮多糖溶液经0.45 μm滤膜过滤,然后注入高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)仪。测试条件:1515型高效液相色谱仪;Ultrahydrogel 500、2000色谱柱;2414示差折光检测器;流动相为0.1 mol/L NaNO3溶液;流速为0.5 mL/min;柱温和检测器温度均为35 ℃,进样量25 μL。
1.3.5 奇亚籽皮多糖的表观黏度
按照杨嘉丹等[15]方法,配制不同质量浓度(1、5、10、15、20 mg/mL)的多糖溶液,室温下搅拌均匀,静置12 h使其充分溶解。采用直径为40 mm的不锈钢锥板夹具,设置间隙1.0 mm,于25 ℃测量,吸取量固定为1.5 mL。在剪切速率范围0.01~500 s-1内,考察质量浓度对奇亚籽皮多糖溶液表观黏度的影响。
1.3.6 奇亚籽皮多糖的持水力
参照刘丽莎等[16]的方法。将奇亚籽皮多糖准确称取0.02、0.1、0.2、0.3、0.4 g置于离心管中,加入20 mL蒸馏水,4 000 r/min离心20 min,弃去上清液,称质量。奇亚籽皮多糖的持水力按式(1)计算:
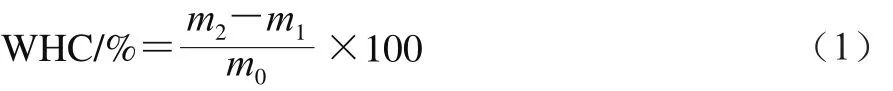
式中:WHC为持水力/%;m0为样品质量/g;m1为离心管质量/g;m2为吸水后样品和离心管总质量/g。
1.3.7 奇亚籽皮多糖的持油力
准确称取0.02、0.1、0.2、0.3、0.4 g奇亚籽皮多糖置于离心管中,加入玉米油20 mL,4 000 r/min离心20 min,弃去上层油液并用滤纸吸除残渣中游离的油,称质量。奇亚籽皮多糖的持油力按式(2)计算:
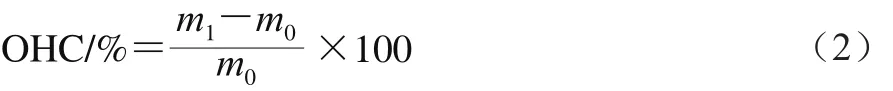
式中:OHC为持油力/%;m0为样品质量/g;m1为残渣质量/g。
1.3.8 奇亚籽皮多糖乳状液的制备
将奇亚籽皮多糖溶于蒸馏水中,配制不同质量浓度(1、5、10、15、20 mg/mL)的多糖溶液,磁力搅拌器搅拌(300 r/min,20 min),然后缓慢加入体积分数5%的玉米油,乳状液总体积50 mL。在室温条件下,于高速剪切乳化机26 000 r/min乳化2 min,乳状液制备好后立即添加0.2 mg/mL的叠氮钠溶液,在4 ℃条件下保存备用。
1.3.9 乳状液粒度的测定
参照Liu Hongcheng等[17]方法,采用Malvern Mastersizer 3000E激光粒度分析仪测定不同质量浓度(1、5、10、15、20 mg/mL)奇亚籽皮多糖溶液的乳状液液滴平均粒径及其分布。测试条件:在室温条件下,将少量乳状液分散于流动的蒸馏水中(2 400 r/min),使遮光率达到9%左右。贮存14 d内定期对乳状液进行检测。分散相(玉米油)和连续相(水)的折射率分别为1.473和1.330。乳状液的平均粒径用体积分数平均直径(D[4,3])表示,按照式(3)计算:

式中:ni为粒径大小为di的颗粒数量。
1.3.10 乳状液稳定性分析
参考Xu Duoxia等[18]方法,利用Turbiscan AGS多重光散射稳定性分析仪,分析不同质量浓度(1、5、10、15、20 mg/mL)奇亚籽皮多糖乳状液的稳定性。将乳状液置于样品池中,以扫描模式运行,测试温度25 ℃,每隔40 μm采集透射光和背散射光数据,得到透射光强度变化(ΔT)和背散射光强度变化(ΔBS)相对于样品高度(mm)的变化曲线,用稳定性动力学指数(the stability index,TSI)表征乳状液的乳化稳定性。贮存14 d内定期对乳状液进行检测,将ΔBS曲线与参比曲线(t=0 h)进行比较。
此外,对奇亚籽皮多糖乳状液进行离心加速实验。将乳状液在80 ℃热水浴中保持1 h后,以3 000 r/min离心10 min,按式(4)计算乳化指数(creaming index,CI):

式中:V1为离心后乳清层的高度/mL;V0为乳状液的总高度/mL。
1.3.11 乳状液表观黏度的测定
利用DHR-1流变仪测定,取1.5 mL乳状液加在测试台上,室温下采用直径为40 mm的不锈钢锥板夹具,设置间隙1.0 mm,检测不同质量浓度(1、5、10、15、20 mg/mL)奇亚籽皮多糖乳状液的表观黏度并将其绘制为剪切速率(0.01~500 s-1)的函数。
1.3.12 乳状液微流变特性的测定
使用Rheolaser Master光学法微流变仪分析不同质量浓度(1、5、10、15、20 mg/mL)奇亚籽皮多糖乳状液液滴的布朗运动,微流变是基于一种被称为扩散光谱学的动态激光光散射技术[19],可以通过专利运算法得出粒子均方根位移(mean square displacement,MSD)与去相关时间的关系。测试温度25 ℃,测试时间1 h。
1.4 数据统计分析
实验结果以 ±s表示,采用SPSS 20软件对数据进行统计分析,利用Origin 8.0软件绘图。
2 结果与分析
2.1 奇亚籽皮多糖的纯度
由图1可以看出,紫外光谱显示在260 nm和280 nm波长处均无明显的吸收峰,因此可以判断奇亚籽皮多糖均没有核酸和蛋白质残留。

图1 奇亚籽皮多糖的紫外光谱扫描Fig. 1 Ultraviolet absorption spectrum of chia seed peel polysaccharide
2.2 奇亚籽皮多糖的红外光谱

图2 奇亚籽皮多糖的傅里叶红外光谱扫描Fig. 2 FTIR spectrum of chia seed peel polysaccharide
由图2可知,奇亚籽皮多糖在3 290.6 cm-1附近具有宽而强的吸收峰,这是由多糖分子中O—H伸缩振动引起的,表明多糖分子中存在大量的羟基;2 926.0 cm-1附近出现窄而弱的吸收峰是C—H伸缩振动峰;1 608.6 cm-1的宽带与吸收的水相关,表明奇亚籽皮多糖对水分子有很强的亲和力;1 419.6 cm-1处为C—H变角振动的特征峰[20];1 246.0 cm-1吸收峰的出现可能与酯基存在有关,表明多糖结构中可能会出现CH3COOR;在1 200~950 cm-1之间的峰可能是由2 种C—O键的伸缩振动引起的,这两种键其中一种是吡喃糖环上的醚键C—O—C键,另一种是与O—H相连的C—O键[21];在887.3 cm-1附近存在吸收峰,表明奇亚籽皮多糖的结构具有β-糖苷键。
2.3 奇亚籽皮多糖的平均分子质量

图3 奇亚籽皮多糖的凝胶色谱图Fig. 3 HPGPC chromatogram of chia seed peel polysaccharide
由图3可知,奇亚籽皮多糖HPGPC色谱峰分布较窄,对称性强,呈现单一峰形,说明奇亚籽皮多糖是由均一组分构成的。由表1可得,奇亚籽皮多糖的峰位分子质量(mp)为485 378 u,通过软件计算得其重均分子质量(mw)为452 354 u,数均分子质量(mn)为440 598 u,多分散指数(mw/mn)为1.027,指数接近于1,表明奇亚籽皮多糖的平均分子质量分布集中,纯度高。

表1 奇亚籽皮多糖的HPGPC测定结果Table 1 Results of HPGPC analysis of chia seed peel polysaccharide
2.4 奇亚籽皮多糖的表观黏度

图4 质量浓度对奇亚籽皮多糖表观黏度的影响Fig. 4 Apparent viscosity of chia seed peel polysaccharide at different concentrations
由图4可知,在相同的剪切速率下,奇亚籽皮多糖溶液的表观黏度随多糖质量浓度的增加而增大,这是由于多糖质量浓度的增加,加强了多糖链之间的相互作用,部分多糖分子相互联结,进而聚合程度增加,导致表观黏度的升高[22]。此外,不同质量浓度的表观黏度变化率不同,质量浓度10 mg/mL以下的溶液表观黏度增加幅度较小,质量浓度为10 mg/mL以上的溶液表观黏度增加幅度较大。在相同的质量浓度下,随着剪切速率的增加,奇亚籽皮多糖溶液的表观黏度逐渐减小,表现为非牛顿流体特性,即表观黏度随着剪切速率的增加而减小的剪切稀释流动特征[23]。
2.5 奇亚籽皮多糖的持水力、持油力

图5 质量浓度对奇亚籽皮多糖持水力、持油力的影响Fig. 5 WHC and OHC of chia seed peel polysaccharide at different concentrations
从图5可见,随着奇亚籽皮多糖质量浓度的升高,其持水力和持油力持续增大,分别从16.79%和4.89%增加到了25.39%和9.75%。奇亚籽皮多糖质量浓度由1 mg/mL上升至10 mg/mL时,多糖的持水力从16.79%显著提升至22.17%,持油力从4.89%显著上升至8.17%;当奇亚籽皮多糖质量浓度继续增加到15 mg/mL时,多糖的持水力和持油力并未显著提高,这与Timilsena等[8]报道结果相似。
2.6 乳状液粒度大小及分布结果
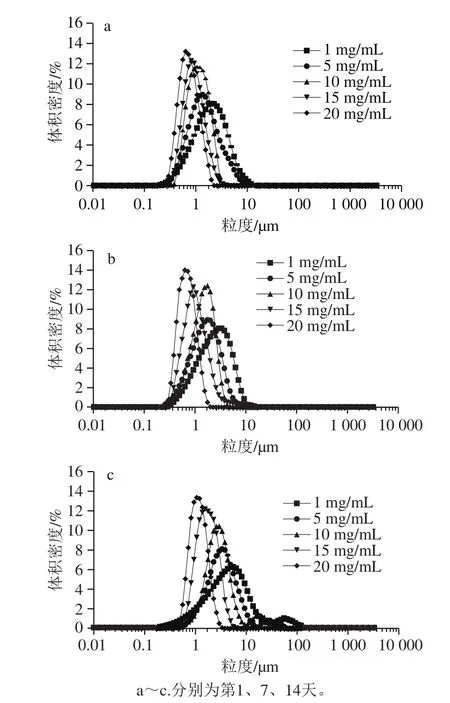
图6 质量浓度对奇亚籽皮多糖乳状液的体积粒度分布的影响Fig. 6 Volume size distribution of emulsions containing chia seed peel polysaccharide at different concentrations
从图6a看出,乳状液在制备后第1天进行测量,乳状液液滴平均粒度分布曲线均呈单峰分布。随着奇亚籽皮多糖质量浓度的增加,乳状液液滴平均粒度分布曲线的峰值明显向较小粒度方向移动,且粒度分布范围更窄,峰值更高。这与不同淀粉添加量的乳状液液滴平均粒度分布的结果一致[24],在较高多糖质量浓度下获得较小的液滴尺寸,这是因为更多的多糖分子可用于稳定更大的整体界面面积。由图6b看出,乳状液贮存第7天,乳状液液滴平均粒度分布曲线呈正态分布,粒度分布范围仍集中,但是偏向较大粒度方向移动。从图6c观察到,贮存第14天,奇亚籽皮多糖质量浓度为1、5、10 mg/mL时,乳状液液滴平均粒度分布曲线从单峰分布转变为双峰分布,乳状液可能出现油水分离,液滴粒度逐渐增大。奇亚籽皮多糖质量浓度为15、20 mg/mL时,乳状液液滴粒度无显著差异。
表2显示出随着奇亚籽皮多糖质量浓度的增加,多糖乳状液的D[4,3]显著降低,质量浓度为1 mg/mL的奇亚籽皮多糖乳状液显示出最大的液滴尺寸。主要是因为奇亚籽皮多糖在较低质量浓度时,多糖分子在乳化过程中的油-水界面分布不均匀而可能发生聚结现象,导致出现大液滴[25]。当奇亚籽皮多糖质量浓度增加到20 mg/mL时,乳状液变稠,液滴的碰撞减少,阻碍发生聚结现象,乳状液发生空间稳定化,从而产生更小的液滴尺寸[26]。相关研究表明,当乳状液液滴平均粒度尺寸较小时,液滴间不易发生聚结,乳化稳定性较好[27-28]。

表2 不同质量浓度的奇亚籽皮多糖乳状液的D[4,3]Table 2 D[4,3] of emulsions containing different concentrations of chia seed peel polysaccharide
2.7 乳状液稳定性分析
图7显示出了不同质量浓度的奇亚籽皮多糖乳状液在制备后的第0、1、7、14天内ΔBS相对于样品高度的变化曲线。由图7a可以看出,质量浓度1 mg/mL的奇亚籽皮多糖乳状液,在样品池底部(0~15 mm)的ΔBS随着时间的延长而逐渐减小,而顶部(30~45 mm)的ΔBS随着时间的延长而增大;当贮存时间延长至第7天时,乳状液底部和中部(15~30 mm)的ΔBS显著降低,顶部的ΔBS随着时间的延长而增大,这说明乳状液底部出现澄清现象,顶部出现上浮现象[29]。由图7b可以看出,奇亚籽皮多糖质量浓度为5 mg/mL时,乳状液的稳定性有所改善,样品池中部的ΔBS曲线未出现明显下降。由图7c~e可以看出,随着奇亚籽皮多糖质量浓度的不断增大,样品池底部和顶部的ΔBS变化幅度减小,逐渐趋于稳定。对于质量浓度为20 mg/mL的奇亚籽皮多糖乳状液,ΔBS曲线发生重叠现象,无明显的ΔBS增强区域,说明随着贮存时间的延长乳状液液滴大小没有显著变化。


图8 不同质量浓度的奇亚籽皮多糖乳状液的TSI值随时间的变化Fig. 8 Changes in TSI value of emulsions containing different concentrations of chia seed peel polysaccharide

图7 奇亚籽皮多糖乳状液在贮存期间ΔBS曲线的变化Fig. 7 Changes in ΔBS curve during storage of emulsions containing different concentrations of chia seed peel polysaccharide
由图8可知,乳状液的稳定性与奇亚籽皮多糖质量浓度有决定性关系。当奇亚籽皮多糖质量浓度为1 mg/mL时,乳状液状态极其不稳定,并且由于乳化和絮凝的作用,乳状液液滴不能被完全覆盖,TSI值表现出显著增加,稳定性降低;当奇亚籽皮多糖质量浓度为5 mg/mL时,TSI值升高的趋势较缓慢,稳定性增强;当奇亚籽皮多糖质量浓度高于10 mg/mL时,乳状液液滴间相互作用较弱,不会发生聚集沉淀的现象,TSI值几乎不变,处于低水平,表明乳状液的稳定性随奇亚籽皮多糖质量浓度的增加而增大,在相同的测量时间下,奇亚籽皮多糖质量浓度越高,乳状液的TSI值越低,乳状液体系越稳定。乳状液的不稳定性表现为乳状液分层,上层为乳析层,下层为乳清层。由表3可知,1 mg/mL的奇亚籽皮多糖显示出最高的CI值(92.42±0.25)%,CI值越高,乳状液液滴移动得越快,形成的絮状物越大,因此液滴发生更多的聚合现象;当多糖质量浓度大于10 mg/mL,CI值大幅降低,说明随着多糖质量浓度的升高,乳状液稳定性增强。乳状液在较高的多糖质量浓度下比较稳定的原因可能是奇亚籽皮多糖溶液中动态缠结网络结构的增加使其不会发生聚集[30]。
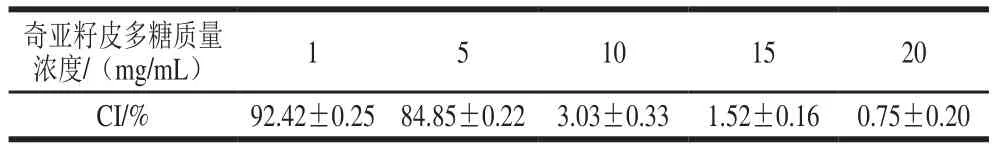
表3 不同质量浓度的奇亚籽皮多糖乳状液的CI值Table 3 CI value of emulsions containing different concentrations of chia seed peel polysaccharide
2.8 乳状液的表观黏度分析

图9 质量浓度对奇亚籽皮多糖乳状液表观黏度的影响Fig. 9 Apparent viscosity of emulsions containing different concentrations of chia seed peel polysaccharide
由图9可知,不同质量浓度的奇亚籽皮多糖乳状液的表观均黏度随着剪切速率的增加而降低,表现出典型的剪切稀化流动行为。在食品乳液中,剪切诱导的结构破坏会导致剪切稀化行为[31]。提高剪切速率会破坏沿流动方向的分子聚集和排列,导致乳状液液滴重排,表观黏度下降。乳状液在较高的奇亚籽皮多糖质量浓度下具有较大的表观黏度。大量研究表明,乳状液稳定性与流变特性密切相关[32]。乳状液表观黏度的增加可以减少乳状液液滴间的碰撞次数,表明奇亚籽皮多糖有助于增加连续相的黏度。
2.9 乳状液的微流变特性分析
据报道,光学法微流变学技术监测乳状液液滴布朗运动,与剪切流变学技术相比,不会引起乳状液结构的破坏,进而不会导致乳状液液滴以絮凝[33]。用MSD与去相关时间的关系曲线表征乳状液的布朗运动。如图10所示,随着奇亚籽皮多糖质量浓度的增加,乳状液MSD值明显下降,表明乳状液液滴的布朗运动受到限制。当多糖质量浓度大于15 mg/mL时,乳状液的MSD曲线接近,说明超过一定多糖质量浓度后,乳状液结构相对稳定[34]。20 mg/mL的奇亚籽皮多糖乳状液的MSD值最小,表明此质量浓度下乳状液液滴间的作用力最强,平台区与去相关时间轴所形成的面积最小,该乳状液的黏弹性最高[35]。
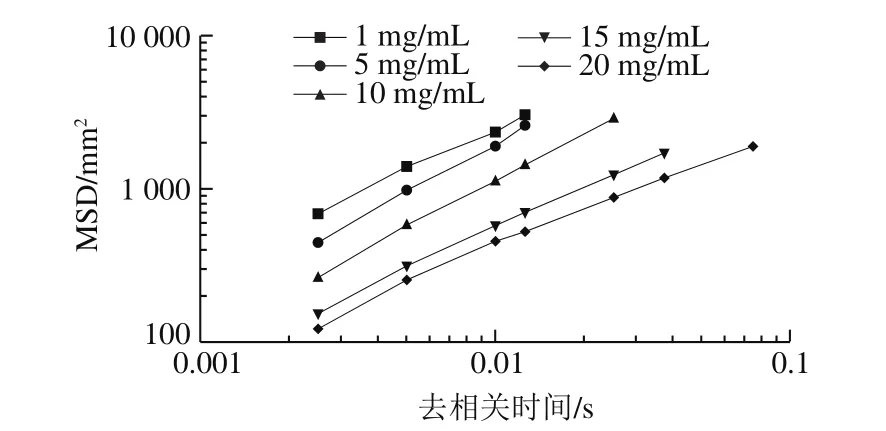
图10 不同质量浓度奇亚籽皮多糖乳状液的MSD值Fig. 10 MSD values of emulsions containing different concentrations of chia seed peel polysaccharide
固液平衡(solid-liquid balance,SLB)值代表样品固体性质和液体性质的比率。0<SLB<0.5,表明该体系中固体行为(凝胶行为)占主导作用;SLB=0.5,表明体系中液体行为和固体行为是同等的;SLB>0.5,表明体系中液体行为占据着主导地位[36]。由图11a可知,在25 ℃下,随着奇亚籽皮多糖质量浓度的增加,SLB值降低,但SLB值在0.5~1.1之间,因此该乳状液体系中的液体行为占据主导地位。乳化体系弹性因子(elasticity index,EI)是用来描述样品弹性特征的参数,可以给出样品弹性随时间的变化过程[37]。图11b表示不同质量浓度的奇亚籽皮多糖乳状液EI值随时间的变化曲线。随着奇亚籽皮多糖质量浓度的增加,乳状液的EI值越来越大,表明体系的弹性随多糖质量浓度的增加逐渐升高。宏观黏度因子(macroscopic viscosity index,MVI)与产品真实宏观黏度相对应,MVI值越低,在同样的去相关时间时,分散粒子移动的距离越小。MVI实际为乳液在零剪切速率下的黏度,是表征体系结构承受低剪切效应的能力,数值越大,说明体系的结构越强[38]。由图11c可知,随着奇亚籽皮多糖质量浓度的增加,乳状液的MVI值越来越大。

图11 不同质量浓度奇亚籽皮多糖乳状液的微流变曲线Fig. 11 Microrheological curves of emulsions containing different concentrations of chia seed peel polysaccharide
3 结 论
本研究采用热水浸提奇亚籽皮多糖,探究奇亚籽皮多糖的表观黏度、持水力及持油力,并对不同质量浓度的奇亚籽皮多糖乳状液的粒度分布、稳定性、表观黏度及微流变特性进行分析。结果表明,奇亚籽皮多糖溶液的表观黏度随着剪切速率的增加而增大,呈现剪切稀化的非牛顿流体行为;奇亚籽皮多糖的持水力和持油力分别为16.79%~25.39%、4.89%~9.75%。乳状液在贮存期间,较高质量浓度的奇亚籽皮多糖对乳状液的稳定性显著增强,ΔBS和CI值趋近于0,TSI曲线趋于平稳,MSD曲线表明,多糖质量浓度的升高使乳状液液滴间具有强作用力,形成稳定结构。奇亚籽皮多糖的存在减缓了乳状液液滴的扩散运动,进而改善了乳状液的乳化稳定性。本实验结果为奇亚籽皮多糖作为天然植物多糖乳化剂的开发和利用提供理论支持。
