基于DPPH、ABTS法的竹叶花椒抗氧化谱效关系研究
2020-05-29赵容张萌萌陈茜王丹袁星
赵容,张萌萌,陈茜,王丹,袁星*
(1.成都中医药大学,成都 611137;2.四川省中医药科学院,成都 610041)
竹叶花椒(ZanthoxylumarmatumDC.)系芸香科(Rutaceae)花椒属(ZanthoxylumLinn.)植物,又名藤椒、野花椒、岩椒、蜀椒等[1],药食同源,主产于我国东南及西南各省区、陕西秦岭及甘肃东南部[2]。竹叶花椒果实呈翠绿色,且含油量高达14%~19%,其味芬芳、易挥发,具有清香浓郁、麻味绵长的口感[3],在食品中作为风味调节剂和防腐剂使用[4]。将竹叶花椒果实经加工可制成藤椒油,餐饮市场上流通的藤椒油有纯香型和浓香型两种味型,以幺麻子品牌为主要代表。藤椒油运用于食品制作可使食物具有藤椒特殊的清香麻风味,即藤椒味,有文献指出,根据川菜味型命名法则,在理论上应将藤椒味确立为新时代川菜常用基础味型之一。前期研究表明,竹叶花椒具有清除DPPH、ABTS等自由基的活性,然而其抗氧化的物质基础尚不明确。本文采用HPLC技术建立竹叶花椒指纹图谱,测定其抗氧化活性,通过皮尔逊相关分析法及逐步回归分析法考察指纹图谱特征峰与抗氧化活性作用的关联度,旨在为竹叶花椒食品的质量控制及新的应用方向的开发提供科学依据。
1 材料与仪器
1.1 材料与试剂
1,1-二苯基-2-三硝基苯肼(DPPH):上海华蓝化学科技有限公司;2,2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS):美仑生物技术有限公司;L-抗坏血酸(Vc):美国Sigma-Aldrich公司;过硫化钾、乙醇、甲醇(分析纯):成都市科龙化工试剂厂;甲醇(色谱纯)、乙腈(色谱纯):Sigma公司。
1.2 仪器与设备
Agilent 1260高效液相色谱仪 美国安捷伦公司;Autoscience AS 5150A超声波提取器 天津奥特赛恩斯仪器有限公司;TU-1901双光束紫外可见光光度计 北京普析通用仪器有限责任公司;Bio-Rad iMark酶标仪 伯乐生命医学产品(上海)有限公司。
10批竹叶花椒样品信息详情见表1。
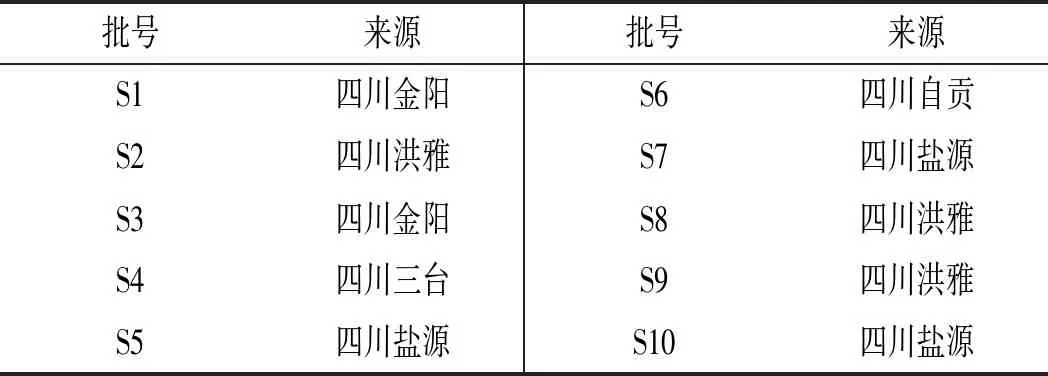
表1 10批不同产地竹叶花椒样品信息Table 1 Information of 10 batches of Zanthoxylum armatum DC. samples from different producing areas
2 HPLC指纹图谱建立[5]
2.1 色谱条件
Wondasil C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈(C)-0.1%甲酸水(D)梯度洗脱;流速1 mL/min;柱温30 ℃;检测波长328 nm;进样量10 μL。洗脱程序见表2。
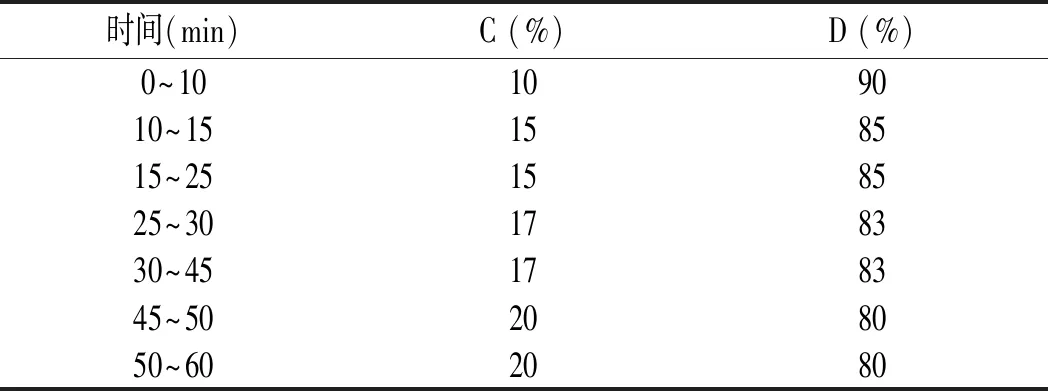
表2 流动相梯度洗脱程序Table 2 Gradient elution program of mobile phase
2.2 供试品溶液的制备
精密称定竹叶花椒粉末(过3号筛)0.5 g,置于20 mL的容量瓶中,加甲醇适量,超声处理使其溶解,取出,放冷,加甲醇至20 mL定容,摇匀。经0.22 μm的微孔滤膜过滤,即得。
2.3 精密度考察
称取竹叶花椒粉末(S1)约0.5 g,精密称定,按2.2项下方法制备供试品溶液,按2.1项下色谱条件连续进样6次,以4号峰为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果10个共有峰的相对保留时间和相对峰面积的RSD值均小于3%,表明仪器的精密度良好。
2.4 重复性考察
称取竹叶花椒粉末(S1)6份,每份约0.5 g,精密称定,按2.2项下方法制备供试品溶液,按2.1项下色谱条件进行测定分析,以4号峰为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果10个共有峰的相对保留时间和相对峰面积的RSD值均小于3%,表明方法的重复性良好。
2.5 稳定性考察
称取竹叶花椒粉末(S1)约0.5 g,精密称定,按2.2项下方法制备供试品溶液,按2.1项下色谱条件分别于0,0.5,1.0,2.0,4.0,8.0 h测定峰面积,以4号峰为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果10个共有峰的相对保留时间和相对峰面积的RSD值均小于3%,表明仪器稳定性良好,竹叶花椒供试品溶液在8 h稳定。
2.6 指纹图谱建立
称取10批竹叶花椒粉末各约0.5 g,精密称定,按2.2项下方法制备供试品溶液,按2.1项下色谱条件进样,记录各样品色谱图,得到10批竹叶花椒样品的指纹图谱,将其导入“中药色谱指纹图谱相似度评价系统”(2004A版),选取参照图谱,设定时间宽度,多点校正后进行分析,生成竹叶花椒共有模式对照指纹图谱。结果得到10批竹叶花椒样品的指纹图谱(见图1);再以表3中S3为参照图谱,时间宽度设定为0.10,共标定10个共有峰(见图2);各批次样品色谱图与对照指纹图谱相似度结果(见表3),由表3可知,10批竹叶花椒样品相似度较好,均大于0.90,表明各产地的花椒质量具有较高的一致性。
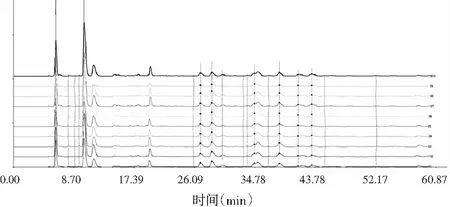
图1 10批竹叶花椒样品指纹图谱叠加图Fig.1 Overlay chart of HPLC fingerprint spectra of 10 batches of Zanthoxylum armatum DC. samples
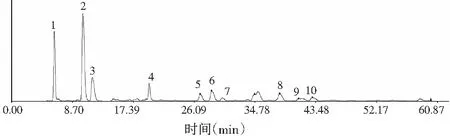
图2 竹叶花椒对照指纹图谱Fig.2 Reference fingerprint spectra of Zanthoxylum armatum DC.
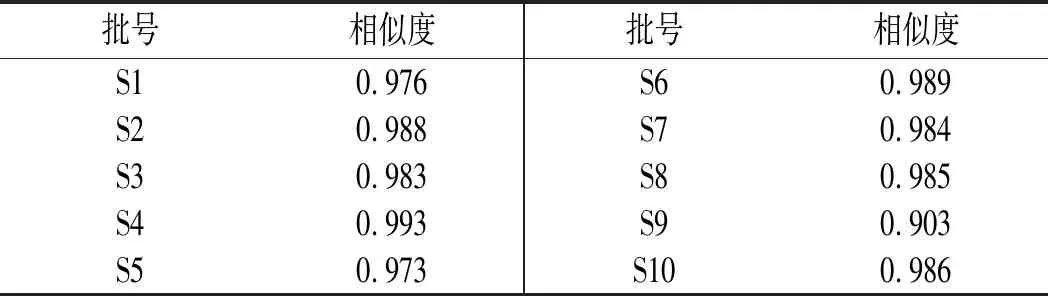
表3 10批竹叶花椒对照指纹图谱相似度Table 3 Similarity of HPLC fingerprint spectra of 10 batches of Zanthoxylum armatum DC.
2.7 聚类分析[6]
将10批竹叶花椒黄酮类成分指纹图谱的10个共有峰的峰面积相对于取样量量化后作为变量,本研究应用IBM SPSS Statistics 24软件,利用组间联接法,以Euclidean Distance为测量度对竹叶花椒样品进行聚类分析,见图3。
由图3可知,当类间距离为10时,10批竹叶花椒样品被分为3大类,S2、S4、S6~S8、S10聚为一类,S1、S3、S5聚为一类,S9单聚一类;当类间距离为5时,10批竹叶花椒样品被分为5大类,S2、S4、S6、S8即四川洪雅(两批)、自贡、三台聚为一类,S7、S10即四川盐源聚为一类,S1、S5即四川金阳、盐源聚为一类,S3、S9各自聚为一类。由此表明,不同产地的竹叶花椒样品各自聚类呈现产地相关性;四川洪雅、盐源、金阳虽然各自的竹叶花椒样品相似度都很高,但也被划分为不同类,说明同一产地的竹叶花椒既具有相似性也存在差异性。
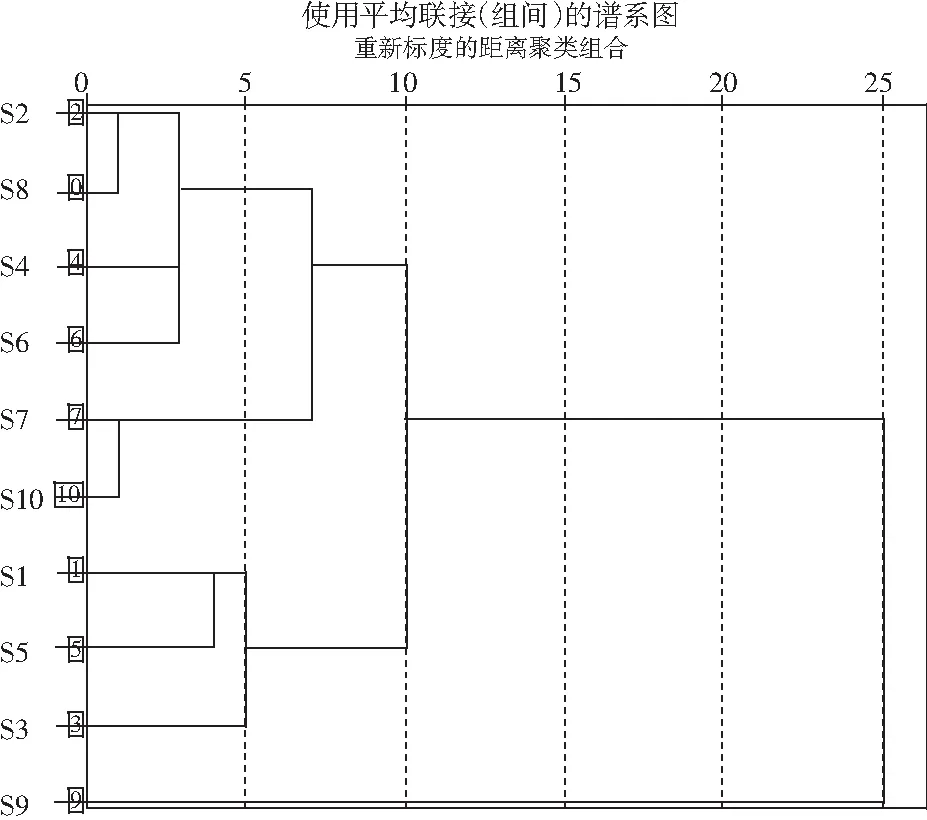
图3 10批竹叶花椒样品聚类分析树状图Fig.3 Cluster analysis dendrogram for 10 batches of Zanthoxylum armatum DC. samples
2.8 主成分分析
将10批竹叶花椒黄酮类成分指纹图谱的10个共有峰的峰面积相对于各样品总峰面积量化后作为变量,利用IBM SPSS Statistics 24软件对其进行去均值标准化处理后,再进行PCA分析,并以获取的主成分特征值及贡献率作为提取主成分的选择标准。
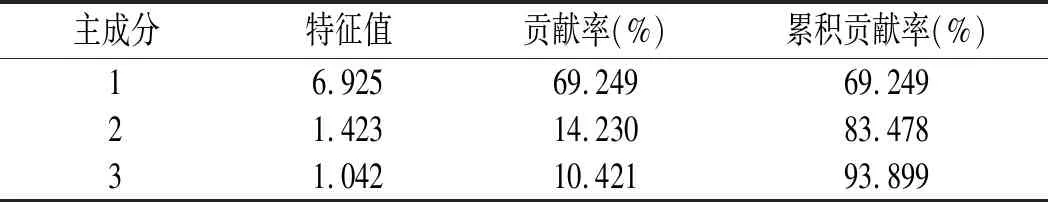
表4 主成分特征值及贡献率Table 4 Eigenvalues and contribution rates of principal components
由表4可知,提取的3个主成分特征值均大于1,累积贡献率为93.899%>85%,说明其可代表竹叶花椒HPLC指纹图谱中10个共有峰93.899%的信息,故通过提取3个主成分即可对10批竹叶花椒样品进行综合评价。
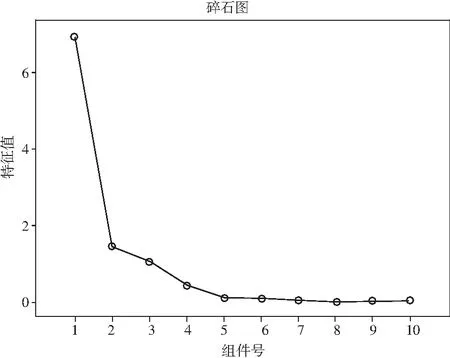
图4 碎石图Fig.4 Macadam figure
由图4可知,提取的3个主成分能够表征10个共有峰的绝大多数信息。结合载荷图(见图5)和旋转成分矩阵(见表5)分析:F2、F4~F6、F8、F10在主成分1上的载荷绝对值最大,F3、F9主要解释主成分2的信息,F1、F7在主成分3上的信息贡献量最大。
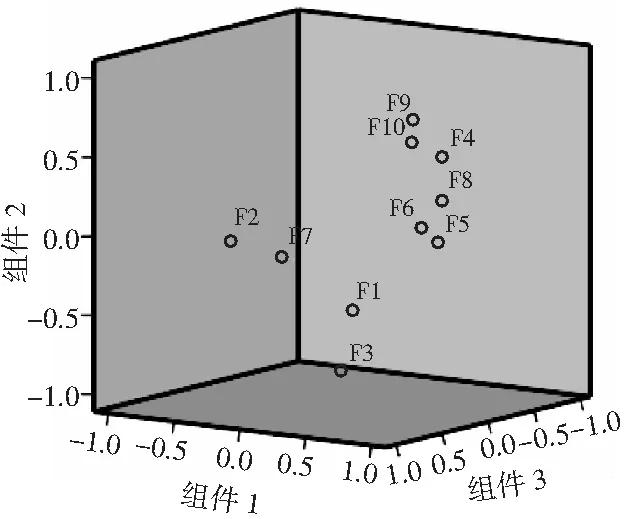
图5 载荷图Fig.5 Loading plot
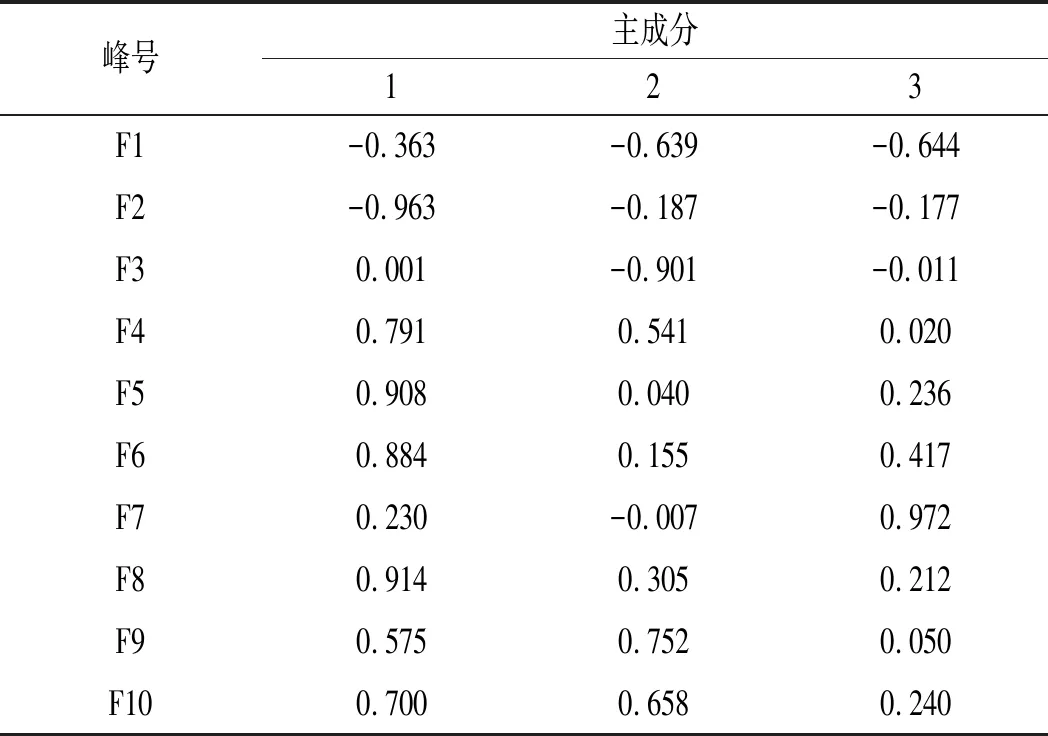
表5 因子负荷矩阵Table 5 Factor loading matrix
计算10批竹叶花椒样品的主成分得分,见表6。
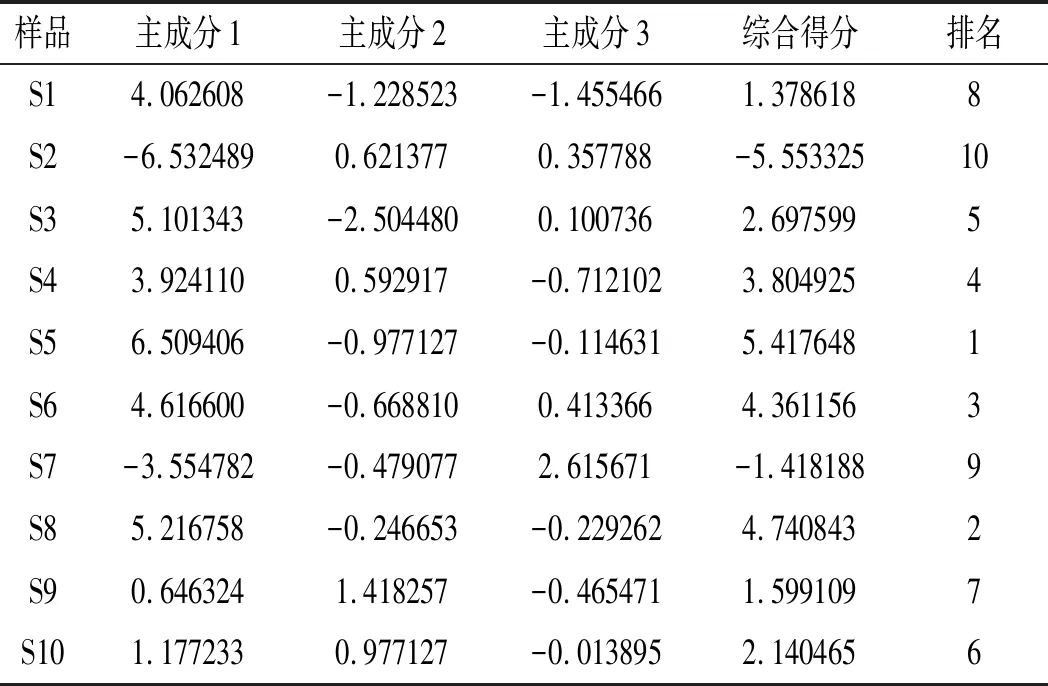
表6 主成分得分、综合得分排名Table 6 Ranking of principal component scores and comprehensive scores
由表6可知S4、S6、S8质量相似,S1、S9可聚为一类。PCA分析与Q型聚类分析结果具有相似性,同时存在差异性。
3 抗氧化活性测定
3.1 试液制备
3.1.1 供试品溶液制备
取10批竹叶花椒粉末(3号筛)各10 g,加入10倍量甲醇超声提取3次,每次1 h,合并3次滤液,蒸干。取竹叶花椒甲醇提取物5 mg,加10 mL 95%乙醇制成0.5 mg/mL的母液,再分别制成浓度为0.012,0.018,0.028,0.042,0.072,0.084,0.102 mg/mL的溶液。
3.1.2 Vc溶液制备
精密称取L-抗坏血酸(Vc)5.10 mg,置于10 mL容量瓶中,加95%乙醇溶解,定容,摇匀,即得Vc原溶液(浓度为0.510 mg/mL)。再分别制成浓度为0.00051,0.001275,0.00255,0.0051,0.006375,0.01275,0.025 mg/mL的Vc样品液。
3.1.3 DPPH溶液的配制
精密称取DPPH 4.06 mg,置于100 mL容量瓶中,加95%乙醇溶解,定容,摇匀,即得DPPH溶液(浓度为0.0406 mg/mL)。
3.1.4 ABTS+溶液的配制
参照文献[7]的方法,将ABTS配制成6.94 mmol/L水溶液, 将K2S2O8配制成2.6 mmol/L水溶液,在使用前将二者混合溶液置于阴凉处12~16 h,使两者发生完全充分的反应。然后用95%乙醇稀释原溶液,在波长734 nm处检测,直到最终测得的吸光度值在0.70±0.02之间,即完成ABTS+溶液的配制。
3.2 DPPH清除率计算
96孔板加入样品后置于阴暗处反应40 min后使用Bio-Rad iMark酶标仪测定吸光度A值,测定波长选择490 nm。DPPH清除率计算公式如下:
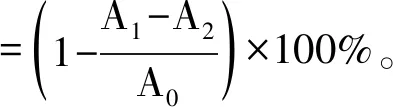
式中:A0表示100 μL DPPH溶液+100 μL 95%乙醇的吸光度值;A1表示100 μL DPPH溶液+100 μL供试品/Vc溶液的吸光度值;A2表示100 μL 95%乙醇+100 μL供试品/Vc溶液的吸光度值。
3.3 ABTS清除率计算
96孔板加入样品后置于阴暗处反应40 min后使用Bio-Rad iMark酶标仪测定吸光度A值,测定波长选择750 nm。ABTS清除率计算公式如下:
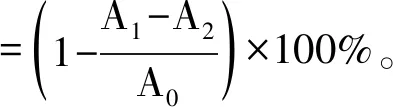
式中:A0表示25 μL 95%乙醇+175 μL ABTS+的吸光度值;A1表示25 μL样品+175 μL ABTS+的吸光度值;A2表示25 μL样品+175 μL 95%乙醇的吸光度值。
3.4 EC50值计算
应用SPSS 20软件进行Probit回归,预测出EC50值,结果见表7。
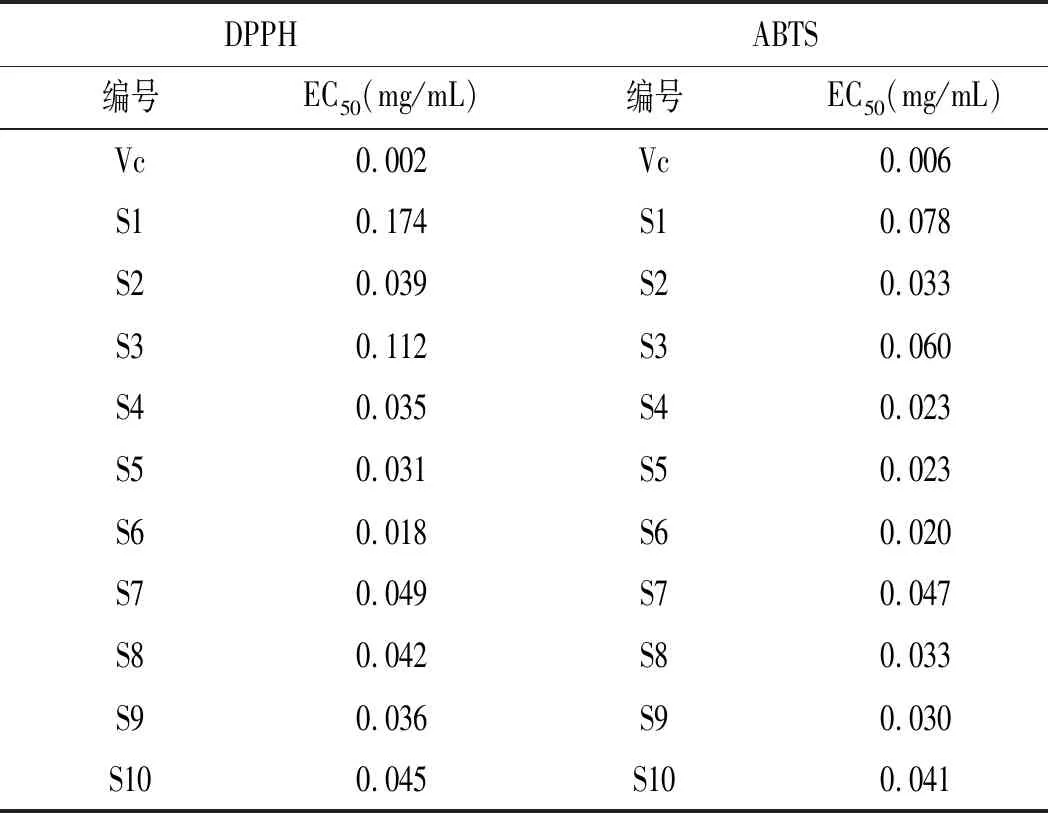
表7 DPPH/ABTS法测定的10批竹叶花椒的EC50值Table 7 EC50 of 10 batches of Zanthoxylum armatum DC. determined by DPPH/ABTS methods
由表7可知,竹叶花椒甲醇提取物具有一定的抗氧化能力,但比Vc弱。通过DPPH法测定,10批不同来源的竹叶花椒中,自由基清除能力大小为:Vc>S6>S5>S4>S9>S2>S8>S10>S7>S3>S1。通过ABTS法测定,10批不同来源的竹叶花椒中,自由基清除能力大小为:Vc>S6>S5=S4>S9>S2=S8>S10>S7>S3>S1。可见两种方法得出的自由基清除能力大小顺序一致,S6的抗氧化能力最强,S1的抗氧化能力最弱。
4 竹叶花椒抗氧化活性的谱效研究
4.1 皮尔逊相关分析[8]
应用SPSS 20.0统计学软件,对10个共有峰面积与10批竹叶花椒提取物的EC50进行双变量相关分析,有明显相关作用的特征指纹峰与抗氧化活性的相关系数测定结果见表8。
由表8可知,10个共有峰中5号峰与DPPH自由基清除活性呈极显著正相关(P≤0.001),与ABTS自由基清除活性呈极显著正相关(P≤0.001);8号峰与DPPH自由基清除活性略呈正相关(P≤0.05),与ABTS自由基清除活性呈显著正相关(P≤0.01);3号峰与DPPH自由基清除活性略呈负相关(P≤0.05)。综上,5号峰和8号峰与竹叶花椒抗氧化活性呈显著正相关,3号峰与竹叶花椒抗氧化活性略呈负相关。
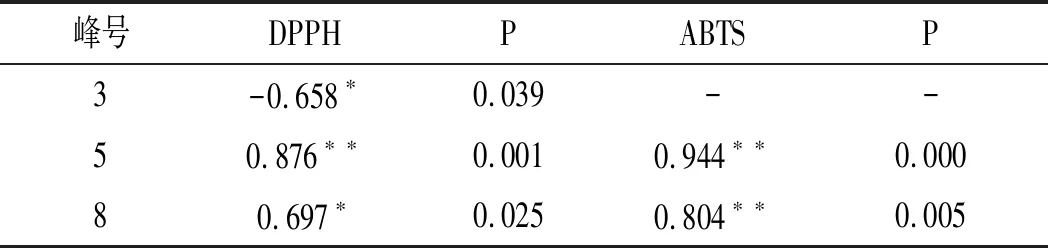
表8 特征指纹峰与抗氧化活性的相关系数测定结果Table 8 Determination results of correlation coefficients between characteristic fingerprint peaks and antioxidant activities
4.2 逐步回归分析[9]
应用SPSS 20.0统计学软件,以EC50为因变量,共有峰面积为自变量,对10个共有峰面积与10批竹叶花椒甲醇提取物的EC50进行逐步回归分析,得方差分析表和回归标准残差正态P-P图,见表9和图6。
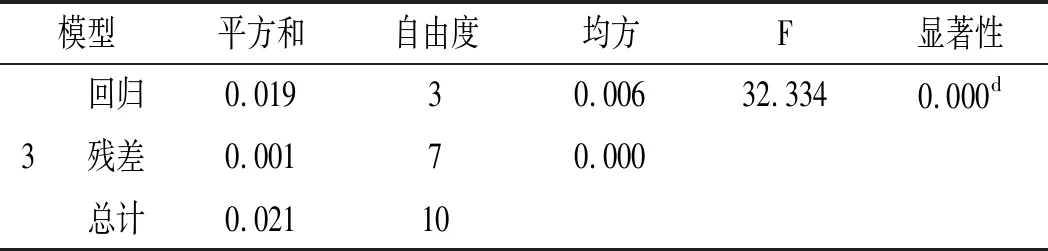
表9 方差分析表Table 9 Analysis of variance
注:d表示预测变量:(常量)、峰5、峰2、峰8。
图6 回归标准残差正态P-P图Fig.6 Regression standard residual normal P-P diagram
由表9和图6可知,自变量和因变量服从正态分布(P<0.01),证明特征指纹图谱峰与其抗氧化活性间存在显著线性关系,其回归系数分析表见表10。
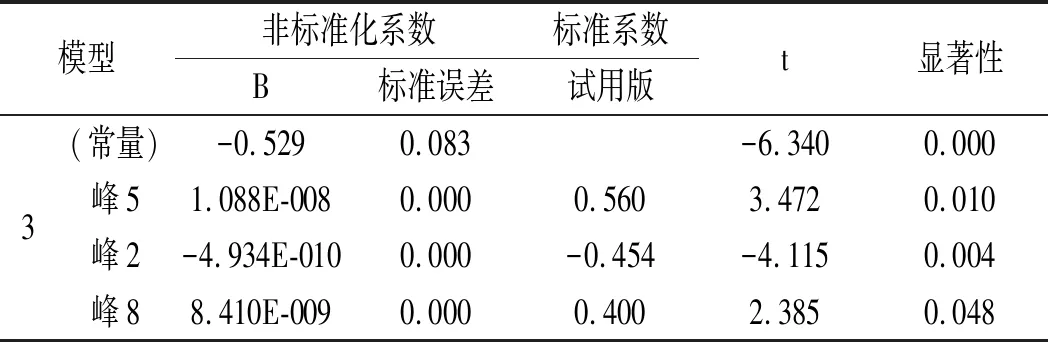
表10 回归系数分析表Table 10 Regression coefficients analysis table
注:a表示因变量:EC50。
第3个模型的R2值最大,为0.933,拟合优度最好,回归方程为:y=-0.529+1.088×10-8X5-4.934×10-10X2+8.410×10-9X8。
相关分析结果表明:5号峰与竹叶花椒抗氧化活性呈显著正相关(P≤0.01),8号峰与竹叶花椒抗氧化活性略呈正相关(P≤0.05),2号峰与竹叶花椒抗氧化活性呈显著负相关(P≤0.01)。
5 讨论
目前,藤椒种植业发展迅猛,以川渝地区为例,已逐渐形成了以四川洪雅、峨眉山、三台、金阳、平昌等为代表的全国闻名的藤椒基地,其中,洪雅被誉为“中国藤椒之乡”[10]。随着菜系和餐饮产业的发展,藤椒的清香麻风味近年来越来越受欢迎,其藤椒味作为独立的风味广泛使用,藤椒鸡、藤椒鱼等藤椒风味菜品深受食客喜爱。本研究通过建立竹叶花椒HPLC指纹图谱,可有效控制其食品质量,进一步为品质评价提供科学依据。以文中考察的方法建立了10批不同产地竹叶花椒黄酮类成分的HPLC指纹图谱,通过共有模式确定了10个共有峰,结合相似度评价和Q型聚类分析以及PCA分析可知,10批竹叶花椒的相似度大于0.90,共有峰相对保留时间符合程度较好,并且质量与产地具有一定相关性,但同一产地的竹叶花椒不完全聚在一起,说明同一产地的竹叶花椒既具有相似性也存在差异性。
本研究通过DPPH自由基清除法、ABTS自由基清除法对不同批次竹叶花椒的抗氧化活性进行分析,结果表明10批竹叶花椒均表现出明显的抗氧化活性,其中以四川自贡的竹叶花椒自由基清除能力最佳。藤椒在食品中也常作防腐剂使用,其抗氧化活性物质与防腐作用相关,表明竹叶花椒具备天然抗氧化剂的开发价值。结合竹叶花椒指纹图谱进行谱效关系研究,经皮尔逊相关分析与逐步回归分析,可以发现,5号峰、8号峰与竹叶花椒抗氧化活性呈正相关,2号峰、3号峰与竹叶花椒抗氧化活性呈负相关。后期可鉴定得到相关的活性化合物,考虑从单体层面提取天然防腐剂用于食品加工。此外,竹叶花椒抗氧化活性物质可应用于保健品、日化产品方面,拓宽竹叶花椒的应用方向和市场。
