QuEChERS萃取-UPLC-MS/MS测定花生酱中黄曲霉毒素B1方法的研究
2020-05-29梁剑锋李亚梁燕妮杨韶平
梁剑锋,李亚,梁燕妮,杨韶平
(梧州学院 化学工程与资源再利用学院,广西 梧州 543002)
黄曲霉毒素是黄曲霉和寄生曲霉等真菌毒素,在高温高湿环境下产生的一种次生代谢物[1,2]。目前发现有20种黄曲霉毒素及其衍生物 ,其中以黄曲霉毒素B1毒性最强[3],在1993年被国际癌症研究机构列为Ⅰ类致癌物,对广大人民群众的健康产生巨大危害[4]。花生是我国广泛种植的经济作物,以花生为原料加工的食品除了花生油外,还有调味品花生酱,由于其风味、香气独特而深受广大群众喜爱,但是花生在种植、运输、储存过程中容易受到黄曲霉和寄生曲霉污染,从而产生强致癌代谢物黄曲霉毒素B1[5]。所以,有必要开展花生酱中黄曲霉毒素B1的快速、准确、经济检测方法,以利于对其食品安全性进行有效控制。
目前,国内食品中的黄曲霉毒素B1常用的检测方法有:酶联免疫(ELISA)法、薄层色谱(TLC)法、气相色谱(GC)法、高效液相色谱(HPLC)法、液质联用仪法、免疫传感法[6-12]。这些检测方法是通过免疫亲和柱净化后,采用保留时间方法对黄曲霉毒素B1定性的,具有操作步骤繁琐、检测成本高、干扰物对结果影响大等缺点。QuEChERS是一种在蔬菜、粮食中农残检测的快速提取方法,可以有效去除提取液中蛋白、脂肪酸、磷脂、糖、色素等杂质,能够有效提高检测回收率[13]。将高效、经济、快速的QuEChERS前处理方法,与高灵敏性、高选择性的超高速液相色谱-质谱联用仪联合起来,建立适用于花生酱复杂基质样品中黄曲霉毒素B1的快速检测方法。
1 试验部分
1.1 仪器与材料
LC1290-QQQ6490超高速液相色谱-质谱联用仪(配电喷雾离子源 ) 美国安捷伦公司;XS105DU天平 瑞士梅特勒公司;ST16R高速冷冻离心机 美国热电公司;Multi Reax涡旋混合器 德国Heidolph公司;Million Q超纯水器 美国Millipore公司。
黄曲霉毒素B1标准品:浓度2.000 μg/mL,农业部环境保护科研检测所;甲酸:色谱纯,美国MREDA公司;乙腈、甲醇:色谱纯,德国MERCK公司;无水硫酸镁:分析纯,西陇科学股份有限公司;乙二胺-N-丙基硅烷吸附剂:PSA,上海安谱科学仪器有限公司;HC-C18填料:40~63 μm,上海安谱科学仪器有限公司;花生酱:市购。
1.2 样品前处理
称取5.0000 g搅拌均匀的花生酱置于50 mL聚乙烯离心管中,加入20.00 mL 1%甲酸-乙腈溶液摇匀,将离心管置于涡旋混合器上混合5 min,然后在冷冻离心机中5 min(转速4000 r/min,温度4 ℃),取出后放置至室温,准确吸取1.00 mL离心上清液,置于2.0 mL离心管中(预装有无水硫酸镁、HC-C18、PSA净化试剂),将离心管置于涡旋混合器上混合5 min后,在4 ℃下以15000 r/min冷冻离心8 min,取上清液过0.22 μm滤膜(初滤液弃去),将滤液置于液相进样瓶中,供上机测定。
1.3 标准溶液配制
黄曲霉毒素B1标准储备液:吸取黄曲霉毒素B1标准品0.50 mL到10.00 mL棕色容量瓶中,用乙腈定容至刻度,配制成100.0 ng/mL的标准储备液,密封存储于-20 ℃冰箱中(不超过1个月)。
黄曲霉毒素B1标准曲线:分别吸取100,200,300,400,500 μL黄曲霉毒素B1标准储备液到10.00 mL棕色容量瓶中,乙腈定容至刻度,分别得到浓度为1.00,2.00,3.00,4.00,5.00 ng/mL溶液。
1.4 色谱条件
流动相:A相0.1%甲酸溶液,B相乙腈,流动相梯度洗脱程序见表1;色谱柱:C18超高惰性硅胶柱(75 mm×2.1 mm×2.5 μm,ACE UltraCore C18);柱温:35 ℃;流速:0.35 mL/min;进样量:1 μL。

表1 流动相梯度洗脱程序Table 1 Mobile phase gradient elution procedure
1.5 质谱条件
离子源:ESI+;检测模式:多反应监测(MRM);雾化器压力:40 psi;毛细管电压:3500 V;干燥气温度:350 ℃;干燥气流速:9 L/min;监测离子对和其他参数见表2。

表2 质谱仪检测参数Table 2 Detection parameters of mass spectrometer
2 结果与分析
2.1 提取溶剂的选择
花生酱的主要配料是花生仁、白砂糖、氢化油脂、食用盐等,样品中对检测有影响的成分主要是高油(样品中脂肪含量在40%~50%之间)、胶溶性杂质(主要是磷脂、蛋白、糖、食盐成分)、脂溶性杂质(主要是游离脂肪酸、色素)等,因此选择合适的提取溶液,可以降低基体带来的干扰,提高试验的回收率,综合考虑样品基体的特点和分析目标物特性后,试验考察甲醇、酸化甲醇(1%甲酸)、乙腈、酸化乙腈(1%甲酸)、甲醇-乙腈(80∶20,V/V)等不同提取溶剂对试验回收率的影响,试验结果见图1。
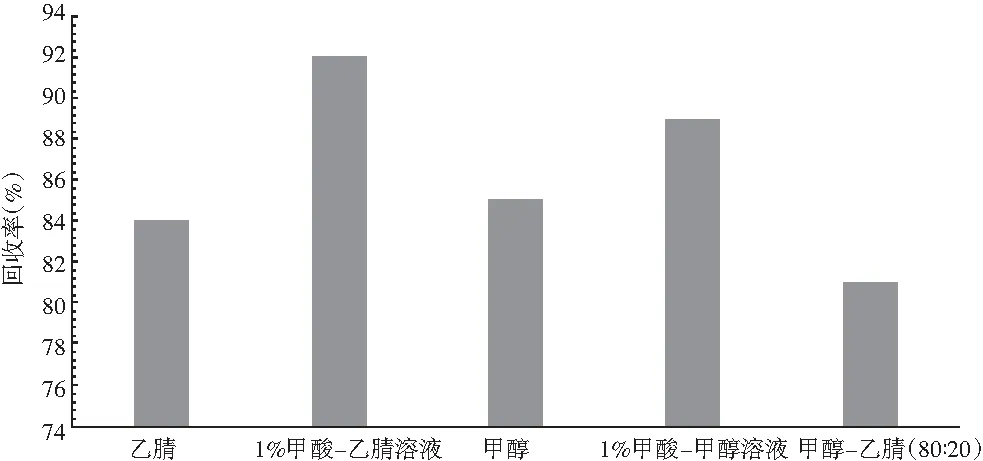
图1 不同提取溶液对花生酱样品回收率的影响Fig.1 Effect of different extracting solutions on the recovery rate of peanut butter samples
由图1可知,花生酱样品采用1%甲酸-乙腈溶液提取回收率最好。可能是由于花生酱样品含有大量脂肪,根据“相似相溶”的原理,乙腈能够高效提取脂肪中黄曲霉毒素B1,同时1%甲酸-乙腈中甲酸能够使花生酱中大量磷脂、蛋白等胶体干扰物质在提取过程中通过形成絮凝沉淀物离心去除,减少这些物质对目标分析物的吸附,从而达到进一步提高试验回收率的作用。
2.2 净化盐包配比确定
2.2.1 盐析剂无水硫酸镁使用量
由于花生酱样品在经过1%甲酸-乙腈溶液提取离心后,其上清液中还存在着大量共萃杂质,还会影响对目标分析,所以需要进一步采用盐析的方法去除杂质。本试验通过在净化盐包中添加无水硫酸镁,去除提取液中水溶性杂质,考察无水硫酸镁不同添加量对目标分析物回收率的影响,其结果见图2。
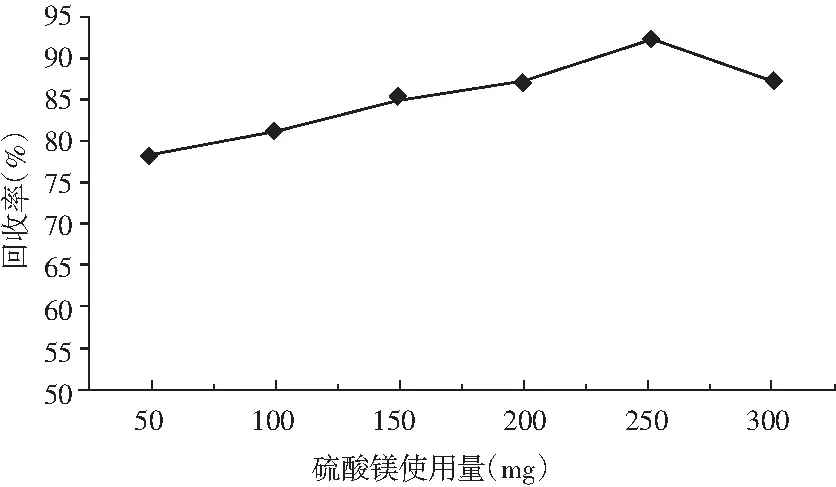
图2 盐析剂无水硫酸镁使用量对回收率的影响Fig.2 Effect of the usage amount of salting-out agent anhydrous magnesium sulfate on recovery rate
由图2可知,随着无水硫酸镁使用量增加,目标分析物黄曲霉毒素B1回收率也在增加,但在无水硫酸镁使用量达到250 mg后,目标物回收率出现了下降,此现象原因分析:由于无水硫酸镁有强结合水的能力,其可以大量吸附提取液中水溶性杂质,同时可以饱和水溶液而使提取液分层,从而提高试验萃取效率,但是大量无水硫酸镁使用后,提取液中无水硫酸镁会出现结块现象,从而导致其与提取液接触的面积减少,同时其吸水过程中产生大量热量使提取液局部迅速升温,从而导致目标分析物的回收率下降,所以净化包中采用250 mg无水硫酸镁比较合适。
2.2.2 净化剂配方考核

图3 净化剂HC-C18使用量对黄曲霉毒素B1回收率的影响Fig.3 Effect of the usage amount of HC-C18 on recovery rate of aflatoxin B1

图4 净化剂PSA使用量对黄曲霉毒素B1回收率的影响Fig.4 Effect of the usage amount of PSA on recovery rate of aflatoxin B1
提取液中除了水溶性杂质外,还有一定量的磷脂、蛋白等非极性杂质,和糖类、脂肪酸等极性杂质影响分析结果,所以净化包中通过采用一定量的HC-C18、PSA净化物质,分别除去提取液中非极性、极性杂质,从而进一步提高试验方法的回收率。本试验考察HC-C18、PSA不同的添加量对花生酱基质提取液的净化效果,以黄曲霉毒素B1回收率为考核的指标,结果见图3和图4。
由图3和图4可知,花生酱样品采用100 mg HC-C18、50 mg PSA净化配方,试验目标分析物黄曲霉毒素B1回收率最高。
2.3 色谱/质谱条件的优化
试验考察纯水、0.1%甲酸溶液分别与乙腈、甲醇组成的流动相,对花生酱样品目标分析物黄曲霉毒素B1保留时间与峰形的影响。
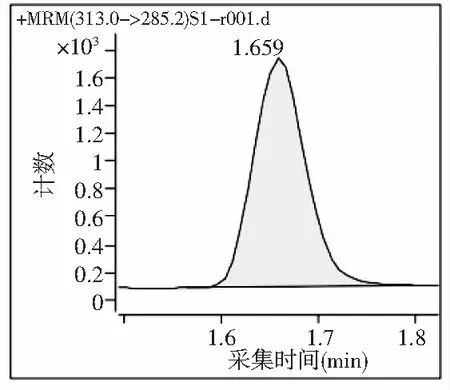
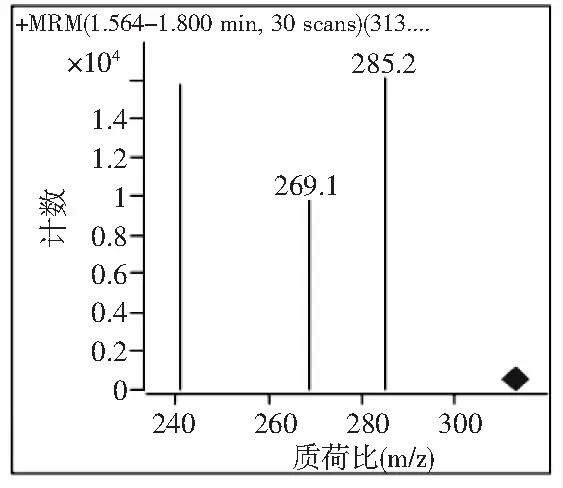
图5 黄曲霉毒素B1标准溶液的MRM质谱图Fig.5 MRM mass spectrogram of aflatoxin B1 standard solution
试验结果表明:流动相采用乙腈洗脱效果明显比甲醇好,同时在ESI+模式时,流动相加入0.1%甲酸溶液时,更容易诱导黄曲霉毒素B1产生[M+H]+,所以试验采用0.1%甲酸-乙腈溶液为色谱的流动相。黄曲霉毒素B1标准溶液的MRM质谱图见图5。
3 试验方法评价
3.1 方法线性考察
以黄曲霉毒素B1标准溶液浓度为横坐标(X),标准溶液响应值为纵坐标(Y)绘制标准曲线,结果表明黄曲霉毒素B1在1.00~5.00 ng/mL的质量浓度范围内具有良好的线性关系,线性回归方程Y=2110.2X+467.9,拟合度r2为0.9993。
3.2 方法检出限
准确称取样品5.00 g(精确到0.0001 g),加入150 μL的浓度为1.00 ng/mL的黄曲霉毒素B1标准溶液。按照1.2的前处理方法处理提取样品,S/N=16.2,图谱见图6。
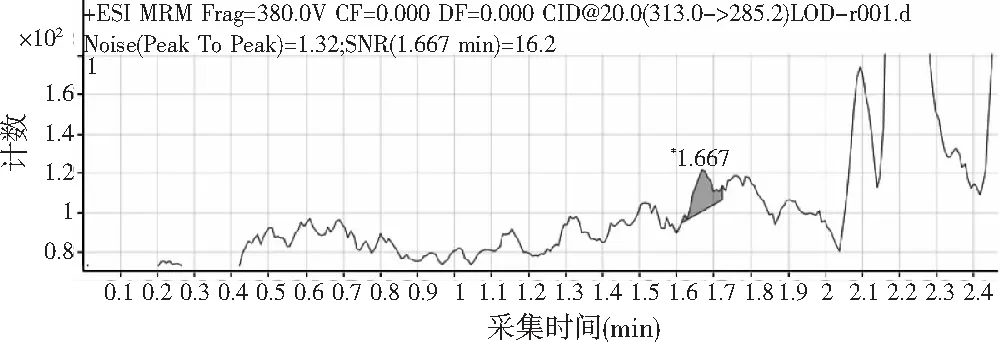
图6 方法的检出限色谱图Fig.6 Detection limit chromatogram of the method
由于检出限为各化合物的3倍信噪比即S/N=3就被定为最低检出限(LOD)。测得数据显示,检出限目标分析物黄曲霉毒素B1信噪比S/N>3,可以确定方法的检出限在0.03 μg/kg。
3.3 方法的回收率及精密度
在空白的花生酱样品中,分别添加0.50,1.00,5.00,10.0 μg/kg 4个不同水平的黄曲霉毒素B1标准溶液,每个水平测定6次,按照1.2的前处理方法处理样品,结果见表3。
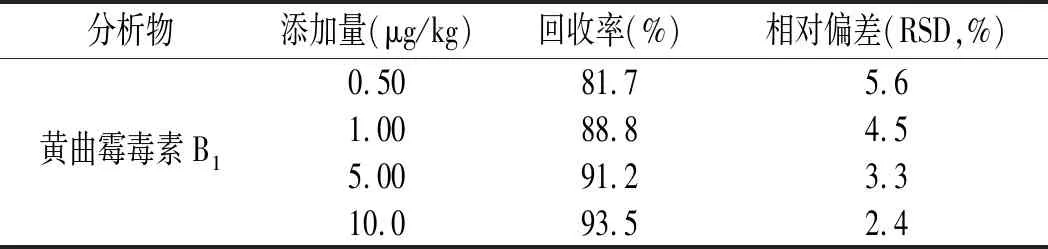
表3 试验方法的回收率与相对标准偏差(n=6)Table 3 Recovery rates and relative standard deviations of test methods (n=6)
由表3可知,本试验方法的回收率在81.7%~93.5%范围内,相对标准偏差(RSD)为2.4%~5.6%。表明该方法适用于样品花生酱中黄曲霉毒素B1分析,试验方法具有良好的回收率与精密度,符合GB/T 27404-2008《实验室质量控制规范 食品理化检测》中回收率和精密度的要求[14]。
3.4 实际样品检测
称取市场上购买的3款花生酱(编号T1、T2、T3),采用1.2的前处理方法处理,同时采用食品中黄曲霉毒素B1检测国家标准GB 5009.22-2016第一法(液质)、第二法(柱前衍生)、第三法(柱后光化学衍生)进行检测[15],不同方法检测结果见表4。
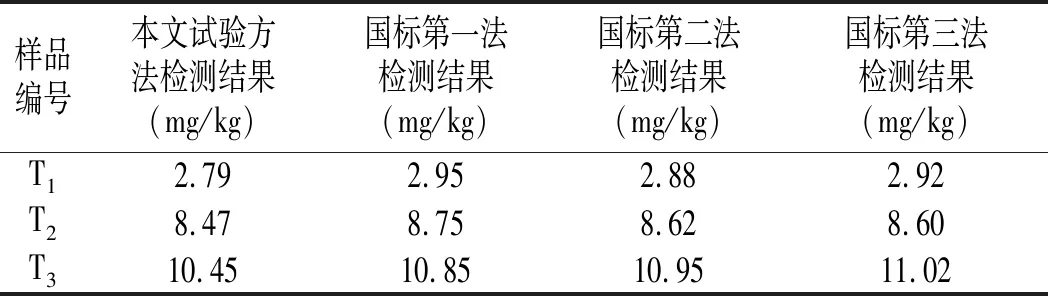
表4 本试验方法与国标检测方法检测结果的比较Table 4 Comparison of testing results between this method and international standard testing methods
由表4可知,本文的试验方法检测结果与国标3种方法结果相比相对偏低,但是相对偏差都在5%以下,符合国标GB 5009.22-2016中方法精密度小于20%的要求。本试验方法与目前的国标方法相比:在经济成本上,由于前处理无需价格昂贵的免疫亲和柱净化,减少了检测成本;在检验效率上,QuEChERS前处理过程简单、快捷,易于大批量的花生酱样品检测,具有极高的检测效率。
4 结论
本文建立了QuEChERS萃取-液质联用仪快速检测花生酱中黄曲霉毒素B1的方法,试验采用250 mg无水硫酸镁、100 mg HC-C18、50 mg PSA净化提取包配方后进入液质联用仪检测,方法回收率在81.7%~93.5%范围内,相对标准偏差(RSD)为2.4%~5.6%,检出限为0.03 μg/kg。该方法具有方便、快捷、经济、准确、回收率高等特点,适用于花生酱等容易受到黄曲霉毒素污染的样品检测与质量控制。
