miR-205-5p/PRKCA/p38信号通路在淫羊藿苷抑制动脉粥样硬化中的介导作用
2020-05-29徐瑞黄鹏张祎冰任立群
徐瑞 黄鹏 张祎冰,3 任立群
(吉林大学 1白求恩医学部,吉林 长春 130021;2药学院实验药理与毒理学教研室;3第一医院眼科)
动脉粥样硬化(AS)特征为主动脉中脂质和纤维成分的积累,这是心血管疾病发展的病理基础〔1,2〕。内皮细胞(ECs)功能障碍导致胆固醇和其他脂质在血管壁中沉积,这是AS发展的初始阶段〔3〕。ECs损伤还会导致促炎因子的内膜侵入及血管平滑肌细胞(VSMCs)增殖异常。AS病变的主要原因之一就是VSMCs的异常增殖和迁移〔4,5〕,因此,VSMCs的增殖和迁移在AS斑块的形成和发展中起着至关重要的作用。MicroRNA(miRNA)是一类小的非编码RNA,由18~23个核苷酸组成,可通过与靶mRNA的3′-非翻译区(UTR)结合来调节基因表达〔6〕。miRNA已被确定参与包括细胞分化、增殖、迁移和凋亡等多种生物学相关过程〔7~9〕。淫羊藿苷(ICA)是中药淫羊藿(Epimedium)的主要药效成分之一。近年来淫羊藿已被证实具有心血管系统保护作用,为AS的防治提供了新的选择〔10〕。迄今为止,miR-205-5p与AS的关系尚未见报道。本研究通过整体动物实验及体外细胞实验对miRNA及其通路介导的ICA抗AS作用进行探索,以期揭示miRNA在ICA治疗AS中的作用及其可能机制。
1 材料与方法
1.1整体动物实验
1.1.1动物分组及处理 动物实验得到吉林大学药学院实验动物伦理委员会的批准(许可号:2016-0304),C57BL/6J背景的载脂蛋白(Apo)E-/-小鼠(8周龄,雄性)购自中国医学科学院实验动物研究所,被安置在吉林大学药学院再生医学研究所。在温度(22±2)℃的环境下,将所有小鼠分组饲养在12 h/12 h的明暗循环中,自由获取食物和水。适应性饲养1 w后,将80只ApoE-/-小鼠随机分为:①正常对照(CON)组:普通饮食+等体积羧甲基纤维素钠(CMC-Na)灌胃;②模型对照(MOD)组:高脂饮食(HFD)+等体积CMC-Na灌胃;③阳性药辛伐他汀(SIM)组:高脂饮食+辛伐他汀(5 mg/kg)灌胃;④ICA低剂量(ICA-L)组:高脂饮食+ICA(20 mg/kg)灌胃;⑤ICA高剂量(ICA-H)组:高脂饮食+ICA(40 mg/kg)灌胃。每组均为16只,药物溶于CMC-Na中,给药体积为0.1 ml/10 g,每日灌胃1次。通过给小鼠喂食HFD来诱导加速发生AS,该饮食包含20%的脂肪和1.25%的胆固醇(D12108C,Research Diets Inc)。每天早晨9∶00灌胃,每组连续灌胃12 w,MOD组和ICA组分别接受0.2 ml ICA,CON组给予等体积CMC-Na灌胃。ICA购自维克奇生物科技有限公司(中国四川)。待12 w实验结束后,每组随机取10只小鼠,行眼眶内眦静脉丛取血,室温放置至上清液析出,离心取上层血清,-80℃保存备用。再于冰上将小鼠主动脉从根部至腹主动脉肾动脉分支处离断取出,固定于4%多聚甲醛,以备石蜡包埋切片备用。每组余下6只小鼠同上法取主动脉立即置于液氮中保存,以备分子生物学检测之用。
1.1.2血清学检查 取小鼠血清进行血脂水平检测,采用胆固醇氧化酶-过氧化物酶耦联法检测血清中总胆固醇(TC)水平,采用磷酸甘油氧化酶-过氧化物酶耦联法检测三酰甘油(TG)水平,采用直接法(表面活性剂消除法)检测血清低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平,采用氧化低密度脂蛋白(ox-LDL)检测试剂盒检测血清ox-LDL〔11〕。试剂盒均购自南京建成生物工程研究所。
1.1.3小鼠胸主动脉组织HE染色 将小鼠胸主动脉组织固定,制备成石蜡切片后,二甲苯脱蜡、梯度乙醇水化,HE染色,以中性树脂封片,使用光学显微镜拍照。
1.1.4基因芯片检测及生物信息学分析 将MOD组和ICA-H组主动脉组织送检基因芯片分析(课题组前期工作基础)〔11〕。将ICA-H组MOD组之间差异表达(DE)的mRNA进行基因本体论(GO)和京都基因与基因组百科全书(KEGG)途径分析。通过构建全基因信号转导网络以证明基因之间的相互作用。使用Cytoscape软件将网络表示为图形,每个基因对应一个节点,节点之间通过一条边连接。程度定义为从一个节点到其他节点的链接数,程度更高的基因在信号网络中占据更重要的位置。同样地,基因的特征也由中介中心性来描述,中介中心性可以评估基因在网络中的中心性。基因相互作用可以根据统计数据得出。
根据mRNA和miRNA中特异性表达的标准化信号强度,建立了miRNA-mRNA共表达网络以鉴定miRNA与mRNA之间的相关性,使用Cytoscape软件绘制共表达网络。
1.1.5定量聚合酶链反应(qPCR)验证相关基因的表达 根据基因表达谱分析确定miRNA及其靶mRNA。并在CON组、MOD组及ICA两个剂量组胸主动脉组织所选取的miRNA及其靶基因mRNA表达情况进行qPCR验证。使用TRIzol试剂从小鼠胸主动脉组织中提取总RNA,使用逆转录试剂盒将提取的总RNA逆转录为cDNA。逆转录反应操作如下:25℃持续5 min,42℃持续60 min,80℃持续2 min。PCR引物设计参见前期实验〔12〕,按SYBR GREEN qPCR Super Mix试剂盒配制反应体系(1∶20稀释cDNA)5.0 μl,上游引物0.5 μl,下游引物0.5 μl,2×SYBR Green qPCR SuperMix 10 μl,dd H2O 20 μl),反应条件为50℃(2 min),95℃(2 min),95℃(15 s),60℃(32 s),40个循环收集荧光信号,进行溶解曲线分析。GAPDH为内部参照,2-ΔΔCt法用于量化每个基因的相对表达,所有实验一式三份进行,并重复3次。
1.1.6Western印迹验证相关蛋白表达 将小鼠胸主动脉组织匀浆悬浮在放射免疫沉淀(RIPA)裂解缓冲液中30 min,离心(10 000 r/min,10 min)后,使用二喹啉甲酸(BCA)蛋白分析试剂盒(南京凯基生物发展有限公司)定量上清液的蛋白质浓度,然后将蛋白质样品在95℃下孵育10 min。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离变性的蛋白质(20 μg/组),并电泳转移到聚偏二氟乙烯(PVDF)膜上。随后,将膜摇动并用溶于TBS-T的5%牛血清白蛋白(BSA)在室温下封闭2 h,然后在4℃下的一抗中孵育过夜。用0.1%TBS-T清洗膜后,将膜用辣根过氧化物酶(HRP)标记的二级多克隆抗体在室温下处理2 h。用增强的化学发光试剂盒(Thermo Fisher 公司)检测条带。ImageJ软件分析相对谱带强度。
1.2体外细胞实验
1.2.1小鼠VSMCs培养及传代 小鼠VSMCs于中科院上海细胞库购买。细胞培养:将装有DMEM高糖培养基、青霉素链霉素及胎牛血清混合液的培养瓶放入37℃含5%CO2培养箱中预热10 min;解冻细胞,制备悬液,离心,将细胞悬液分装入培养皿内,置于上述培养箱内培养,镜下观察细胞形态密度。细胞传代:VSMCs贴壁生长状态良好、细胞密度约为80%时,弃瓶中培养液,磷酸盐缓冲液(PBS)冲洗,加胰蛋白酶消化,加入含血清培养基终止胰酶作用;吸管吹打至单个细胞悬液后,补足培养基,按稀释比例转移至新培养瓶中,于上述培养箱内培养〔12〕。
1.2.2四氮唑盐(MTT)法确定ox-LDL诱导VSMCs增殖的最佳浓度 将生长良好的VSMCs以低血清培养基饥饿12 h后,使用正常血清培养基重悬细胞,以1×104个/孔的细胞密度接种到96孔板,每孔100 μl,待细胞贴壁后分别给予10、25、50、100、200 μg/ml的ox-LDL干预,同时设空白对照组(CON组),给予等量的无血清培养基。收集各个时间点的细胞(培养0 h,24 h,48 h,72 h,96 h)加入MTT溶液,每孔分别加入20 μl MTT溶液(5 mg/ml),继续培养4 h,弃上清,加入二甲基亚砜(DMSO),低速振荡,分别于溶解后的24 h、48 h、72 h时置于酶标仪检测490 nm处各孔吸光度值(OD)。
1.2.3细胞分组及给药 实验分组及处理如下:①正常对照(CON)组,②模型(MOD组,25 μg/ml ox-LDL),③ICA 10 μmol/L组(25 μg/ml ox-LDL),④ICA 20 μmol/L组(25 μg/ml ox-LDL),⑤ICA 40 μmol/L 组(25 μg/ml ox-LDL)。
1.2.4MTT法检测ICA对ox-LDL诱导VSMCs增殖的作用 将生长良好的VSMCs以低血清培养基饥饿12h后,用正常血清培养基重悬细胞并接种到96孔板,待细胞贴壁后,根据前期实验基础〔12〕,实验分组见1.2.3,各给药组分别给予相应浓度的ICA干预,CON组和MOD组给予等量的无血清培养基。0.5 h后,MOD组及各给药组给予ox-LDL至终浓度为25 μg/ml,CON组给予等量的无血清培养基,培养24 h,收集各组细胞加入MTT溶液。MTT实验方法见1.2.2。
1.2.5划痕实验检测ICA对ox-LDL诱导VSMCs迁移的影响 实验分组参见1.2.3,实验方法:将生长良好的VSMCs以无血清培养基重悬,计数并调整细胞浓度为1×105个/ml,在6孔板背面每隔1 cm画上一条直线,每个孔加入100 μl,即每孔细胞为1×104个细胞,待细胞铺满后,用200 μl枪头垂直于线制造细胞划痕,吸掉旧培养基,用无菌PBS冲洗细胞3次,再加入无血清培养基,各实验组按实验方法加入相应药物。将6孔培养板置于37℃ 5%CO2培养箱培养。选择24和48 h拍照,使用ImageJ进行图像数据分析。
1.2.6qPCR检测相关基因表达情况 细胞实验分组及处理参照1.2.3。细胞复苏1 w后将生长良好、处于对数生长期的VSMCs,以1×104个/孔的细胞密度接种于6孔培养板,培养24 h。实验结束后以PBS清洗细胞,将VSMCs刮下并收集,总RNA提取及逆转录,进行qPCR,方法参见1.1.5。为保证实验准确性,每次实验做3个复孔,并重复实验3次。
1.2.7Western印迹检测相关蛋白表达 蛋白样品定量试剂见表1。细胞实验分组及处理参见1.2.3。方法如下:(1)总蛋白提取:按1 ml裂解液加10 μl苯甲基磺酰氟(PMSF)(100 mmol/L)和10 μl混合物〔乙二胺四乙酸(EDTA),100×二甲基亚砜(DMSO)储液〕,摇匀置于冰上,收集各实验组细胞,将裂解液加入细胞中,在冰上吹打混匀裂解30 min,4℃条件下离心10 min,取上清并进行蛋白定量。(2)蛋白样品定量:①标准曲线的绘制:准备96孔板,按照下表加入试剂;配制BCA工作液;每孔加入200 μl BCA工作液,37℃避光孵育30 min;用酶标仪读取560 nm的吸光度值。②样品检测:稀释待测样品至合适浓度,使样品稀释液总体积为20 μl,加入BCA工作液200 μl充分混匀,37℃避光孵育30 min,用酶标仪读取560 nm的吸光度值,由已知的标准曲线,根据样品的OD值得到样品的蛋白含量。(3)SDS-PAGE方法同1.1.6。
1.3统计学处理 使用SPSS16.0软件进行单因素方差(ANOVA)分析及LSD-t检验。

表1 各孔蛋白样品定量实验试剂
2 结 果
2.1整体动物实验
2.1.1各组血脂水平 MOD组血清TC、TG、LDL-C和ox-LDL含量明显高于CON组(P<0.001),HDL-C含量显著低于CON组(P<0.001)。与MOD组比较,SIM组及ICA-L、-H组血清TC、TG、LDL-C和ox-LDL含量均明显下降(P<0.001),HDL-C水平均显著升高(P<0.05或P<0.001),见表2。
表2 各组血清脂质
与CON组比较:1)P<0.001;与MOD组比较:2)P<0.01,3)P<0.001
2.1.2主动脉HE染色结果 CON组主动脉组织内膜、中膜和外膜分界清楚,内皮细胞排列有序完整,中膜可见梭形平滑肌细胞,弹力纤维层结构清晰完整,外膜为疏松结缔组织;MOD组主动脉内膜及中膜层见平滑肌细胞增殖及少量泡沫样细胞,弹力纤维变性、断裂和崩解,中膜萎缩;ICA-L、-H组内膜下见少量炎细胞浸润、平滑肌细胞轻度增殖,泡沫样细胞少见,AS病理改变较MOD组有不同程度的减轻,以SIM和ICA-H组上述改善最明显。见图1。
2.1.3基因芯片检测及生物信息学分析结果 对基因芯片分析发现53个差异表达miRNAs,通过对miRNAs同源性比较,筛选出人与小鼠同源性良好的、差异表达更显著的目标miRNA,即miR-205-5p。在基因芯片miRNAs差异表达谱聚类图中,miR-205-5p位列差异表达上调的第1位,前10位上调差异表达miRNAs见表3。
通过KEGG及target scan找到靶基因,取交集,然后David分析进行富集,再通过富集程度找到可能的目的基因——蛋白激酶Cα(PRKCA),构建miRNA-mRNA共表达网络如图2。通过构建信号转导通路,确定p38为靶基因PRKCA的下游信号分子(图3),因此构建出miR-205-5p/PRKCA/p38信号通路。
表3 miRNA数据集上调差异表达前10位基因
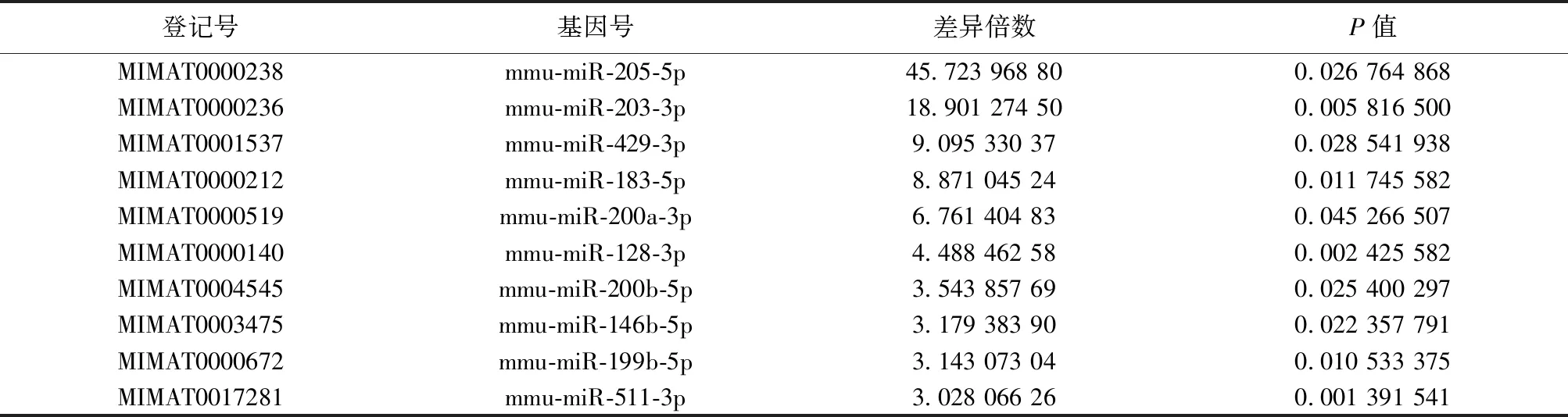
登记号基因号差异倍数P值MIMAT0000238mmu-miR-205-5p45.723 968 800.026 764 868MIMAT0000236mmu-miR-203-3p18.901 274 500.005 816 500MIMAT0001537mmu-miR-429-3p9.095 330 370.028 541 938MIMAT0000212mmu-miR-183-5p8.871 045 240.011 745 582MIMAT0000519mmu-miR-200a-3p6.761 404 830.045 266 507MIMAT0000140mmu-miR-128-3p4.488 462 580.002 425 582MIMAT0004545mmu-miR-200b-5p3.543 857 690.025 400 297MIMAT0003475mmu-miR-146b-5p3.179 383 900.022 357 791MIMAT0000672mmu-miR-199b-5p3.143 073 040.010 533 375MIMAT0017281mmu-miR-511-3p3.028 066 260.001 391 541
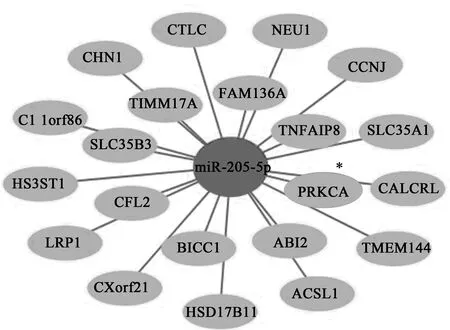
深灰色节点,miR-205-5p;浅灰色节点,miR-205-5p的靶mRNA,节点之间通过线连接。*所选靶mRNA图2 miRNA-mRNA共表达网络
2.1.4ICA对ApoE-/-小鼠胸主动脉miR-205-5p及PRKCA mRNA表达的影响 与CON组(1.067±0.04、1.005±0.13)对比,MOD组miR-205-5p表达(0.283±0.03)明显降低(P<0.05),PRKCA mRNA表达(1.736±0.43)明显升高(P<0.05);与MOD组相比,ICA-L、-H组miR-205-5p表达(2.632±0.31、5.288±0.90)明显上调(P<0.001),PRKCA mRNA表达(1.446±0.18、0.612±0.10)明显下降(P<0.01或P<0.001),且miR-205-5p及PRKCA mRNA的变化与ICA的剂量改变具有明显量效关系。
2.1.5ICA对ApoE-/-小鼠胸主动脉PRKCA蛋白表达及p38蛋白磷酸化的影响 与CON组(1.00±0.085、1.00±0.103)相比,MOD组PRKCA蛋白表达(1.61±0.009)明显升高(P<0.001),p38蛋白磷酸化(1.82±0.052)明显增加(P<0.001);与MOD组相比,ICA-L、-H组PRKCA蛋白表达(1.28±0.012、0.91±0.003)明显降低(P<0.001),p38蛋白磷酸化(1.47±0.017、0.53±0.008)明显减少(P<0.001),且具有量效关系。见图4。
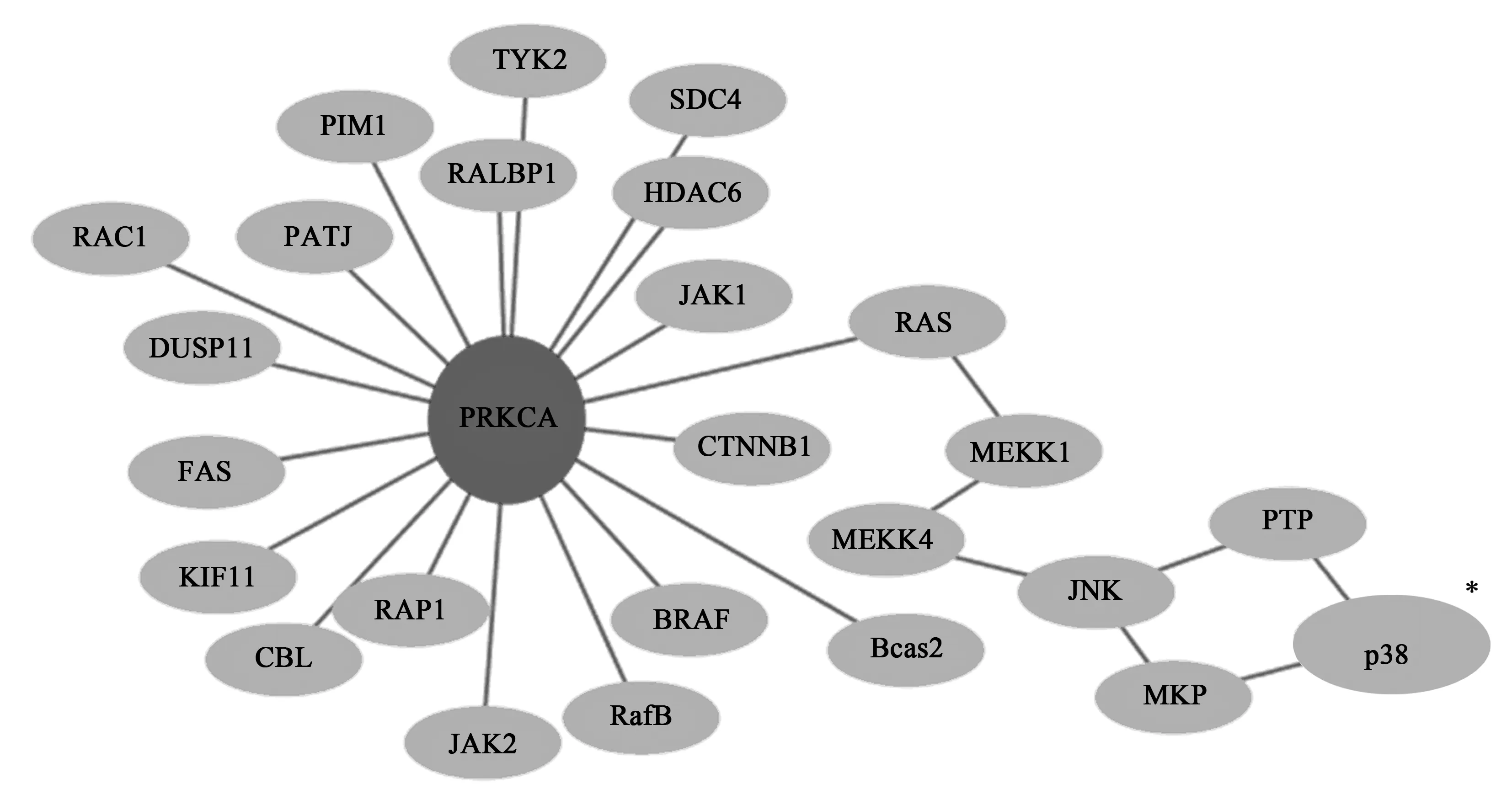
深灰色节点,靶基因PRKCA上调;浅灰色节点,下调的信号转导通路,节点之间通过线连接。*与PRKCA级联的信号通路分子图3 与PRKCA相关的信号转导通路
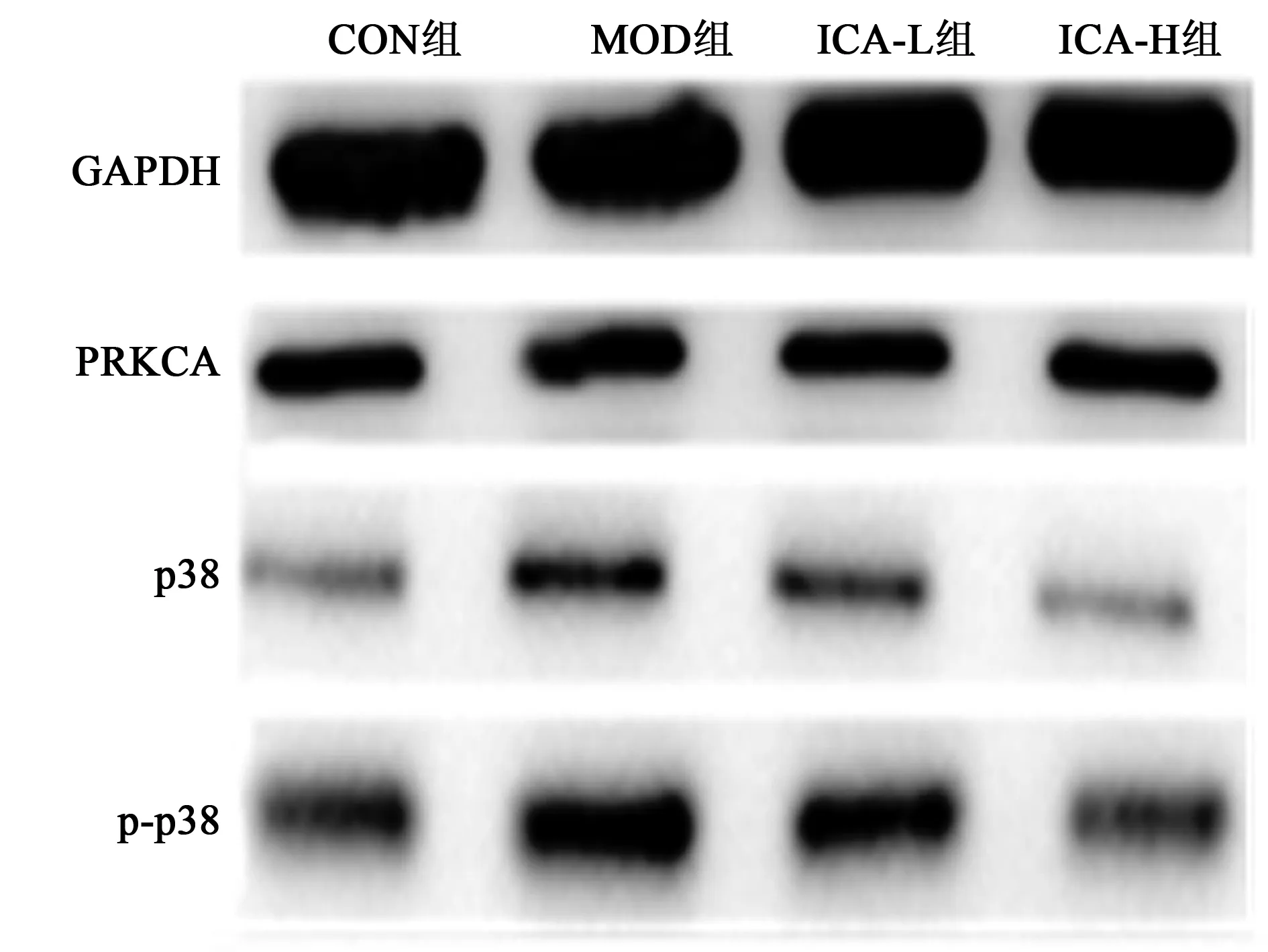
图4 各组胸主动脉PRKCA蛋白表达及p38蛋白磷酸化
2.2体外细胞实验
2.2.1ox-LDL诱导VSMCs增殖最佳浓度的确定 10、25、50、100、200 μg/ml CON组、ox-LDL组VSMCs相对细胞活性为100.0%±1.2%、127.7%±1.0%、160.0%±3.5%、144.0%±5.3%、125.0%±8.1%和100.1%±3.5%。与CON组相比,当ox-LDL浓度在10~100 μg/ml时VSMCs的增殖能力明显增强,当ox-LDL浓度为25 μg/ml对VSMCs的增殖能力作用最强(P<0.01),而随着ox-LDL浓度增加到200 μg/ml,ox-LDL促进VSMCs增殖能力反而降低。故选择25 μg/ml ox-LDL作为后续实验的浓度。
2.2.2ICA对ox-LDL诱导VSMCs增殖的抑制作用 CON组、MOD组、ICA 10、20、40 μmol/L组VSMCs相对细胞活性为100.0%±3.3%、165.7%±1.6%、125.5%±5.4%、101.4%±2.1%、100.8%±2.6%。与CON组相比,MOD组ox-LDL对VSMCs有明显的增殖作用(P<0.001);与MOD组相比,ICA 3个浓度组均显著抑制VSMCs的增殖(P<0.001)。
2.2.3ICA对ox-LDL诱导VSMCs迁移的影响 CON组、MOD组、ICA 10、20、40 μmol/L组VSMCs迁移率分别为培养24 h,(7.1±0.10)%、(22.3±2.17)%、(13.2±1.75)%、(7.6±0.12)%、(7.1±0.09)%;培养48 h,(13.9±0.08)%、(45.1±1.20)%、(33.8±1.75)%、(14.7±0.21)%、(14.1±0.24)%。培养24 h和48 h,MOD组细胞迁移均较CON组明显增加(P<0.01),与MOD组相比,ICA 3个浓度组细胞迁移均明显降低(P<0.05)。见图5。
2.2.4ICA对ox-LDL刺激VSMCs miR-205-5p及PRKCA mRNA表达的影响 与CON组(1.063±0.06、1.006±0.15)相比,MOD组细胞miR-205-5p表达水平(0.339±0.06)显著降低(P<0.05),PRKCA mRNA表达(2.178±0.37)显著升高(P<0.01);与MOD组相比,ICA 10、20、40 μmol/L组细胞miR-205-5p表达(2.744±0.45、4.843±0.35、4.103±0.05)均显著升高(P<0.01,P<0.001),ICA 10、20、40 μmol/L组细胞PRKCA mRNA表达(1.445±0.17、0.905±0.29、1.152±0.16)均显著降低(P<0.05,P<0.01)。

1~5:CON组、MOD组、ICA 10 μmol/L组、ICA 20 μmol/L组、ICA 40 μmol/L组,下图同图5 各组VSMCs迁移能力
2.2.5ICA对ox-LDL诱导VSMCs PRKCA蛋白表达及p38蛋白磷酸化的影响 与CON组(1.00±0.099、1.00±0.008)相比,MOD组VSMCs PRKCA蛋白表达(1.31±0.012)显著升高(P<0.001),p38蛋白磷酸化(2.24±0.102)显著升高(P<0.01);与MOD组相比,ICA 10、20、40 μmol/L组VSMCs PRKCA蛋白表达(0.91±0.015、0.42±0.009、0.56±0.015)和p38蛋白磷酸化水平(0.89±0.011、0.43±0.018、0.68±0.025)显著降低(P<0.001)。见图6。
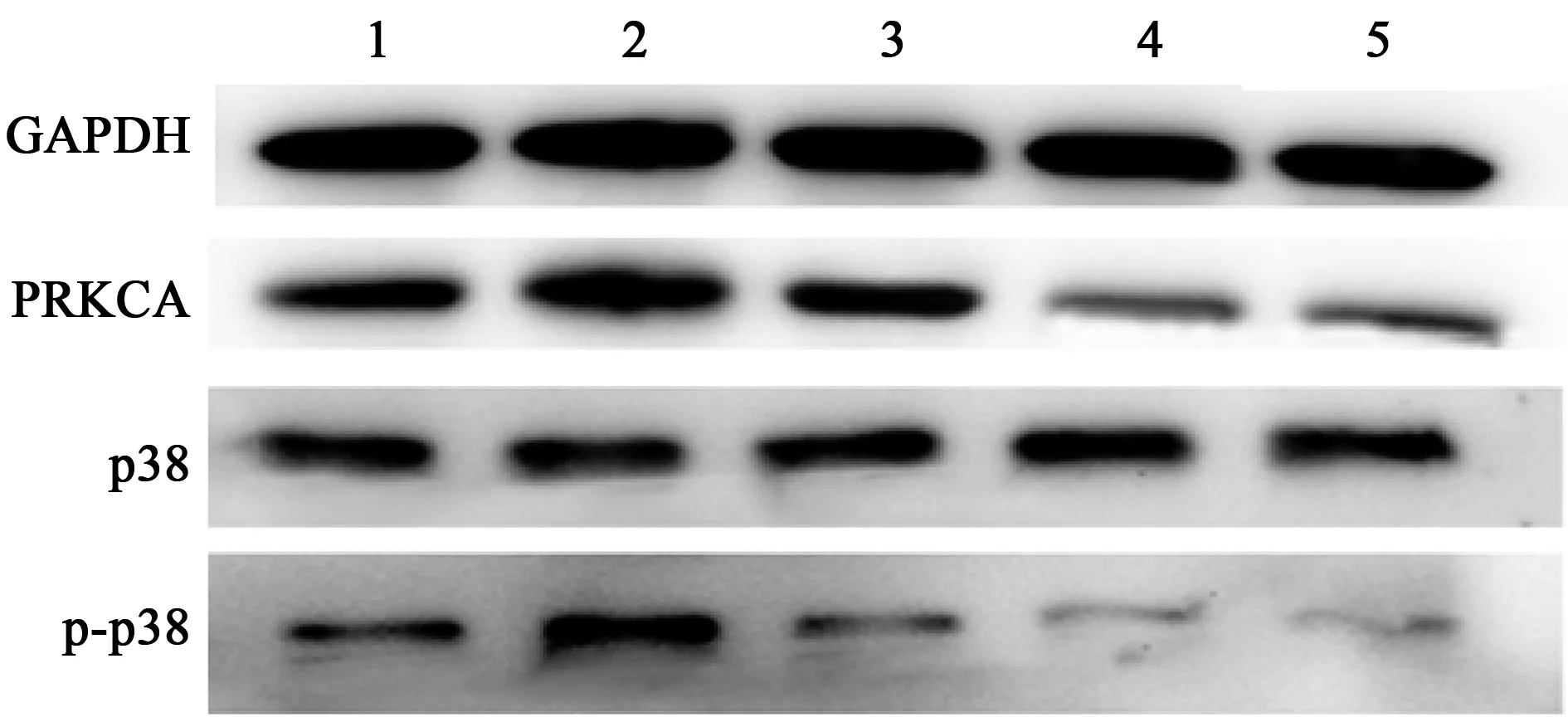
图6 各组VSMCs PRKCA和p-p38蛋白表达
3 讨 论
AS是动脉壁对内皮细胞损伤的一种慢性炎症反应,病变的机制包括脂蛋白氧化修饰、单核巨噬细胞与动脉壁细胞成分之间的相互作用,病变进展的核心因素包括内皮细胞损伤、炎症因子的释放、平滑肌细胞的增殖及迁移等〔13~15〕。
构建AS模型的方法很多,但大部分是基于AS的发病机制。如根据脂质浸润学说,建立了高脂饲料喂养法;根据损伤反应学说,建立机械损伤法等。因高脂饲料喂饲法复制的AS模型较接近人类病变,使用率较高。相比于非ApoE-/-的健康小鼠,ApoE-/-小鼠AS风险更高,尤其是在高脂饮食喂饲的情况下,可以在短期内构建AS模型,因而该模型得到广泛应用〔16,17〕。本研究结果表明,以HFD喂饲ApoE-/-小鼠在12 w内可以成功构建小鼠AS动物模型,与文献报道一致〔11,13,16〕。
ICA可通过抑制氧化损伤和趋化作用等生物学进程,达到延缓AS进展的作用〔17~19〕。沈晓君等〔20〕证实,ICA可通过抑制核因子(NF)-κB的活性进而抑制兔主动脉粥样硬化进展。马一君等〔21〕证实ICA可显著抑制兔VSMCs增殖及凋亡作用。
miRNA在AS的发生发展起重要作用〔22,23〕。蒋子平〔24〕发现,miR-200a/Keap1/Nrf2抗氧化信号通路与糖尿病导致的AS有着密切联系。王明辉〔25〕报道,miRNA-361-5p在AS中与血管重构有关。miRNA miR-29b在调节VSMCs功能中发挥重要作用,而VSMCs增殖迁移与AS发生发展密切相关〔26〕。
生物信息学分析广泛用于确定目的基因〔20,24〕。miRNA在DE基因的代表性谱中有显著差异,通过使用网络数据库GO可以分析特定基因的主要功能进而揭示基因调控网络,并将基因组织作为分层类别。根据KEGG及target scan路径分析可以定位DE基因的重要途径〔27〕,取DE基因交集然后采用David分析进行富集,再通过富集程度找到目的基因,通过构建全基因信号转导网络以证明基因之间的相互作用。PRKCA是PKC家族的成员,PRKCA的上调在几种类型的癌症中被发现并可调节多种细胞功能,包括细胞增殖,存活和转移,PRKCA的表达升高与肺腺癌相关,肺腺癌患者中较高的PRKCA表达与较低的累积总生存率相关〔28〕,研究表明PRKCA上调受miR-203调节〔29〕。p38丝裂原激活的蛋白激酶(MAPK)信号转导通路与AS的发生发展具有密切联系。苏绍红等〔30〕研究发现白芍总苷对AS大鼠肿瘤坏死因子(TNF)-α/p38 MAPK/NF-κB/视黄醇结合蛋白(RBP)4信号通路具有影响,孙晓旭等〔31〕报道Urantide可降低AS大鼠动脉p38 MAPK表达。已有实验表明,在小鼠肺腺癌模型中,PRKCA-/-小鼠在体外和体内肿瘤中均显示出支气管肺泡干细胞(BASCs)中的磷酸化p38 MAPK降低〔32〕,即PRKCA表达减少可能导致p38蛋白磷酸化减少。本研究结果表明miR-205-5p/PRKCA/p38信号通路在ICA抑制AS的发生发展中起介导作用。
综上,ICA具有抗AS作用,其机制可能是通过提高miR-205-5p mRNA表达,下调PRKCA mRNA及蛋白表达,进而减少p38蛋白磷酸化,并抑制VSMCs增殖与迁移,发挥其抗AS的作用。
