抵抗素样分子-β与老年患者颈动脉粥样硬化及斑块稳定性的相关性
2020-05-29王本孝王俊珺王鹏刘建魁牛祥
王本孝 王俊珺 王鹏 刘建魁 牛祥
(皖北煤电集团总医院 蚌埠医学院第三附属医院神经内科,安徽 宿州 234011)
缺血性脑卒中是临床中常见的一种脑血管疾病,具有高发病率、高致残率及高病死率特点,严重威胁我国中老年患者的生命安危〔1〕。颈动脉粥样硬化(CAS)斑块形成及易损结构是诱发脑卒中的重要危险因素,及时预防动脉粥样硬化的发生、时控制病情发展意义重大〔2〕。动脉粥样硬化病变初期为动脉管壁内中膜厚度增加,最终在诸多因素影响下发展为斑块,而其中易损伤型斑块具有薄的纤维帽、胶原纤维减少、大的脂核、细胞因子增加、巨噬细胞活性增加及多重炎症因子增加等特征,且炎症反应与斑块稳定性密切相关〔3,4〕。因此临床如何有效控制机体炎症反应,稳定斑块成为近年来缺血性脑卒中疾病研究的热点问题。抵抗素样分子(RELM)-β是一种抵抗素相关蛋白,研究发现RELM-β在人体心、肺、肾等脏器中的T细胞、巨噬细胞及平滑肌细胞中均有表达,并参与机体炎症反应,且RELM-β与高脂血症及糖尿病的发生密切相关,而高脂血症及糖尿病是动脉粥样硬化发生的危险因素〔5,6〕。因此RELM-β是重要的炎症调节因子,促进机体内炎症反应,但目前临床中针对RELM-β与CAS及斑块稳定性相关性研究较少。本研究分析RELM-β与老年患者CAS及斑块稳定性的相关性。
1 资料与方法
1.1一般资料 回顾性分析蚌埠医学院第三附属医院2019年1~6月收治的102例住院老年患者临床资料,其中男54例,女48例;年龄60~78岁,平均年龄(68.04±6.64)岁。采用美国GE公司生产的LOGIQ彩色多普勒超声诊断仪进行颈部超声检查,探头频率为7.5~10.0 MHz,测定颈动脉内中膜厚度(IMT)值,CAS斑块诊断标准〔7〕:IMT≥1.3 mm则为斑块形成。根据超声特定将其分为均质的低回声脂质型软斑块、均质等回声的纤维型斑块、均质强回声或伴声影钙化型硬斑块、不均质回声溃疡型混合斑块4类,其中纤维型斑块和钙化型斑块均为稳定斑块,而混合斑块及软斑块为不稳定斑块。以上述为依据将无斑块患者37例纳入A组,将斑块稳定患者35例纳入B组,将斑块不稳定患者30例纳入C组。排除标准:①合并支气管哮喘、慢性阻塞性肺疾病、感染性疾病等;②精神异常,不具认知能力者;③合并免疫系统、血液系统疾病及恶性肿瘤疾病者;④合并心源性、药物、感染、脑血管畸形等疾病引起脑卒中者。本研究符合医院医学伦理委员会制定的相关标准。
1.2研究方法 设计一般情况调查表,详细记录三组患者一般资料(性别、年龄、高血压史、糖尿病史、吸烟史等)、血脂〔三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)〕、炎症因子〔白细胞介素(IL)-1β、IL-6、超敏C反应蛋白(hs-CRP)〕及RELM-β水平。(1)高血压诊断标准:参照《中国高血压防治指南》〔8〕诊断标准:非同日静息状态下两次血压值即舒张压≥90 mmHg或收缩压≥140 mmHg;伴有高血压史者,且长期服用降压药物者,血压检测<140/90 mmHg均诊断为高血压。(2)糖尿病诊断标准:在本次发病前明确糖尿病史,参照《中国2型糖尿病防治指南(2017年版)》〔9〕诊断标准:具有典型症状“三多一少”,空腹血糖≥7.0 mmol/L或餐后2 h血糖≥11.1 mmol/L;没有典型症状,仅空腹血糖≥7.0 mmol/L或餐后2 h血糖≥11.1 mmol/L;(3)实验室生化指标:于患者入院次日采集清晨空腹静脉血4 ml,放置于干燥试管中,温室放置2 h,3 000 r/min离心15 min后,取上清液,血脂、hs-CRP采用临床检验科全自动生化分析仪检测,检测试剂盒由北京利德曼生化有限公司提供。(4)IL-6、IL-1β、RELM-β检测:取备用血清液,采用酶联免疫吸附试验检测IL-6、IL-1β、RELM-β 水平。
1.3观察指标 比较三组患者一般资料、血脂、炎症因子及RELM-β水平,分析RELM-β水平与主要炎症因子水平的相关性及RELM-β与老年患者颈动脉粥样硬化及斑块稳定性的相关性。
1.4统计学方法 应用SPSS20.0软件进行单因素方差分析、χ2检验、t检验、双变量Pearson相关性检验、多元Logistic回归。
2 结 果
2.1一般资料 三组性别、年龄、高血压、糖尿病、吸烟史、TG、TC、HDL-C比较,差异无统计学意义(P>0.05);LDL-C比较差异有统计学意义(P<0.05)。见表1。
2.2血清炎症因子与RELM-β水平 C组血清RELM-β、IL-6、IL-1β、hs-CRP水平最高,其次为B组,A组最低,三组组间比较差异有统计学意义(P<0.05)。见表2。
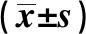
表1 三组一般资料对比
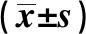
表2 三组血清炎症因子及RELM-β水平对比
2.3血清炎症因子与RELM-β水平的相关性 CAS患者的血清RELM-β与IL-6、IL-1β、hs-CRP呈正相关(r=0.837、0.647、0.801,均P<0.001),即血清RELM-β水平升高,炎症因子IL-6、IL-1β、hs-CRP水平升高。
2.4血清RELM-β对老年CAS患者斑块稳定性的影响 将血清RELM-β作为因变量,将斑块是否稳定作为自变量,经二元Logistic回归分析发现,血清RELM-β升高可能是诱发颈动脉粥样硬化斑块不稳定的影响因素(OR=1.760,95%CI:1.322~2.342,P<0.001)。
3 讨 论
动脉粥样硬化是一种因脂质积累、平滑肌细胞增加及钙化引起的动脉内膜损伤为主要特征的慢性疾病,炎症伴随动脉粥样硬化的整个过程,是老年患者并发心脑血管疾病的重要基础,而CAS是缺血性脑血管疾病发生的独立危险因素〔10,11〕。从病理学解剖角度分析,CAS发展过程主要为4部分:(1)脂质点:形成脂质条纹;(2)斑块前期:脂质池尚未形成;(3)粥样斑块:脂质池形成;(4)纤维斑块期:纤维斑块期会导致动脉腔内狭窄,继发血管性病变,如斑块破裂、斑块内出血、血栓〔12〕。粥样硬化病变常累及颈动脉,导致血管腔出现阻塞和狭窄,造成脑局部出现缺血缺氧性损伤或坏死,即为急性缺血性脑卒中,危及患者生命〔13,14〕。因此动脉粥样硬化及稳定性在急性脑卒中疾病发病中扮演着重要角色。
近年来,随着颈动脉血管超声成像技术不断发展与应用,使临床中对CAS斑块性状有了进一步认识,目前临床中将其分为不稳定行斑块和稳定斑块两种,其中不稳定型斑块诸多特征中一个较为突出的特点为炎症细胞浸润,如T淋巴细胞、巨噬细胞、中性粒细胞及肥大细胞等,表明炎症反应在维持斑块稳定性方面具有重要作用〔15〕。在小鼠动脉粥样硬化斑块内均能够检测到IL-1β和IL-6的存在,而且在敲除IL-1β和IL-6的ApoE小鼠动脉粥样硬化模型中发现,动脉粥样硬化斑块面积及巨噬细胞含量均显著,证实IL-1β和IL-6在动脉粥样硬化斑块形成和发展中具有重要作用。IL-6、IL-1β、hs-CRP均为细胞炎症因子,且IL-6、IL-1β在动脉粥样硬化不稳定斑块中表达明显增加,继而诱导血管腔炎症反应,扩大斑块面积,增加血管性疾病发生风险性,IL-6、IL-1β与动脉粥样硬化斑块形成及发展密切相关。IL-6、IL-1β是一类具有多种功能的细胞因子,是机体内炎症及免疫反应发生过程重要的介导物质,主要由巨噬细胞及淋巴细胞分泌而来,但T淋巴细胞及巨噬细胞浸润会诱发不稳定性斑块的发生及发展,因此IL-6、IL-1β水平增加会加重斑块炎症浸润,促进不稳定斑块形成,降低其稳定性。而RELM-β在心、肺、肾等多脏器中均有表达,尤其在巨噬细胞、IL-1β、T细胞等炎症细胞中表达尤为突出。有研究证实如孙鹏飞等〔16〕通过对小鼠研究证实RELM-β可通过感染炎性介质IL-6、IL-1β释放促进易损斑块形成及脱落。RELM-β可促进胃肠内炎症反应,但鲜有关于RELM-β与CAS及稳定性的相关研究。本研究结果表明RELM-β水平与老年患者CAS及斑块稳定性密切相关。分析其原因为低水平炎症环境,活化的巨噬细胞、T细胞会分泌大量RELM-β,导致机体内循环RELM-β水平增加;此外,巨噬细胞可迁移至血管壁,导致局部RELM-β水平增加,而循环及局部RELM-β又作为一种效应分子,可激活血管壁细胞,导致血管内皮细胞功能失调,诱发血管壁发生炎症反应,继而促进一系列AS的发生,并影响斑块的稳定性,增加斑块脱落堵塞血管的风险〔17,18〕。
综上所述,RELM-β水平与老年患者CAS及斑块稳定性显著相关,RELM-β水平过高可导致CAS斑块的不稳定性,增加斑块脱落、脑卒中发生的风险。本研究仍有不足之处,如研究样本量较少,血清各项指标检测均为患者入院后次日水平,未对患者治疗后相关水平进行检测和对比分析,使研究数据结果可信度减低,日后应增加研究样本量,多时间段获取血清水平,以提高研究数据的可信度。
