微RNA-145抑制剂靶向CRKL调节促分裂原活化的蛋白激酶通路对卵巢颗粒细胞激素合成的影响Δ
2020-05-29张远远胡昌华杨书红
张远远,胡昌华,杨书红,王 峥
(1.武汉科技大学附属汉阳医院妇产科,湖北 武汉 430000; 2.华中科技大学附属同济医院妇产科,湖北 武汉 430000; 3. 荆州市第二人民医院妇产科,湖北 荆州 434000)
卵巢作为维系女性健康的生殖器官,行使着生殖及内分泌的功能。受遗传、环境和行为等因素的影响,女性卵巢功能逐渐衰退,激素调节失衡,进而导致机体如骨骼、心血管及免疫等多器官、系统的功能障碍。卵巢功能减退表现为女性在40岁以前出现的月经异常、促性激素水平升高及雌激素水平波动性降低,随病情加重,出现闭经、雌激素水平降低等症状,以致卵巢早衰[1]。在我国,卵巢早衰的发病率为1%,其中90%~95%的患者无法自然妊娠,严重影响了女性的身体健康及生活质量。目前,临床根据症状和患者对生育的不同需求,常使用激素替代疗法、免疫治疗和中药治疗等方法恢复排卵以受孕,但尚无有效的方法能够恢复卵巢功能[2]。卵巢颗粒细胞 (granulosa cell,GC)是卵巢合成和分泌雌激素、抑制素的主要功能细胞,其在卵泡细胞的成熟和发育中起着支持雌激素介导作用,同时维持卵巢激素平衡[3]。GC的凋亡启动卵泡发生闭锁,使有正常生理功能的卵泡数目大幅减少,从而导致卵巢早衰[4-5]。CRKL是CRK蛋白家族中的重要成员,可以促进并调节细胞增殖、黏附和迁移等多种生物学功能。有研究结果发现,Crk和CrkL蛋白可能在上皮性卵巢癌的发生、发展中发挥某种作用[6],可能成为细胞恶性转化的潜在新型诊断标志物和治疗靶点。微RNA (microRNA,miRNA)是由19~25个核苷酸构成的非编码单链小RNA分子,在动植物及微生物中都广泛存在,其通过对信使RNA进行转录调控,使其表达沉默,进而影响细胞的生长、发育、分化及凋亡。有报道称,无论物种如何,miRNA-21、miRNA-99a、miRNA-125b、miRNA-126、miRNA-143、miRNA-145和miRNA-199b都是最常见的卵巢miRNA群[5]。该类小分子参与调节卵巢颗粒细胞的增殖、凋亡等多种功能[5],在卵巢激素生成、卵泡生长发育及排卵方面都发挥了重要的调节作用[7]。但miRNA如何调控颗粒细胞激素的合成及通过何种途径影响颗粒细胞的凋亡等功能,值得进一步探讨。本研究预备采用miRNA芯片技术检测在不同时期小鼠卵巢颗粒细胞中差异性表达的miRNA,采用生物信息学软件TargetScan预测具有显著差异性表达的miRNA靶基因,分析靶基因在信号通路及生物学功能的富集情况,筛选与CRKL存在最佳碱基互补的miRNA,结合生物信息预测结果,筛选在不同时期卵巢颗粒细胞中起到重要调控作用的miRNA;调查其在体内、体外对激素生成及细胞增殖的影响,分析CRKL在卵巢颗粒细胞中是否受关键miRNA的调控,从而对关键信号通路产生影响,为颗粒细胞凋亡引发的卵巢早衰的防治提供新的治疗靶点依据。
1 材料与方法
1.1 材料
小鼠miRNA寡核苷酸基因芯片12.0、miRNA Complete Labeling and Hyb Kit及Gene Expression Wash Buffer Kit均购自美国安捷伦公司;miRVana RNA提取试剂盒购自Ambion公司;RNase-Free DNase Set (50)购自Qiagen公司;RNA提取试剂Trizol购自Gibco BRL公司;M-MLV逆转录酶、Oligo (dT)购自Promega公司;Taq DNA聚合酶购自MBI公司;RNA酶抑制剂RNasin购于Sigma公司;DMEM/F12购自美国Gibco公司;噻唑蓝(MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma公司;青链霉素混合液购自索莱宝公司;本研究所有基因引物均购自上海生工公司;CRKL酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购自上海康朗生物科技有限公司;雌二醇(E2)、促卵泡激素(FSH)、黄体生成素(LH)ELISA试剂盒购自上海西唐公司;p-p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)及p-蛋白激酶1/2(p-ERK1/2)ELISA检测试剂盒购自南京森贝伽生物科技有限公司。DAVID数据库网址(https://david.ncifcrf.gov/,版本号6.8),TargetScan数据库网址(http://www.targetscan.org/vert_72/)。
1.2 实验动物的药物干预及处理
C57BL/6小鼠购自湖北疾控中心,miRNA-145敲除的C57BL/6小鼠购自赛业生物科技有限公司,饲养于华中科技大学同济医学院实验动物中心SPF级动物房。小鼠接受自由饮食饮水,控制日夜周期,雌雄性小鼠在各品种内自由交配。5日龄乳鼠卵巢内出现初级卵泡,遂分别选取5日龄小鼠及14日龄小鼠进行指标的检测。将初生雌鼠分为A组(5日龄正常雌鼠)、B组 (5日龄miRNA-145敲除小鼠)、C组(14日龄正常雌鼠)和D组 (14日龄miRNA-145敲除小鼠)。
1.3 5、14日龄雌鼠卵巢颗粒细胞的提取、培养及生存率检测
(1)DMEM/F12培养液:胎牛血清与DMEM/F12混合比例为1∶9,并且加入1%体积的青霉素和链霉素。无菌操作,密封后4 ℃保存。Ⅰ型胶原酶:Ⅰ型胶原酶0.1 g与PBS 100 ml充分混匀,滤过除菌后分装,置于-20 ℃保存。(2)分别于5、14 d对四组小鼠进行解剖,取出双侧卵巢,分离卵巢周围多余脂肪及卵巢囊,根据文献方法[8],提取卵巢颗粒细胞,将不同组小鼠的卵巢颗粒细胞分别接种于4个培养瓶中,置于DMEM/F12培养基、37 ℃、5%CO2和湿度90%的孵箱孵育。12 h换液1次,24 h传代1次。体外培养72 h后分别加入miRNA-145抑制剂2 μmol/L继续培养72 h。(3)细胞培养结束后,取出培养板,在每孔液面上加入5 mg/ml的MTT 20 μl,37 ℃温箱中孵育4 h后取出培养板,小心抽去上清液,结晶用DMSO 150 μl溶解,在平板振荡器上振荡10 min,使用Thermo 3001型多功能酶标仪570 nm处测量各孔的吸光值,计算药物对细胞活力的影响:

1.4 Q-PCR检测miRNA-145及CRKL mRNA的表达
采用试剂盒提取细胞RNA,反应体系为 2×SYBR Green PCR Master Mix 10 μl,Primer A 1 μl,Primer B 1 μl,cDNA 2 μl,RNase-free water 6 μl,Total reaction volume 20 μl。反应条件为 95 ℃ 10 min,95 ℃ 10 s,60 ℃ 45 s。循环扩增 40 次结束后,获得miRNA-145及CRKL mRNA循环阈值 (cycle threshold,Ct),应用ΔΔCt (ΔCt目的基因-ΔCt 内参基因)分析,计算2-ΔΔCt目的基因相对表达量之后,进行统计分析。
1.5 ELISA法检测雌鼠血清中E2、FSH和LH水平及卵巢颗粒细胞中CRKL、p-p38 MAPK和p-ERK1/2水平变化
(1)将各组小鼠解剖后,进行眼眶取血,离心后留上清液,根据试剂盒检测方法对E2、FSH、LH的水平进行检测。(2)各组小鼠解剖后,取出卵巢组织,分离卵巢细胞,采用文献的方法提取细胞全蛋白[9],根据试剂盒检测方法对卵巢颗粒细胞中CRKL、p-p38 MAPK及p-ERK1/2的水平进行检测。
2 结果
2.1 5、14日龄小鼠卵巢中差异性表达miRNA分析及关键miRNA的筛选
根据miRNA在不同组间的表达量的差异,5日龄与14日龄小鼠卵巢颗粒细胞中miRNA相比,15个miRNA表达明显上调;9个miRNA表达明显下调[见图1(A)];随后采用TargetScan数据库预测有明显差异性表达的miRNA的靶基因,并对靶基因集合进行KEGG通路富集及GO-BP分析,结果显示,差异性表达miRNA对应靶基因多集中于MAPK信号通路及NOD样受体信号通路,且其生物学功能多与细胞的增殖、分化及形态有关[见图1(B、C)],提示miRNA可能通过影响细胞的增殖分化等过程影响小鼠卵巢的发育。经TargetScan数据库预测与CKRL蛋白碱基互补的miRNA。结合miRNA在不同日龄小鼠卵巢中表达的差异、其靶蛋白所涉及的生物学功能及与CRKL碱基互补情况结果,预测miRNA-145可能通过与CRKL结合(见表1),从而影响卵巢细胞的增殖及激素合成,同时发现CRKL在富集于MAPK通路的分子集中。为验证预测结果,本课题组将在体外试验中研究miRNA-145是否通过靶向CRKL影响其增殖及激素合成情况。

A.差异性表达miRNA聚类分析热图;B.差异性表达miRNA靶基因通路富集分析;C.差异性表达miRNA靶基因生物学功能富集分析A.heat map of differential expression miRNA cluster analysis; B.pathway enrichment analysis of differential expression miRNA target gene; C.biological function enrichment analysis of differential expression miRNA target genes
2.2 miRNA-145、CRKL mRNA在5、14日龄小鼠卵巢颗粒细胞中及miRNA-145抑制剂作用后的表达
对不同日龄雌鼠的卵巢中miRNA-145及CRKL mRNA的表达情况进行对比分析,结果发现,5日龄小鼠卵巢中miRNA-145表达与14日龄雌鼠卵巢中miRNA-145相比有显著性降低[见图2(A)]。而CRKL mRNA表达水平结果显示,5日龄小鼠卵巢中CRKL mRNA表达与14日龄雌鼠卵巢中CRKL mRNA相比同样有显著性降低,证明CRKL mRNA与miRNA-145表达呈正相关[见图2(B)]。MTT法检测各组卵巢颗粒细胞的生存率结果提示[见图2(C)],卵巢颗粒细胞在正常生理环境下衰老凋亡速度较慢,但抑制miRNA-145的表达后,细胞生存率明显升高,miRNA-145能够加速细胞的衰老乃至凋亡。同时检测了miRNA-145抑制剂对不同生长时期卵巢颗粒细胞中CRKL mRNA水平的影响[见图2(D)],结果显示,miRNA-145抑制剂能够明显降低各组细胞的CRKL mRNA水平。
2.3 miRNA-145敲除小鼠卵巢激素分泌正向调节,颗粒细胞内CRKL水平下调
POF的诊断标准之一就是促性腺激素水平升高,伴雌激素水平降低[5]。根据结果[见图3(B、C、D)],14日龄基因敲除小鼠与14日龄正常组小鼠相比,FSH及LH水平明显降低,E2水平显著性升高。miRNA-145敲除后小鼠卵巢与正常小鼠卵巢中相比,CRKL水平显著性降低[见图3(A)],与体外实验结果一致。
2.4 miRNA-145敲除小鼠的卵巢颗粒细胞p-p38 MAPK,p-ERK1/2蛋白表达下调
经统计学对比后发现,基因敲除小鼠的卵巢颗粒细胞中p-p38 MAPK及p-ERK1/2水平与正常组小鼠比较显著降低[见图4(A、B)],提示miRNA-145的表达受到抑制后,MAPK信号通路的激活同样受到抑制,从而使卵巢颗粒细胞的凋亡明显下降。

表1 CRKL与miRNA-145碱基配对情况

5D:5日龄雌鼠卵巢颗粒细胞;14D:14日龄雌鼠卵巢颗粒细胞; A.miRNA-145在5、14日龄小鼠卵巢颗粒细胞中的表达(与5D相比,*P<0.05,**P<0.01);B.CRKL mRNA在5、14日龄小鼠卵巢颗粒细胞中的表达(与5D相比,*P<0.05,**P<0.01);C.miRNA-145抑制剂对5、14日龄小鼠卵巢颗粒细胞生存率的影响(与A组相比,*P<0.05,**P<0.01);D.miRNA-145抑制剂对5、14日龄小鼠卵巢颗粒细中CRKL mRNA表达的影响(与A组相比,*P<0.05,**P<0.01;与C组相比,#P<0.05,##P<0.01)5D: ovarian granulosa cells of 5-day-old female mice, 14D: ovarian granulosa cells of 14-day-old female mice; A. expression of miRNA-145 in ovarian granulosa cells of 5-day-old and 14-day-old mice (vs. 5 D, *P<0.05, **P<0.01); B. expression of CRKL mRNA in ovarian granulosa cells of 5-day-old and 14-day-old mice(vs. 5 D, *P<0.05, **P<0.01); C. effect of miRNA-145 inhibitor on the survival rate of ovarian granulosa cells in 5-day-old and 14-day-old mice (vs. group A, *P<0.05, **P<0.01); D. effect of miRNA-145 inhibitor on the expression of CRKL mRNA in ovarian granules of 5-day-old and 14-day-old mice (vs. group A, *P<0.05, **P<0.01; vs. group C, #P<0.05, ##P<0.01)
3 讨论
目前认为,卵巢衰老的主要原因是卵泡数目减少、卵巢微环境的改变以及对外界刺激的反应力降低,其中卵泡数目的减少是最主要的衰老病因,而卵泡数目的减少与卵泡闭锁密切相关[10]。在女性一生中,发育成熟并能够最终被释放的卵泡数目是有限的,但卵巢衰老后,随着卵泡闭锁以致消亡会导致卵巢功能最终丧失,激素分泌、调节失衡,引发机体其他系统或器官的病变[11]。引发卵泡闭锁的重要环节是卵巢颗粒细胞的凋亡[12]。miRNA是一类可调控转录水平基因表达的小分子非编码RNA,在卵巢激素的生成、卵泡生长发育、排卵以及黄体功能形成过程中发挥着重要的调节作用[13]。大量有关miRNA的研究集中于其对肿瘤细胞的调节作用,罕见对机体正常功能细胞的生长、分化及功能的研究。本研究采用miRNA 芯片技术检测了5、14日龄雌性小鼠卵巢中差异性表达的miRNA共23个,随后通过对miRNA靶基因的生物学功能及通路的富集分析结果发现,MAPK信号通路是不同日龄小鼠的卵巢颗粒细胞在增殖等过程中的重要信号通路,与相关研究结果一致[14],这也就间接提示,miRNA可能通过影响细胞的增殖分化等过程影响小鼠卵巢的发育。经TargetScan数据库与CRKL碱基互补良好的miRNA,同时结合生物信息学结果,预测miRNA-145可能通过与CRKL靶向结合,从而影响卵巢细胞的增殖及激素合成。
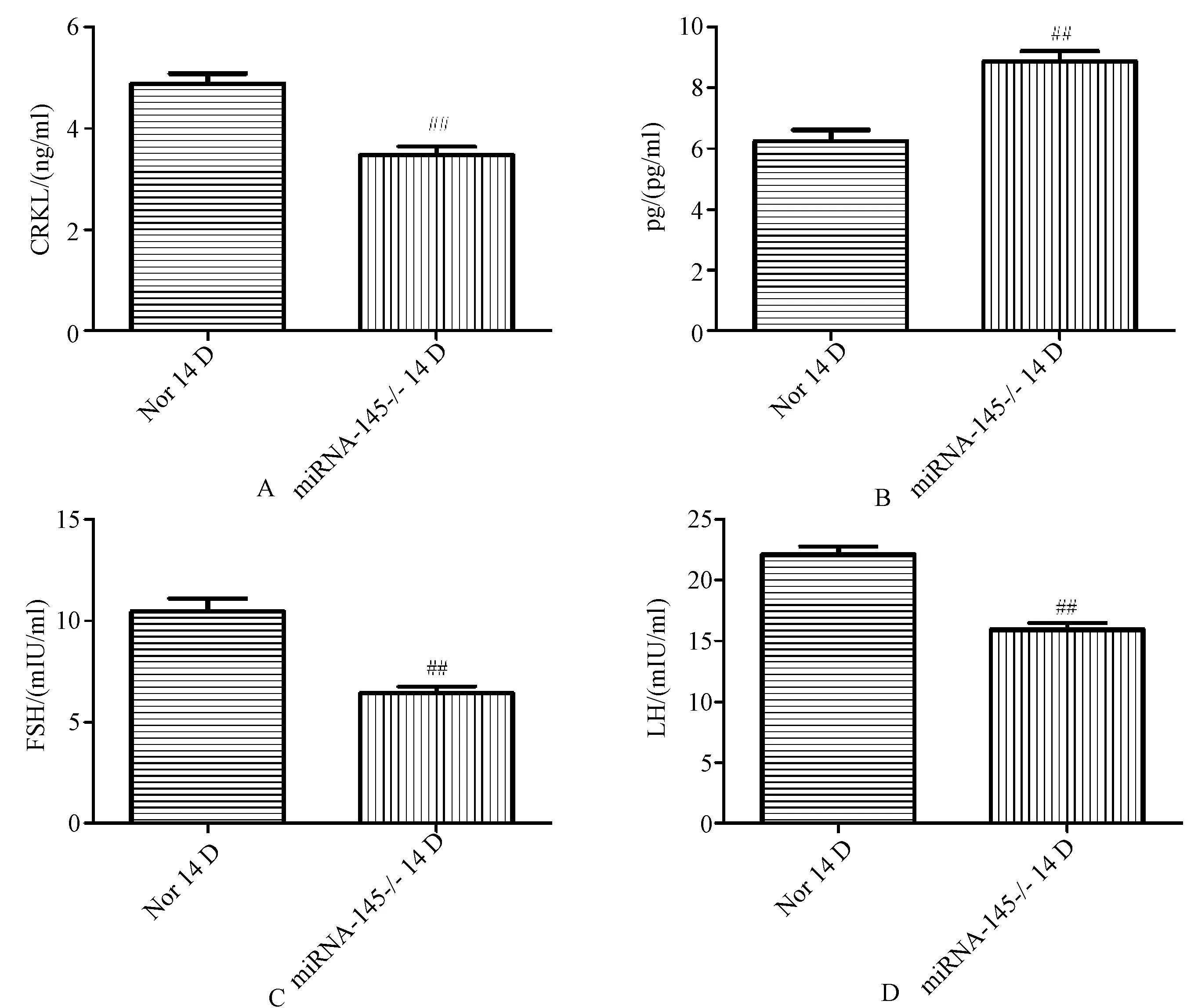
Nor 14D:14日龄雌鼠卵巢颗粒细胞;miRNA-145 -/- 14D:14日龄miRNA-145敲除小鼠卵巢颗粒细胞; A.CRKL在14日龄正常小鼠与14日龄miRNA-145敲除小鼠卵巢细胞中的表达(与Nor 14 D相比,#P<0.05,##P<0.01);B.E2在14日龄正常小鼠与14日龄miRNA-145敲除小鼠卵巢细胞中的表达(与Nor 14 D相比,#P<0.05,##P<0.01);C.FSH在14日龄正常小鼠与14日龄miRNA-145敲除小鼠卵巢细胞中的表达(与Nor 14 D相比,#P<0.05,##P<0.01);D.LH在14日龄正常小鼠与14日龄miRNA-145敲除小鼠卵巢细胞中的表达(与Nor 14 D相比,#P<0.05,##P<0.01)Nor 14D: ovary granulosa cells of 14-day-old female mice; miRNA-145-/-14D: ovary granulosa cells of 14-day-old miRNA-145 knockout mice; A.expression of CRKL in ovary of 14-day-old normal mice and 14-day-old miRNA-145 knockout mice (vs. Nor 14 D, #P<0.05, ##P<0.01); B. expression of E2 in ovary of 14-day-old normal mice and 14-day-old miRNA-145 knockout mice (vs. Nor 14 D, #P<0.05, ##P<0.01); C. expression of FSH in ovary of 14-day-old normal mice and 14-day-old miRNA-145 knockout mice (vs. Nor 14 D, #P<0.05, ##P<0.01); D. expression of LH in ovary of 14-day-old normal mice and 14-day-old miRNA-145 knockout mice (vs. Nor 14 D, #P<0.05, ##P<0.01)

Nor 14D:14日龄雌鼠卵巢颗粒细胞;miRNA-145 -/- 14D:14日龄miRNA-145敲除小鼠卵巢颗粒细胞; A.p-P38-MAPK在14日龄正常小鼠与14日龄miRNA-145敲除小鼠卵巢细胞中的表达(与Nor 14D相比,#P<0.05,##P<0.01);B.p-ERK 1/2在14日龄正常小鼠与14日龄miRNA-145敲除小鼠卵巢细胞中的表达(与Nor 14D相比,#P<0.05,##P<0.01)Nor 14D: ovary granulosa cells of 14-day-old female mice; miRNA-145-/-14D: ovary granulosa cells of 14-day-old miRNA-145 knockout mice; A.expression of p-P38-MAPK in ovary of 14-day-old normal mice and 14-day-old miRNA-145 knockout mice (vs. Nor 14D, #P<0.05, ##P<0.01); B.expression of p-ERK 1/2 in ovary of 14-day-old normal mice and 14-day-old miRNA-145 knockout mice (vs. Nor 14D, #P<0.05, ##P<0.01)
有研究结果证明,CRKL通过上调基质金属蛋白酶9的表达以及激活ERK通路,提高肺癌细胞侵袭能力[15]。针对结肠癌的研究结果表明,CRKL在结肠癌中的表达显著高于正常组织,促进细胞增殖、迁移和侵袭,同时抵抗细胞凋亡,提示CRKL的上调会促进细胞的生长增殖行为[16]。为验证预测结果,本研究分别提取了5、14日龄雌鼠的卵巢颗粒细胞,对不同日龄雌鼠的卵巢中miRNA-145及CRKL mRNA的表达情况进行对比分析。结果发现,随年龄增长,卵巢发育,卵巢颗粒细胞中相关蛋白开始改变,miRNA-145表达的差异可能是卵巢发育乃至衰老的一个持续性变化RNA。而CRKL mRNA与miRNA-145表达呈正相关,证明CRKL与细胞的发育、分化等有关。
在卵巢中,FSH、LH受体与颗粒细胞状态呈现相关性,卵泡闭锁和颗粒细胞凋亡会导致FSH和LH受体表达降低[17]。研究结果表明,FSH的增加可减缓颗粒细胞的凋亡速度,激素水平的调节及卵巢功能失衡是卵巢早衰的重要诊断之一[18]。本研究对比14日龄小鼠激素水平结果发现,与正常小鼠相比,基因敲除小鼠FSH及LH水平明显降低,E2水平显著性升高,证明miRNA-145敲除后,小鼠卵巢中激素分泌水平受到影响,抑制miRNA-145的表达可以延缓小鼠卵巢衰老的进程。体外miRNA-145抑制剂对不同生长时期小鼠卵巢颗粒细胞生存率及CRKL mRNA水平的影响提示,CRKL水平与miRNA-145水平呈正相关,推测miRNA-145受到抑制后,表达下调,CRKL水平降低,从而提升细胞生存率;根据miRNA-145敲除小鼠miRNA-145抑制后14日龄小鼠卵巢中CRKL水平可见,miRNA-145敲除后小鼠卵巢与正常小鼠卵巢相比,CRKL水平显著性降低。以上研究结果提示,miRNA-145可能通过靶向CRKL对卵巢颗粒细胞的功能及生存率产生影响,而生物信息预测结果提示,MAPK通路可能是重要的机制之一。
MAPK信号通路在多种生物和细胞中具有重要调控作用,参与机体生长、发育等多种生物学过程[19]。在卵巢颗粒细胞中MAPK信号通路参与细胞增殖、分化及氧化应激等多种过程[20]。MAPK家族的信号通路主要由4条途径组成,包括p-p38 MAPK、蛋白激酶 (ERK)、c-Jun N端激酶应激激活的蛋白激酶和ERK5/BMK1[21]。其中p-p38 MAPK作为研究最多也最透彻的信号转导途径,影响着细胞生长、分化、增殖和凋亡等一系列生物过程[22]。经生物信息学预测,miRNA-145可能通过靶向CRKL对MAPK产生作用,从而影响卵巢颗粒细胞的生存率及生物学功能。在体实验结果发现,miRNA-145基因敲除后,与正常组小鼠对比,p-p38 MAPK、p-ERK1/2蛋白表达水平明显降低,提示miRNA-145能够调控MAPK信号通路,通过抑制miRNA-145的表达,可抑制MAPK通路的激活,减少卵巢颗粒细胞的凋亡。
miRNA-145表达受抑制后,卵巢颗粒细胞的生存率得到保护,凋亡减少,激素分泌水平趋于平衡,其机制与MAPK通路有关,而其中关键的作用蛋白可能是与miRNA-145靶向结合的CRKL。
综上所述,本研究采用生物信息学方法预测miRNA-145是卵巢早衰中的重要转录因子,且与CRKL能够靶向结合;体外实验结果发现,miRNA-145抑制剂可减少卵巢颗粒细胞的凋亡,并抑制CRKL水平;在体实验结果发现,miRNA-145敲除小鼠的CRKL表达减少,激素分泌水平趋于平衡,这与抑制MAPK通路的激活有关。miRNA-145抑制剂靶向CRKL调节MAPK通路可能是卵巢早衰的诊治新思路。
