弱稳恒磁场环境下基于BiFeO3@TiO2复合纳米颗粒体外光动力疗法灭活HL60细胞试验研究
2020-05-28刘丽玲张启云艾保全熊建文
赵 杨,刘丽玲,张启云,方 杰,陈 丽,艾保全,熊建文*
(1.华南师范大学物理与电信工程学院, 广州 510006; 2.广东工业大学物理与光电工程学院, 广州510006)
光动力疗法(photodynamic therapy,PDT)具有的选择性杀伤细胞、可与其他治疗方法联合使用等优点使其常用于生物医学领域,并且在皮肤、肿瘤等疾病上已经成功地应用于临床[1,2]。而光敏剂是影响光动力疗法的重要因素之一,因此光敏剂的研发改进也就成为了科学家们研究的热点。由于TiO2的毒性低、化学性质稳定、光催化活性较高,使其成为一种潜在的光敏剂。但是由于TiO2的宽带隙(3.2 eV),导致其可见光响应较低,表面生成的电子空穴复合率高,使其在PDT应用中受到一定限制。
针对TiO2可见光响应低等缺点,已经有较多的方法对TiO2进行改性,例如金属掺杂、非金属掺杂、量子点修饰、半导体复合等[3-7]。目前国内外很多研究学者考虑TiO2在PDT过程中的局限性,成功通过半导体复合的方式对TiO2进行改性修饰,提高了PDT对肿瘤细胞的灭活效率,但极少数研究者研究在PDT过程中引入外“加场”来增强光敏剂对白血病细胞的灭活效率。
本文通过引入具有较低生物毒性和良好分散性的半导体BiFeO3纳米颗粒[8,9],用溶胶凝胶法制备了核壳结构的BiFeO3@TiO2复合纳米颗粒,增强了TiO2的可见光响应,并且复合纳米颗粒BiFeO3@TiO2的半导体异质结形成的内电场降低了电子空穴复合率[10-12],此外,在保证磁场强度不直接损伤细胞的情况下,一定大小的弱稳恒磁场能够影响纳米颗粒光催化过程中电子空穴的迁移以及活性氧自由基的生成速率[13-18]。本文试验证明了弱稳恒磁场环境能够增强BiFeO3@TiO2复合纳米颗粒体外光动力疗法灭活HL60细胞的效果。
1 材料与方法
1.1 细胞株
早幼粒细胞白血病的细胞系(HL60),由中山大学动物中心细胞库提供。
1.2 试剂与仪器
钛酸丁酯,硝酸铁(FeN3O9·9H2O),硝酸铋(BiN3O9·5H2O),乙二醇甲醚,无水乙醇,台盼蓝试剂(美国Invitrogen),CCK-8试剂(日本同仁化学研究所),RPMI-1604培养基(美国Gibco),活性氧检测试剂(普利莱)。
X射线粉末演示仪(德国Bruker),JEM-2100HR透射电子显微镜(日本JEOL),UV-1700紫外可见分光光度计(日本Shimadzu),WFY-28型荧光分光光度计(天津拓普),SK2510LHC超声仪(上海科导),磁力加热搅拌器(江苏科析),超微振荡器(姜堰新康),Countesstm型自动细胞计数仪(美国Invitrogen),酶标仪(美国Bio Rad),SW-CJ型洁净工作台(苏州安泰),HH·CP-TW(80 L)二氧化碳培养箱(上海一恒科技),PDT反应室(自行设计),96孔板及细胞计数板等其它常规器皿。
1.3 试验方法
1.3.1 制备复合纳米颗粒BiFeO3@TiO2
BiFeO3的制备:称取2.425 g硝酸铋(BiN3O9·5H2O)溶解于20 mL乙二醇甲醚中,常温下磁力搅拌30 min得到A溶液;称取2.02 g硝酸铁(FeN3O9·9H2O)溶解于20 mL乙二醇甲醚中,常温下磁力搅拌30 min得到B溶液;将A、B溶液混合,常温下磁力搅拌2 h后得到混合液C溶液;将C溶液置于鼓风干燥箱内90 ℃下15 h成干凝胶,取出研磨成粉装入陶瓷坩埚,置于马弗炉中以1 ℃/min的升温速率升到550 ℃后保温4 h,自然冷却后取出,得到BiFeO3纳米颗粒。
BiFeO3@TiO2的制备:称取0.5 g的BiFeO3溶于15 mL无水乙醇磁力搅拌1 h;量取2.2 mL的钛酸四丁酯加入其中,恒温40 ℃超声水浴1 h,之后置于鼓风干燥箱90 ℃下10 h;取出研磨装入陶瓷坩埚,置于马弗炉中以5 ℃/min的升温速率升到500 ℃后保温2 h,自然冷却后取出,得到BiFeO3与TiO2质量比为1∶1的BiFeO3@TiO2复合纳米颗粒,标记为样品1。重复此试验方法,制备BiFeO3与TiO2质量比为1∶2和2∶1的BiFeO3@TiO2复合纳米颗粒,对应标记为样品0.5和样品2。
1.3.2 BiFeO3@TiO2复合纳米颗粒的表征手段
用透射电子显微镜(transmission electron microscope,TEM)对BiFeO3@TiO2复合纳米颗粒进行成像分析,检测样品的尺寸以及样品分散性;X射线衍射(X-ray diffraction,XRD)仪检测样品的衍射峰,根据衍射图谱检测样品组成;荧光光谱(fluorescence spectre,FS)分析其激发光谱范围、发射光谱范围和强度等。
1.3.3 HL60细胞的培养与计数
将HL60细胞置于RPMI-1640完全培养基中,把整个培养基放入37 ℃、5%CO2、95%空气湿度的二氧化碳培养箱中培养。培养适当时间后,取处于对数生长期的细胞进行试验,换液打散至细胞液均匀,将此细胞液与台盼蓝按照1∶1的体积比例混合,使用Countesstm型自动细胞计数仪计数。
1.3.4 弱稳恒磁场增强BiFeO3@TiO2的复合纳米颗粒PDT体外灭活HL60细胞的试验
根据试验内容对96孔板进行试验设计规划,试验分为遮光组和光照组。遮光组包括:遮光板(A板)、遮光磁场板(B、C、D板)。光照组包括:光照板(E板)和光照磁场板(F、G、H板)。每个板设置试验组和对照组。为了减少试验误差,同一条件设置3个重复孔。取对数生长期浓度为2×105个/mL的HL60细胞接种在已经规划好的96孔板中。试验组和对照组中每孔接种100 μL的细胞液。试验组中各孔按照规划加入终值质量浓度为50 μg/mL的TiO2和质量比为2∶1、1∶1、1∶2的BiFeO3@TiO2溶液100 μL,而对照组中加入血清含量为10%的RPMI-1640培养液100 μL,每孔的总体积为200 μL。把96孔板放到微量震荡仪中震荡5 min,用无水乙醇擦拭消毒96孔板后置于培养箱中培养。其中,遮光磁场板(B、C、D板)在培养12 h后,B、C、D板外加磁场分别对应为5、10、20 mT各1 h,光照板(E板)在培养12 h后,置于波长为410 nm、光功率密度为5 mW/cm2的光动力辐照室中光照1 h;光照磁场板(F、G、H板)在培养12 h后,置于相同光动力辐照室中光照且外加磁场强度分别为5 mT(F板)、10 mT(G板)、20 mT(H板)下各1 h,而遮光板(A板)则避光处理连续培养12 h。然后每孔加入20 μL的CCK-8试剂[19],震荡均匀后用无水乙醇擦拭消毒,置于培养箱再培养2 h。使用酶标仪,以450 nm为测量波长,630 nm为参比波长,对上述各板的试验组和对照组进行细胞活性的吸光度检测。
1.3.5 数据处理与分析
试验数据主要采用Origin8.0,Mathtype,SPSS24.0软件进行处理,结果用(均值±标准差)表示,如下是本试验所用到的公式[20]:
计算细胞相对存活率的公式:
(1)
式中ODcontrol为对照组的OD值;ODtreat为试验组的OD值。
计算PDT效率的公式:
(2)
式中ODirradiation为光照组的OD值;ODwithout-irradiation为遮光组的OD值。
2 结果与分析
2.1 复合纳米颗粒BiFeO3@TiO2的表征
2.1.1 TEM成像分析
通过溶胶凝胶法制备的BiFeO3与TiO2质量比为2∶1、1∶1、1∶2的BiFeO3@TiO2复合纳米颗粒的TEM图像如图1所示。样品0.5对应图1a、1b、1c,样品2对应图1d,样品1对应图1e,图1c中晶格间距0.39、0.27 nm分别对应BiFeO3的(101)面和(110)面,晶格间距0.35 nm对应锐钛矿TiO2的(101)面。从图1a、1b、1d、1e中可以看出BiFeO3颗粒被TiO2壳包裹,具有一定分散性,粒径在20~90 nm之间,均小于100 nm,满足纳米颗粒进入细胞的尺寸条件,符合光敏剂的尺寸要求。

图1 BiFeO3@TiO2纳米颗粒的TEM图Fig.1 TEM images of BiFeO3@TiO2 nanoparticles(a)BiFeO3@TiO2样品0.5的TEM图;(b)BiFeO3@TiO2样品0.5的TEM图;(c)BiFeO3@TiO2样品0.5的TEM局部放大图,白色线代表BiFeO3,红色线代表TiO2;(d)BiFeO3@TiO2样品2的纳米颗粒TEM图;(e)BiFeO3@TiO2样品1的TEM图(a)TEM image of BiFeO3@TiO2 sample 0.5;(b)TEM image of BiFeO3@TiO2 sample 0.5;(c)Zoomed up TEM image of BiFeO3@TiO2 sample 0.5,white lines represent BiFeO3 and red lines represent TiO2;(d)TEM image of BiFeO3@TiO2 sample 2;(e)TEM image of BiFeO3@TiO2 sample 1
2.1.2 XRD分析
TiO2、BiFeO3@TiO2纳米颗粒的X射线衍射谱如图2所示。由曲线1可见,在2θ=25.28°、37.80°、48.05°、53.89°、55.06°、62.69°等处出现了属于锐钛矿(101)、(004)、(200)、(105)、(211)、(204)晶面的衍射峰,曲线2在2θ=22.49°、31.80°、32.13°、39.50°、45.81°、51.37°、57.12°等处出现了属于BiFeO3(101)、(012)、(110)、(021)、(202)、(113)、(300)晶面的衍射峰,峰型尖锐且无其他杂质峰。曲线3~5是不同质量比复合纳米颗粒BiFeO3@TiO2的衍射谱,均出现TiO2以及BiFeO3的特征峰。

图2 TiO2,BiFeO3@TiO2纳米颗粒的X射线衍射谱Fig.2 XRD patterns of TiO2, BiFeO3@TiO2 nanoparticles
2.1.3 荧光激发光谱及光源分析
BiFeO3@TiO2纳米颗粒在波长为630 nm的荧光激发光谱如图3a所示。图3b是BiFeO3@TiO2纳米颗粒在410 nm处的荧光激发光谱放大图。而本实验室所使用的光动力辐照室的LED光源的发射光谱如图3c所示,其发射峰为410.23 nm,光动力辐照室LED阵列的发光光谱与BiFeO3@TiO2复合纳米颗粒在410 nm处的激发峰能够很好地匹配,满足可见光激发此纳米材料的条件。
2.2 暗室条件下,弱稳恒磁场对HL60细胞的活性影响
从图4中可以看出,暗室条件下,强度为5、10、20 mT的弱稳恒磁场在较短时间内对比没有磁场作用的HL60细胞的活性没有显著影响,弱稳恒磁场本身在短时间内对细胞的生长无明显促进或抑制作用。
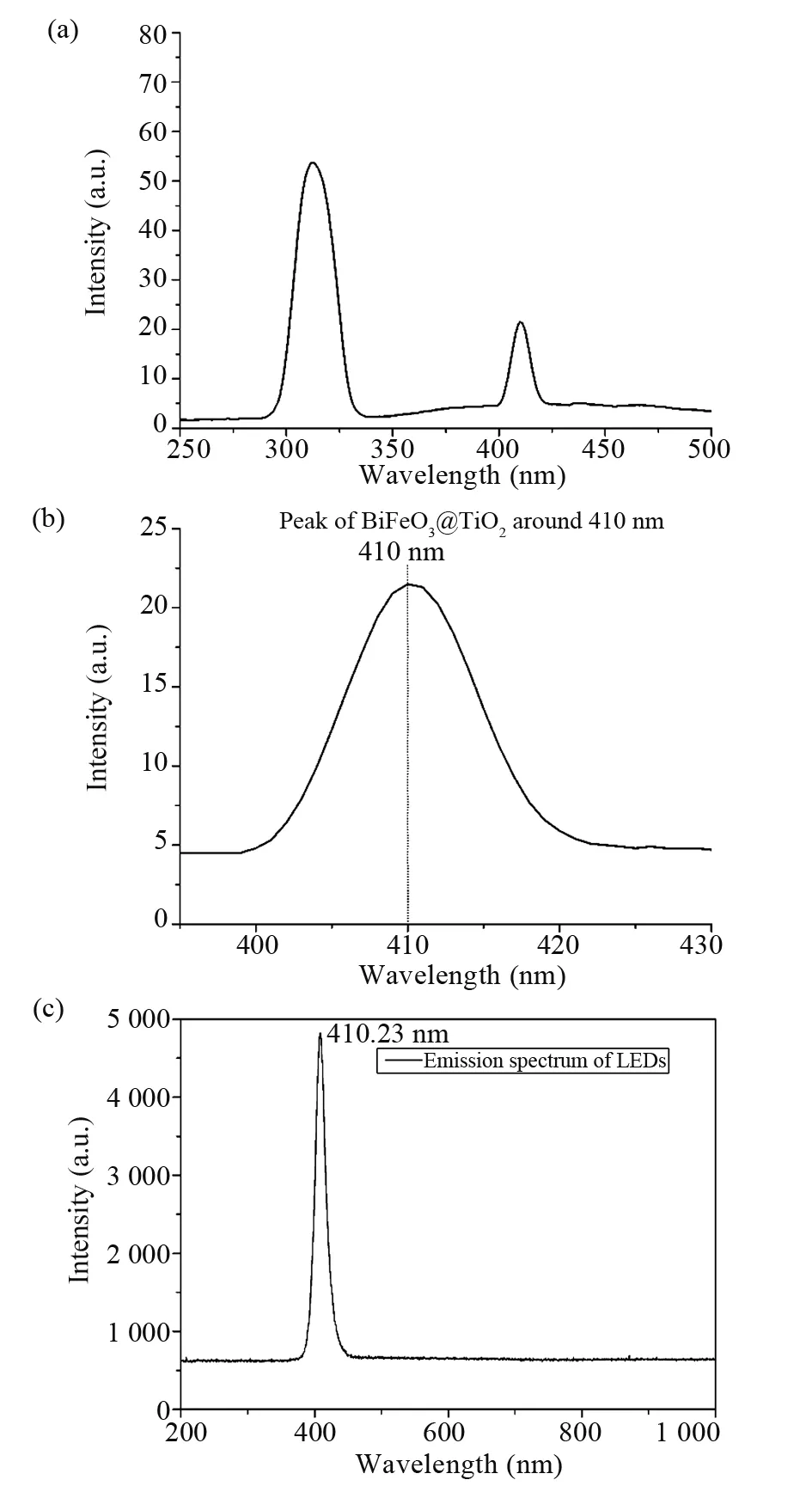
图3 纳米颗粒的荧光激发光谱与光动力试验箱LED阵列的发射光谱Fig.3 Fluorescence excitation spectra of nanoparticles andemission spectrum of LEDs of PDT irradiation chamber(a)BiFeO3@TiO2纳米颗粒的荧光激发光谱;(b)BiFeO3@TiO2纳米颗粒的荧光激发光谱局部放大图;(c)光动力试验箱LED阵列的发射光谱(a)Fluorescence excitation spectra of BiFeO3@TiO2nanoparticles;(b)Zoomed up fluorescence excitation spectra of BiFeO3@TiO2 nanoparticles;(c)Emission spectrum of LEDs of PDT irradiation chamber

图4 磁场强弱对HL60细胞OD值的影响(P>0.05)Fig.4 Effect of magnetic field strength on OD value of HL60 cells(P>0.05)
2.3 暗室条件下,弱稳恒磁场作用下BiFeO3@TiO2复合纳米颗粒对HL60细胞的毒性试验
根据公式(1)计算HL60细胞的相对存活率,暗室条件下,如图5所示,在没有磁场作用下,可发现,样品2、样品1、样品0.5、样品TiO2对应细胞的相对存活率分别为78%、81%、85%、94%。复合纳米颗粒BiFeO3@TiO2具有较低的生物毒性,并且随着TiO2外壳厚度的增加,生物毒性越来越低,样品0.5处理的细胞组在暗室条件下,细胞的相对存活率最高达到85%。
对于暗室条件下有弱稳恒磁场存在,磁场强度为5、10、20 mT时,样品TiO2对应细胞相对存活率分别为92%、93%、91%;样品2对应的细胞相对存活率分别为79%、78%、77%;样品1对应细胞相对存活率分别为82%、80%、81%;样品0.5对应细胞的相对存活率分别为84%、83%、84%。由此可知,在不同强度弱稳恒磁场作用下,各个样品对各自细胞组的相对存活率影响无显著性差异。此外,由图5对比可看出,在暗室条件下,有无弱稳恒磁场对复合纳米颗粒BiFeO3@TiO2作用的细胞活性无明显影响。
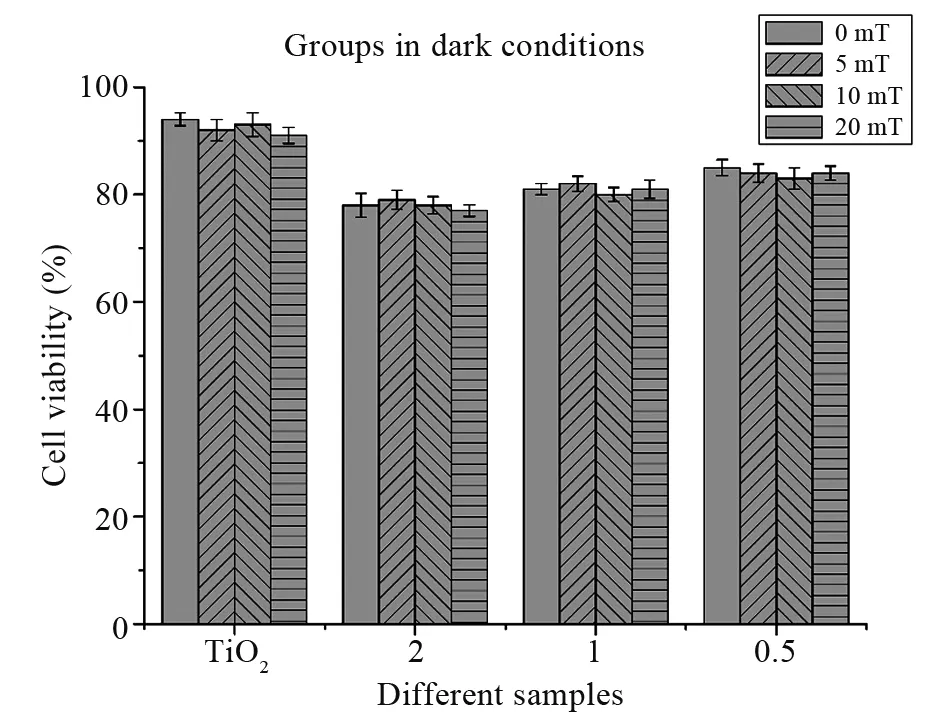
图5 暗室条件与弱稳恒磁场作用下不同外壳厚度BiFeO3@TiO2纳米颗粒作用的HL60细胞相对存活率(P>0.05)Fig.5 Viability of HL60 cells treated with BiFeO3@TiO2nanoparticlesin different shell thickness under darkroom conditions and weak stable magnetic field(P>0.05)
2.4 光照条件下,BiFeO3@TiO2复合纳米颗粒对HL60细胞存活率的影响
如图6所示,在药物终值质量浓度为50 μg/mL处理的HL60细胞中,光照组细胞的相对存活率明显低于遮光组。此外,由图看出,光照组在光照条件一致情况下,同一浓度不同纳米颗粒作用的HL60细胞相对存活率依次为:样品0.5<样品1<样品2<样品TiO2,表明复合纳米颗粒BiFeO3@TiO2有效提高了PDT的灭活效率,其中样品0.5组对HL60细胞的PDT灭活效果最佳。

图6 光照条件下,不同外壳厚度的BiFeO3@TiO2纳米颗粒作用的HL60细胞相对存活率(P<0.05)Fig.6 Viability of HL60 cells treated with BiFeO3@TiO2nanoparticlesin different shell thickness under light exposure(P<0.05)
2.5 光照条件下,弱稳恒磁场作用下BiFeO3@TiO2复合纳米颗粒对HL60细胞存活率的影响
从图7a中可以看出,光照条件下,没有外加磁场作用时的复合纳米颗粒BiFeO3@TiO2处理的HL60细胞的相对存活率高于有外加磁场作用情况下的细胞组。对于光照条件下且有外加磁场作用的细胞组而言,磁场强度为5、10、20 mT时,TiO2对应细胞相对存活率分别为85%、82%、80%;样品2对应的细胞相对存活率分别为38%、35%、33%;样品1对应细胞相对存活率分别为32%、30%、28%;样品0.5对应细胞相对存活率分别为24%、20%、18%。

图7 HL60细胞的相对存活率与PDT灭活效率Fig.7 Viability and the PDT efficiency of HL60 cells(a)光照条件与弱稳恒磁场作用下不同外壳厚度BiFeO3@TiO2纳米颗粒作用的HL60细胞相对存活率(P<0.05);(b)弱稳恒磁场作用下不同外壳厚度BiFeO3@TiO2纳米颗粒对HL60细胞的PDT灭活效率(P<0.05) (a)Viability of HL60 cells treated with BiFeO3@TiO2 nanoparticlesin different shell thickness under light exposure and weak stable magnetic field(P<0.05);(b)The PDT efficiency of BiFeO3@TiO2 nanoparticles in different shell thickness on HL60 cells under weak stable magnetic field(P<0.05)
如图7b所示,根据公式(2)可计算出HL60细胞的PDT灭活效率。光照条件下,没有磁场作用时,样品TiO2、样品2、样品1、样品0.5对应的PDT灭活效率分别为7%、47%、54%、67%。光照条件下,磁场强度为5 mT时,样品TiO2、样品2、样品1、样品0.5对应的PDT灭活效率分别为8%、52%、61%、71%。光照条件下,磁场强度为10 mT时,样品TiO2、样品2、样品1、样品0.5对应的PDT灭活效率分别为11%、55%、63%、76%。光照条件下,磁场强度为20 mT时,样品TiO2、样品2、样品1、样品0.5对应的PDT灭活效率分别为13%、57%、65%、78%。对同一浓度的同一样品而言,光照磁场组的细胞灭活效率高于光照组,而光照磁场组的细胞灭活效率又随着磁场强度的增强而提高。对同一浓度的不同样品而言,在同一光照条件与磁场强度作用下,HL60细胞的PDT灭活效率为:样品TiO2<样品2<样品1<样品0.5,终值质量浓度为50 μg/mL的样品0.5处理的HL60细胞在20mT弱稳恒磁场作用下的PDT灭活效率最高达到78%。
2.6 纳米颗粒PDT体外灭活HL60细胞机理分析
在PDT过程中,光敏剂能吸收特定波长的光子而从基态跃迁到激发态,然后将吸收的能量转移到附近的氧气分子产生单线态氧,或者与周围的物质通过电子转移发生光化学反应产生活性氧自由基,因此光敏剂介导产生的活性氧(reactive oxygen species,ROS)起到了关键作用[21]。
本文光敏剂主要是通过电子转移产生更多的活性氧物质,来提升光动力疗法的治疗效果,因此光敏剂在410 nm荧光激发时,电子空穴复合率的降低可以提高光动力疗法效率。如图8的荧光发射光谱图所示,光敏剂的荧光强度与电子空穴的复合率相关,光敏剂的电子空穴复合率越高则荧光强度值越大,反之亦然[22]。由图8可看出,在没有弱稳恒磁场作用下,样品2、样品1、样品0.5均比样品TiO2的荧光强度低,原因是半导体BiFeO3的引入使得复合纳米颗粒BiFeO3@TiO2存在半导体异质结构,从而形成一个内电场使得电子空穴有效分离,降低了电子空穴复合率,其中样品0.5的荧光强度最弱,电子空穴复合率最低。此外在20 mT弱稳恒磁场作用下,光敏剂的荧光强度相对于没有磁场作用时也有所降低,也就是说弱稳恒磁场也能使电子空穴有效分离,进一步降低电子空穴复合率,从而提高活性氧产量增强光动力疗法的治疗效果。
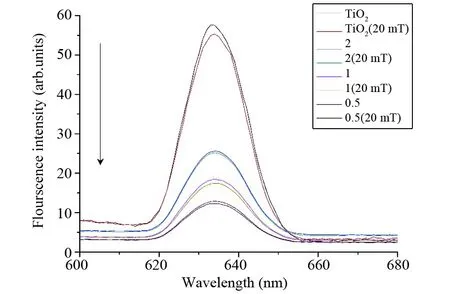
图8 不同外壳厚度BiFeO3@TiO2纳米颗粒的荧光发射光谱(λex=410 nm)Fig.8 Fluorescence emission spectra of BiFeO3@TiO2 nanoparticles in different shell thickness (λex=410 nm)
3 讨论
本文探究了弱稳恒磁场环境下基于BiFeO3@TiO2复合纳米颗粒体外光动力疗法灭活HL60细胞的试验研究。采用溶胶凝胶法制备了核壳结构的BiFeO3@TiO2复合纳米颗粒,用TEM、XRD、FS对该光敏剂的粒径、核壳结构、成分组成和激发光谱等性质进行表征,结果表明,BiFeO3@TiO2复合纳米颗粒粒径在90 nm左右,满足光动力细胞试验的要求。细胞试验表明,复合纳米颗粒BiFeO3@TiO2在暗室条件下具有较低的生物毒性,随着TiO2壳厚度的增加,生物毒性降低。
半导体BiFeO3的引入使得复合纳米颗粒BiFeO3@TiO2能被410 nm的可见光所激发,并且其形成的半导体异质结构使得光敏剂在特定波长光激发下的电子空穴复合率降低。此外,由荧光发射光谱图间接表明,外加弱稳恒磁场能进一步使电子空穴复合率降低,弱稳恒磁场能够影响光敏剂光催化过程中电子空穴的迁移,使得电子空穴有效分离,光敏剂与周围的物质通过电子转移发生光化学反应产生活性氧自由基。已有研究表明ROS对肿瘤细胞的直接毒性能使其坏死或诱导其凋亡、自噬,所以弱稳恒磁场环境下光生电子和空穴的分离效率更高,产生的ROS更多,PDT过程对HL60细胞的灭活效率就更高[13-18,20-22]。并且细胞PDT试验显示,没有稳恒磁场作用的细胞组PDT效率明显低于有稳恒磁场作用的细胞组,同时随着弱稳恒磁场作用的增强,PDT效率也随之提高。在本文试验中,磁场强度分别为5、10、20 mT的弱稳恒磁场环境下的PDT试验显示,在磁场强度为20 mT的弱稳恒磁场环境下,PDT效率最高,如果继续增大弱稳恒磁场强度,PDT效率是否随之提高也是我们接下来需要展开的研究工作。
综合以上分析,弱稳恒磁场环境能够有效增强具有核壳结构的BiFeO3@TiO2复合纳米颗粒体外光动力疗法灭活HL60细胞的效果,同时为弱稳恒磁场环境下光敏剂体外光动力灭活白血病细胞提供了一定试验数据,但如使其应用于临床,仍需我们在后续工作中进一步深入研究弱稳恒磁场环境的影响机理。
